
- •Лекция № 13. Электрический ток в электролитах и газах.
- •I.Электрическая диссоциация молекул в растворах. Закон Ома для жидкостей.
- •II. Электролиз.Законы Фарадея.
- •Законы электролиза (Фарадея).
- •III.Электропроводность газов.Подвижность газовых ионов.
- •IV.Теория самостоятельного и несамостоятельного разряда в газах.
- •1. Пробой газа происходит при постоянном для каждого газа отношении напряженности поля к давлению газа:
- •2. Условие перехода несамостоятельного разряда в самостоятельный:
- •V.Виды самостоятельных газовых разрядов.Катодные и каналовыелучи.Понятие о призме.
- •1. Тлеющий разряд.
- •Описание тлеющего разряда:
- •2. Разряды при нормальных давлениях:
- •3. Катодные и каналовые (анодные) лучи.
- •4. Плазма.
Лекция № 13. Электрический ток в электролитах и газах.
I.Электрическая диссоциация молекул в растворах. Закон Ома для жидкостей.
При прохождении тока через проводники 2-го класса на электродах происходит выделение вещества (химические процессы) – электролиз.
|
|
Схема опыта по исследованию проводимости водных растворов различных веществ. |
Прохождение тока в растворах объясняется появлением ионов.
Распад молекул на ионы называется электролитической диссоциацией, он происходит при растворении вещества.
Теория электролитической диссоциации разработана Р. Клаузиусом (1857 г.) и разработана С. Аррениусом (1887 г.). Большое значение имеют также работы русского ученого И.А. Каблукова.
Наряду с диссоциацией при соударениях возможны обратные процессы воссоединения разноименных ионов в нейтральные молекулы – рекомбинацияилимолизация.
|
В установившемся электролите всегда существует динамическое равновесие |
К Щ С |
Способность диссоциировать у различных жидкостей – различна. Для количественной характеристики степени диссоциации вводится коэффициент степень диссоциации α.
α – определяется соотношением числа диссоциированных молекул, т.е. он показывает – какая доля молекул растворенного вещества распалась на ионы.
α зависит: 1) от природы растворителя;
2) от природы растворяемого вещества;
3) от концентрации раствора;
4) от температуры.
Электрический ток в жидкостях обусловлен упорядоченным движением ионов. При отсутствии внешнего поля ионы в электролите совершают тепловое движение.
При перемещение иона возникает сила трения, пропорциональная средней скорости движения иона:
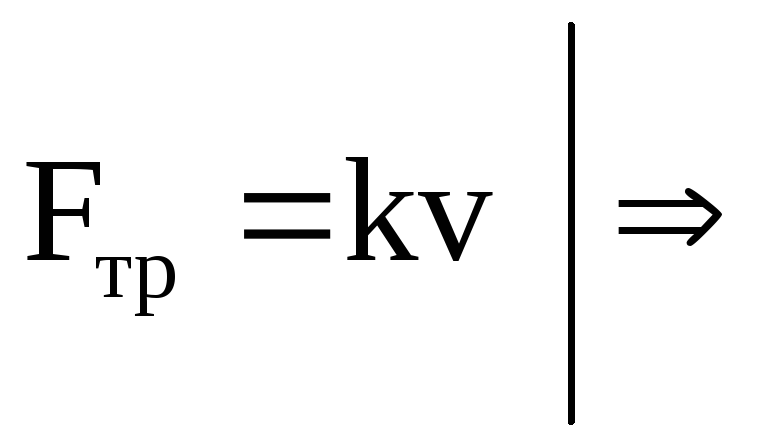
![]() ,
,
где k– коэффициент трения.
С другой стороны движение иона происходит под действием электрической силы:
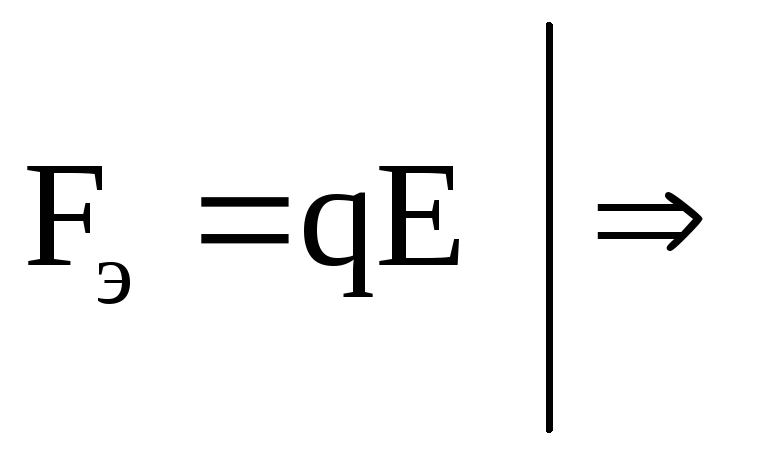
![]()
Для установившегося режима:

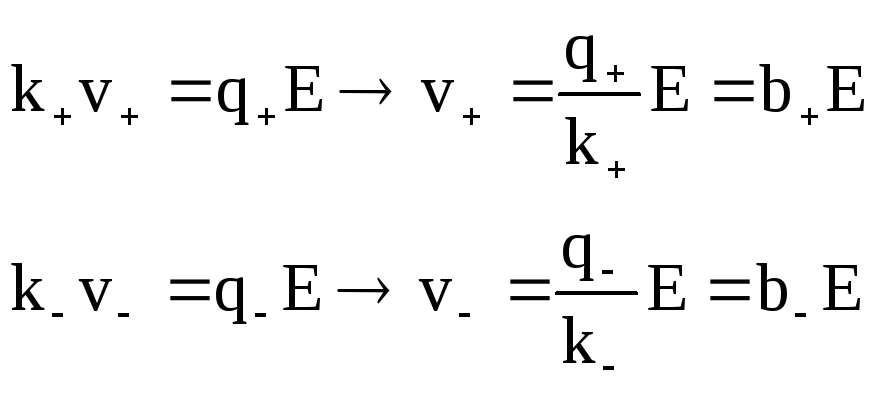 ,
,
где b– подвижность ионов.
Подвижность – скорость ионов при Е=1
![]()
Плотность тока в электролите равна:
j=j++j–![]()
![]() ,
,
где n– концентрация ионов.
Для бинарных электролитов справедливо:
n+=n–=n,
где – коэффициент диссоциации;
n– число молекул растворенного вещества в единице объема электролита.
Полагая также q+=q–=q, имеем:
j=αnqv++αnqv–=αnq(v++v–)
Учитывая, что v+=b+E;v–=b–E
![]() –закон Ома для электролитов(1)
–закон Ома для электролитов(1)
Сравнивая эту формулу с дифференциальной формой закона Ома j=E, получим:
γ = nq(b+ + b–)
II. Электролиз.Законы Фарадея.
При пропускании тока через электролитическую ванну электронные потоки в электродах замыкаются ионными потоками электролита. При этом у анода будет происходить превращение анионов в нейтральные атомы с отдачей электронов аноду; у катода – превращение катионов в нейтральные атомы с получением электронов от катода.
У поверхности электродов происходит выделение веществ – это сущность электролиза.
Законы электролиза (Фарадея).
|
1 закон |
Масса вещества, выделившегося на электроде, прямопропорциональна заряду, прошедшему через электролит. |
![]() , (2)
, (2)
где k– электрохимический эквивалент.
|
2 закон |
Электрохимические эквиваленты прямопропорциональны их химическим эквивалентам х. |
![]() , (3)
, (3)
где ![]() :
А – атомный вес вещества,Z– его валентность.
:
А – атомный вес вещества,Z– его валентность.
![]() – число Фарадея – равно электрическому
заряду, который нужно пропустить через
электролит для выделения на электроде
1 моля вещества.
– число Фарадея – равно электрическому
заряду, который нужно пропустить через
электролит для выделения на электроде
1 моля вещества.
![]()
|
3 закон |
Объединенный закон. |
![]() (4)
(4)
Применение электролиза:
получение металлов в электрометаллургии (расплавы) Na,Al
Очистка или рафинирование металлов (Cu)
Электролитическое разложение воды на Н2и О2
Гальванопластика (изображение предметов)
Гальваностегия (покрытия)
Электролитическая полировка


 ислоты:HClH++Cl–
ислоты:HClH++Cl– елочи:
NaOH Na+
+ OH–
елочи:
NaOH Na+
+ OH– оли:NaClNa+
+Cl–
оли:NaClNa+
+Cl–