
IV.Теорема Нернста.
Выражение
![]() определяет не саму энтропию, а разность
двух состояний. Нернст дал возможность
определить энтропию в любом состоянии,
выбрав за точку отсчета абсолютный
нуль.
определяет не саму энтропию, а разность
двух состояний. Нернст дал возможность
определить энтропию в любом состоянии,
выбрав за точку отсчета абсолютный
нуль.
Теорема Нернста:
|
При стремлении абсолютной температуры к нулю энтропия любого тела также стремится к нулю: |
![]()
Согласно этой теореме энтропия любого тела при абсолютном нуле равна нулю. Тогда энтропия тела в состоянии с температурой Т имеет вид:
![]()
Например:
известна Сркак функция температуры, тогда:
![]()
V.Энтропия и вероятность. Философское значение второго закона термодинамики.
Процессы, изучаемые термодинамикой, рассматриваются и статистической физикой. Это рассмотрение приводит к другим результатам, чем те, к которым приходит термодинамика.
|
Процессы, невозможные по второму закону (переход тепла от холодного тела к нагретому), в статистической физике являются не невозможными, а очень мало вероятными. |
Связь Sс вероятностьюwустановлена Больцманом
![]()
|
Энтропия пропорциональна логарифму вероятности состояния или: Все процессы в природе протекают в направлении, приводящем к увеличению вероятности состояния. |
Пример:
1) постановка:
вычислить по изменению энтропии двух тел, находящихся при температурах Т1 = 3010К и Т2 = 3000К, отношение вероятностей пребывания тел в этих состояниях, если от одного тела к другому передается количество тепла в 1 эрг.
Решение:
а) переход тепла от 1 к 2
вероятность пребывания тела при температуре Т2–w2
вероятность пребывания тела при температуре Т1–w1
![]()
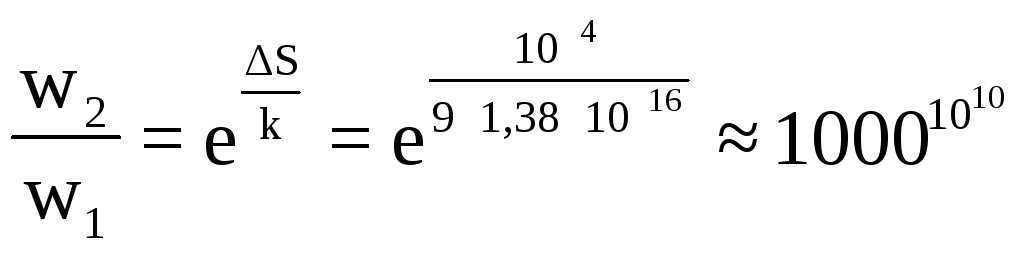 ,
,
т.е. на каждые
![]() случаев
перехода 1 эрг теплоты от тела с Т = 3010К
к телу с Т = 3000К приходится один
случай перехода тепла от 2 к 1.
случаев
перехода 1 эрг теплоты от тела с Т = 3010К
к телу с Т = 3000К приходится один
случай перехода тепла от 2 к 1.
б) переход тепла от 1 к 2 в количестве
![]() эрг
эрг
![]()
Вывод: для малых количеств тепла второй закон не применим.
Законы термодинамики нельзя применять к микромиру. Все реальные макроскопические процессы, происходящие в земных условиях, сопровождаются увеличением энтропии той системы, в которой они происходят.
Формулировка Клаузиуса второго закона термодинамики:
|
энтропия мира стремится к максимуму. |
Однако, как показано ранее, законы термодинамики нельзя применять к микромиру, так нельзя их обобщать и для явлений вселенной.
Такое обобщение привело к представлению о так называемой «тепловой смерти» вселенной.
Суть «тепловой смерти»:
во всех частях Вселенной любые процессы сопровождаются тем, что некоторое количество энергии различных видов превращается в теплоту, а теплота переходит от нагретых тел к холодным, т.е. происходит выравнивание температур, а следовательно развитие природы ведет к прекращению развития: все виды энергии превращаются в теплоту и в ней находят свою смерть.
Ф. Энгельс в своей книге «Диалектика природы» показал, что второй закон термодинамики нельзя понимать как универсальный принцип. Закон возрастания энтропии должен пониматься как частная закономерность, справедливая при определенных физических условиях.
