
III.Теорема Клаузиуса.Энтропия.
Формулу η идеальной тепловой машины, работающей по циклу Карно:
![]()
легко привести к виду
![]() (1)
(1)
Отношение количества переданного (полученного) тепла системой к температуре нагревателя (этого процесса) или холодильника (теплоприемника) называется приведенной теплотой.
Смысл уравнения (1): приведенные теплоты при процессах изотермического расширения и сжатия одинаковы.
Перепишем уравнение (1) в виде:
![]()
Будем считать, что отдаваемая системой теплота отрицательная, Qx< 0, тогда можем записать:
![]() (2)
(2)
Алгебраическая сумма приведенных теплот для обратимого цикла Карно равна нулю.
Если рассмотреть любой равновесный цикл, то легко показать, что его можно представить как совокупность циклов Карно, т.е.:
![]()
Теорема Клаузиуса(1854 г.): сумма приведенных теплот не зависит от пути перехода.
Согласно уравнения (2) для каждого элементарного процесса
![]() ,
а
,
а
в пределе для любого обратимого цикла:
![]() (3)
(3)
В случае необратимой тепловой машины (реальные тепловые машины), как показано в разделе II:
![]() ,
или
,
или![]() (4)
(4)
Можно показать![]() .
Объединяя (3) и (4) имеем:
.
Объединяя (3) и (4) имеем:
![]() –равенство (неравенство)
Клаузиуса (5)
–равенство (неравенство)
Клаузиуса (5)
справедливо для любого кругового процесса.

Для обратимого цикла 1а2б1 интеграл (5) можно представить в виде:
![]() или
или
![]() (6)
(6)
Независимость интеграла (6), выражающего сумму приведенных теплот для обратимого процесса, от пути следования процесса означает, что интеграл зависит лишь от начального и конечного состояния тела. Подынтегральное выражение является полным дифференциалом некоторой функции S, называемойэнтропия.
![]()
Как и внутренняя энергия, энтропия есть функция параметров системы P,V, и Т:
S = S(P,V,T)
Sимеет размерность теплоемкости.
|
Энтропия есть такая функция состояния системы, дифференциал которой связан с элементарным тепловым эффектом в обратимом процессе соотношением. |
dQ=TdS.
Согласно определения энтропии, имеем для обратимого процесса:
![]() , (7)
, (7)
т.е. приращение энтропии равно элементарному количеству тепла, полученному системой, к температуре, при которой тепло получается.
Для обратимого кругового процесса ∆S= 0.
Легко показать, что для необратимого процесса
![]()
Для необратимого кругового процесса ∆S> 0.
Для произвольного процесса имеем:
∆S≥ 0(8)
|
Энтропия изолированной системы при любых происходящих в ней процессах не может убывать (или постоянна, или возрастает). |
Энтропия – греческое слово «энтропос» – поворот, возвращение.
Следствие:
а) энтропия изолированной системы при обратимых процессах не изменяется
(∆S= 0)
б) энтропия изолированной системы при необратимых процессах возрастает
(∆S> 0)
в) все реальные процессы необратимы, энтропия их возрастает.
Возрастание энтропии определяет направление процесса (в сторону возрастания).
Второй закон термодинамики(ещё одна формулировка).
|
В изолированной системе при всех реальных процессах энтропия возрастает. |
Естественные процессы направлены к состоянию равновесия. А т.к. при этом энтропия увеличивается, то устойчивому равновесию изолированной системы соответствует максимальное значение энтропии.
Согласно уравнения (8), если система не изолирована (обмен теплом с внешней средой), то энтропия может вести себя любым образом (возрастать при получении тепла и убывать при отдаче).
Легко вычислить изменение энтропии системы при обратимом процессе, приводящем систему в состояние с одинаковой для обоих тел температурой Т0. Оно равно:
![]() ,
,
где Ст– теплоёмкость тел,
Т1и Т2– температуры тел (Т1>T2).
Объединим первый и второй законы термодинамики:
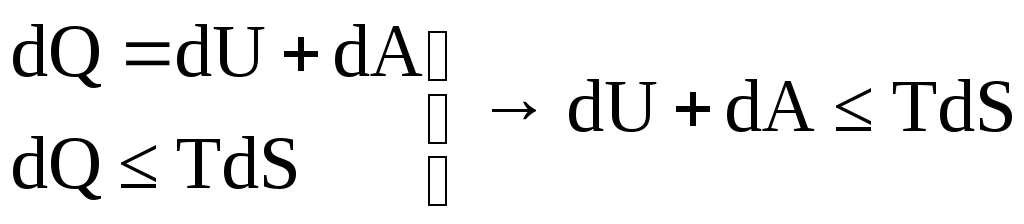
dA ≤ TdS–dU
dA ≥ dU – TdS = d(U – TS)
![]() (9)
(9)
Величина Fв уравнении (9) называетсясвободной энергиейи является функцией состояния.
Из соотношения (9) следует:
F– представляет ту часть внутренней энергии системы, которая превращается во внешнюю работу.
TS– называетсясвязанной энергией, определяет рассеяние энергии.
