
Физика
.pdf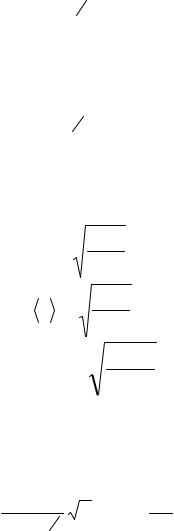
41
|
|
m |
|
|
|
1 |
|
exp{ |
|
mvx |
2 |
|
}. |
|||||
f ( vx ) = ( |
|
|
) |
|
2 |
− |
|
|
|
|||||||||
2π kT |
|
2kT |
||||||||||||||||
11. Функция распределения Максвелла по модулю скорости: |
||||||||||||||||||
f (v) = 4π ( |
|
m |
|
) |
3 |
2 |
v |
2 |
exp{ |
− |
mv2 |
|
}. |
|||||
2π kT |
|
|
2kT |
|
||||||||||||||
12. Скорость молекул: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
средняя квадратичная |
vc = |
|
|
|
3RT ; |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
µ |
|
|
|
|
|
|
|
|
средняя арифметическая |
v |
= |
|
|
|
8RT |
; |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
πµ |
|
|
|
|
|
|
|
|
наиболее вероятная |
v d |
= |
|
|
|
|
2 R T . |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
µ |
|
|
|
|
|
|
|
13. Функция распределения кинетической энергии поступательного движения для равновесного идеального газа:
f (ε) = |
2π |
|
|
ε |
( ) |
3 ε exp − |
. |
||
|
|
|
kT |
|
|
πkT |
2 |
||
|
|
|
|
|
14. Зависимость концентрации молекул в равновесном идеальном газе от коэффициента (Распределение Больцмана):
n(x, y, z) = no |
|
WΠ (x, y, z) |
|
exp − |
kT |
, |
|
|
|
|
|
где no - концентрация молекул в точке, в которой потенциальная энергия равна нулю,
WП(х,y,z) - потенциальная энергия молекул в точке с координатами x, y, z.
15. Барометрическая формула:
P(h) = Po |
|
mgh |
||
exp − |
|
, |
||
kT |
||||
|
|
|
||
где Ро - давление у поверхности Земли,

42
P(h) - давление на высоте h.
Термодинамика
1.Первое начало термодинамики. Работа. Теплоемкость.
16.Теплоемкость системы:
C = δdQT ,
где δQ- количество тепла, подведенное к системе, dT - увеличение температуры системы.
17. Удельная теплоемкость системы:
c = mC ,
где С - теплоемкость системы,
m- масса системы.
18.Молярная теплоемкость системы:
cµ = Cv ,
где v - число молей, содержащихся в системе.
19. Удельные теплоемкости газа при постоянном давлении (cp) и при постоянном объеме (cv) :
cp |
= |
i +2 |
|
R |
, |
cv |
= |
i |
|
R |
. |
|
|
|
|
|
|||||||
|
|
||||||||||
|
2 µ |
|
|
2 µ |
|||||||
20. Уравнение Майера, связывающее молярные теплоемкости:
cµp −cµV =R .
21. Первое начало термодинамики:

43
δQ = dU +δA,
где δQ - количество теплоты, сообщенное системе,
δА - работа, совершаемая системой против внешних сил, dU - изменение внутренней энергии системы.
22. Внутренняя энергия системы:
U = 2i vRT .
23. Работа системы в ходе произвольного процесса:
2 |
V 2 |
A = ∫δA = |
∫ PdV , |
1 |
V 1 |
|
где Р - давление газа,
dV - изменение объема
при изотермическом процессе:
A = |
m |
RT lnV 2 |
; |
|
|||
µ |
V 1 |
|
|
при изобарическом процессе:
A = p(V 2 −V 1)
при адиабатическом процессе:
|
A = −∆U = − |
m |
cµV ∆T |
|
|
|||||||
|
|
|
|
|||||||||
|
|
|
|
|
|
µ |
|
|
|
|
||
|
или A = |
RT1 |
|
m |
|
1 |
− V1 |
γ−1 |
|
, |
||
|
γ −1 µ |
|||||||||||
|
|
|
|
V2 |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
где С µV - молярная теплоемкость при постоянном объеме, |
||||||||||||
γ = cµP |
- показатель адиабаты. |
|
|
|
|
|
|
|
||||
cµV |
|
|
|
|
|
|
|
|
|
|
|
|
24. Уравнение Пуассона, связывающее параметры идеального газа при адиабатическом процессе:

44
PV γ = const ; TVγ −1 = const ; T P |
γ−1 |
=const, |
|
γ |
|
||
где γ - показатель адиабаты, равный отношению теплоемкости при постоянном давлении и объеме.
2.Второе начало термодинамики. Энтропия. Циклы.
25.Статистический вес равновесного идеального одноатомного газа:
Γ= (β V T3/ 2 )N ,
где V- объем газа,
Т- его температура, β - постоянная,
N - число молекул газа.
26. Связь между энтропией и статистическим весом:
S =klnΓ,
где k - постоянная Больцмана.
27. Изменение энтропии в произвольном процессе:
|
V2 |
|
i |
|
T2 |
|
|
∆S = Nk ln |
+ |
ln |
. |
||||
V1 |
|
|
|||||
|
2 |
|
T1 |
||||
28. Термодинамический смысл энтропии: dS = δTQ ,
где δQ - количество теплоты, подводимой к системе при температуре Т;
dS - изменение энтропии в результате этого процесса. 29. Изменение энтропии в равновесных процессах:
∆S = ∫ |
dS = ∫ |
δQ ; |
|
||||||||||
|
2 |
|
|
2 |
|
|
|
|
|
||||
|
1 |
|
|
1 |
|
|
T |
|
|
||||
изотермический процесс: ∆S = νR ln |
V2 |
|
; |
|
|
||||||||
V1 |
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
||||
изохорический процесс: ∆S = |
|
i |
νR ln |
|
T2 |
|
; |
|
|
||||
2 |
|
T |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
1 |
|
|
T2 |
|
||
изобарический процесс: ∆S = |
i + 2 |
|
νR ln |
. |
|||||||||
|
|
|
|
|
|||||||||
|
2 |
T |
|||||||||||
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
30. Изменение энтропии в процессах смены агрегатного состояния:
твердое тело ↔ жидкость: ∆S = ± λm ;
Tn

45
жидкость ↔ газ: ∆S = ± rm ,
Tk
где λ - удельная теплота плавления, m - масса вещества,
Tn - температура плавления,
r - удельная теплота испарения, Tk - температура испарения,
знак “+” относится к плавлению и испарению, знак “−” - к отвердеванию и конденсации.
31. Коэффициент полезного действия тепловой машины:
η = A = Q1 − Q2 ,
Q1 Q1
где А - работа совершаемая машиной за цикл,
Q1 - количество тепла передаваемое нагревателем рабочему телу за цикл.
31. Максимальный (термический) коэффициент полезного действия идеальной тепловой машины:
ηmax = T1 T− T2 , 1
где T1 и T2 - абсолютные температуры нагревателя и холодильника.
5.2.2. Примеры решения задач.
Пример 1. Баллон содержит m1=80г кислорода и m2=320г аргона. Давление смеси р=1МПа, температура Т=300К. Принимая данные смеси за идеальные, определить объем V баллона.
Решение. По закону Дальтона, давление смеси равно сумме парциальных давлений газов, входящих в состав смеси. Парциальным давлением газа называется давление, которое производил бы этот газ, если бы только он один находился в сосуде, занятом смесью.
По уравнению Менделеева-Клапейрона, парциальные давления кислорода p1 и аргона p2 выражаются формулами:
P = |
m1 |
|
RT |
; P = |
m2 |
|
RT |
. |
µ1 |
|
V |
µ2 |
|
V |
|||
1 |
|
2 |
|
|
Следовательно, по закону Дальтона давление смеси газов
|
|
m1 |
|
m2 |
|
RT |
|
||
P = P + P , |
P = |
|
+ |
|
|
|
, |
||
µ1 |
µ2 |
V |
|||||||
1 |
2 |
|
|
|
|
||||
|
|
|
|
|
|
|
|||
откуда объем баллона
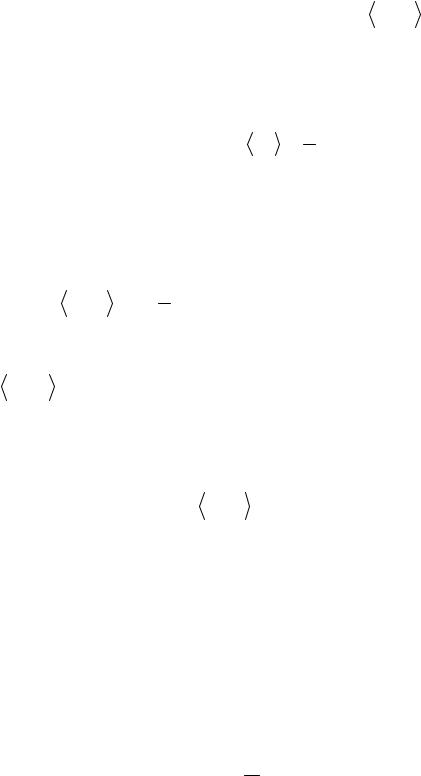
46
m1 |
|
m2 |
|
RT |
|
|
||
V = |
|
+ |
|
|
|
. |
(1) |
|
µ1 |
µ2 |
P |
||||||
|
|
|
|
|
||||
Подставим числовые значения в формулу (1) и произведем вычисления:
|
0.08 |
|
|
0.32 |
|
|
|
8.31 |
300 |
|
3 |
|
3 |
|
V = |
|
|
+ |
|
|
|
|
|
|
m |
|
= 0.0262m |
|
= 26.2 л. |
|
|
40 10 |
|
10 |
|
|
|
|||||||
32 10 |
−3 |
|
−3 |
|
|
6 |
|
|
|
|
|
|||
Пример 2. Найти среднюю кинетическую энергию |
wвращ вращатель- |
|||||||||||||
ного движения молекулы кислорода при температуре T=350 K, а также кинетическую энергию Ек вращательного движения всех молекул кислорода массой m=4г.
Решение. Известно, что на каждую степень свободы молекулы газа
приходится одинаковая средняя энергия w1 |
= |
1 kT , где k- постоянная |
|
|
2 |
Больцмана; Т - абсолютная температура газа. Так как вращательному движению двухатомной молекулы (молекула кислорода - двухатомная) соответствуют две степени свободы, то средняя энергия вращательного движения молекулы кислорода выразится формулой
wвращ |
= 2 |
1 kT . |
|
|
2 |
Подставим в формулу значение k= 1,38. 10-23 Дж/К и Т=350 К, получим
wвращ = 1,38 10−23 350Дж = 4,83 10-21 Дж .
Кинетическая энергия вращательного движения всех молекул газа определяется равенством
Eк = wвращ N .
Число всех молекул можно вычислить по формуле
N = N A v ,
где NA - число Авогадро;
v - количество вещества.
Если учесть, что количество вещества v = m µ, где m - масса газа; µ - молярная масса газа, то
µ, где m - масса газа; µ - молярная масса газа, то
N = N A mµ .

47
Подставим N в Е к, получим
|
|
|
|
Eк |
|
µ |
|
|
|
|
|
|
|
= N A m wвращ . |
|
||||
Подставим числовые значения , найдем |
|
|
|||||||
|
|
23 |
|
4 10−3 |
−21 |
|
|||
Eк = 6 |
,02 10 |
|
|
|
|
|
4,83 10 |
|
Дж = 364 Дж . |
|
32 |
10 |
−3 |
|
|||||
|
|
|
|
|
|
|
|
||
Пример 3. Кислород массой m=2 кг занимает объем V1= 1 м3 и находится под давлением p1 = 0,2 МПа. Газ был нагрет сначала при постоянном давлении до объема V2 =3 м3, а затем при постоянном объеме до давления р3 = 0,5 МПа. Найти изменение ∆U внутренней энергии газа и теплоту Q, переданную газу.
Решение. Изменение внутренней энергии газа выражается формулой
∆U = cV m∆T = |
i |
|
R |
m∆T , |
|
2 µ |
|||||
|
|
||||
где i - число степеней свободы молекул газа ( для двухатомных молекул кислорода i=5); µ - молярная масса.
Начальную и конечную температуру газа найдем из уравнения Менделее-
ва-Клапейрона PV = mµ RT :
T = PVmRµ .
Подставляя числовые данные, получим:
Т1=385 К, Т2=1155 К, Т3=2887 К.
Отсюда изменение внутренней энергии равно:
∆U = |
5 8 ,31 |
|
2(2887 − 385) = 3,24МДж . |
||
|
|
|
|
||
2 32 10 |
−3 |
||||
|
|
|
|||

48
Согласно первому началу термодинамики, теплота Q, переданная газу, равна сумме изменения внутренней энергии ∆U и работы, совершенной газом.
Работа газа, нагреваемого при постоянном объеме, равна нулю. Следовательно, полная работа, совершаемая газом, равна работе расширения газа при постоянном давлении:
A = R mµ ∆T = R mµ (T2 − T1),
Подставив числовые данные, получим
A = 0,4 106 Дж = 0,4 МДж .
Следовательно,
Q = A + ∆U = 0,4 106 + 3,24 106 = 3,64 106 Дж = 3,64 МДж .
Пример 4. В цилиндре под поршнем находится водород массой m=0,02 кг при температуре Т=300К. Водород сначала расширился адиабатически, увеличив свой объем в n1=5 раз, а затем был сжат изотермически, причем объем газа уменьшился в n2 =5 раз. Найти температуру в конце адиабатического расширения и работу, совершенную газом при этих процессах.
Решение. Температура и объем газа, совершающего адиабатический процесс, связаны между собой соотношением
T2 |
V1 γ−1 |
|
T2 |
= |
1 |
|
|
T1 |
= |
|
, или |
T1 |
|
, |
|
γ−1 |
|||||||
V2 |
|
|
|
n |
|||
где γ - отношение теплоемкостей при постоянном давлении и постоянном объеме: γ = 1,4 для водорода как для двухатомного газа.
Поскольку |
n1 |
= |
V 2 |
= 5 ,получим для конечной температуры Т2 следую- |
|||
V 1 |
|||||||
щую формулу: |
|
|
|
|
|
||
|
|
|
|
T1 |
|
||
|
|
|
|
T2 = |
. |
||
|
|
|
|
γ −1 |
|||
|
|
|
|
|
n1 |
||
Подставляя числовые данные, находим, что Т2=157К.

49
Работа А1 газа при адиабатическом расширении определяется по форму-
ле:
1 = |
2 |
PdV = m µV ( |
1 |
− |
|
2)= m i R( 1 − |
2), |
|||||||
A |
∫ |
|
|
c |
T |
|
T |
|
|
|
|
|
T |
T |
|
µ |
|
|
µ 2 |
||||||||||
|
1 |
|
|
|
|
|
|
|||||||
где cµv - молярная теплоемкость при постоянном объеме. Подставив числовые значения R, i, µ, m, T1 и T2 , получим
A1 = 2,98 104 Дж .
Работа А2 газа при изотермическом процессе вычисляется по формуле
|
|
|
A2 |
= ∫ PdV = mR T2 lnV 2 |
= m R T2 ln |
1 , |
||||||
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
1 |
µ |
V 1 |
µ |
|
n2 |
|||
где n2 |
= |
V 2 |
= 5 . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
V 3 |
|
|
|
|
|
|
|
|
|
|
|
Подставив числовые значения, находим А2 = −2,1 104 Дж.
Знак “минус” показывает, что при сжатии работа над газом совершается внешними силами.
Пример 5. Тепловая машина работает по обратимому циклу Карно. Температура нагревателя Т1=500 К. Определить термический к. п. д. η цикла и температуру Т2 охладителя тепловой машины, если за счет каждого килоджоуля теплоты, полученной от нагревателя, машина совершает работу А=350 Дж.
Решение. Термический к. п. д. тепловой машины показывает, какая доля теплоты, полученной от нагревателя, превращается в механическую работу. Термический к. п. д. выражается формулой
η = A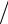 Q1 ,
Q1 ,
где Q1 - теплота, полученная от нагревателя;
А - работа, совершенная рабочим телом машины. Подставив числовые значения в эту формулу, получим
η = 1000350 = 0,35 .
Зная к. п. д. цикла, можно по формуле η= 1 − T2  T1 определить температуру охладителя Т2:
T1 определить температуру охладителя Т2:
50
T2 = 500(1 − 0,35)K = 325 К.
5.2.3. Вопросы и задания для самостоятельного решения и самоконтроля
Молекулярная физика и термодинамика
1. Какое выражение определяет число частиц dN´ со скоростями, лежащими в интервале от v до v + dv ?
Ответы: 1) dN´= |
1 |
dN |
; |
|
N |
||||
|
dv |
|
2)dN´= f (v)dv ;
3)dN´= N f(v) dv ,
где N - число частиц в системе,
f (v) - функция распределения частиц по абсолютным значениям скоростей.
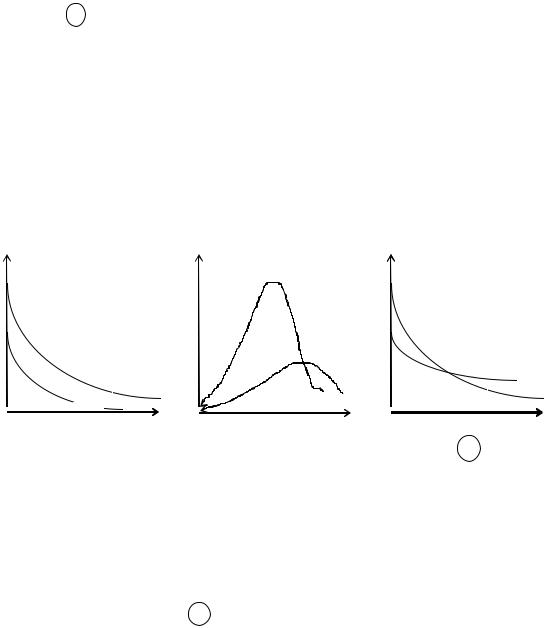
2. Имеются две равновесные системы, находящиеся во внешнем потенциальном поле и подчиняющиеся закону распределения Больцмана. Укажите номер рисунка, на котором приведены графики этих распределений, если масса молекулы первого газа больше массы молекулы второго газа. Газы считать идеальными.
n |
n |
n |
|
|
|
n01 |
n01 - - - - - - - - - |
n01 |
|
|
|
n02 |
n02 - - - - - - - - - - - |
n02 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
h |
h |
|
h |
|
1) |
2) |
|
3) |
|
|
3. На основании теоремы о равнораспределении энергии по степеням свободы среднюю кинетическую ε энергию молекулы, имеющей i степеней свободы, находят по формуле:
Ответы: 1) |
ε = |
1 |
kT |
; 2) ε = |
i |
|
RT ; 3) ε = |
i |
R ; |
|||
|
2 |
|
||||||||||
|
2 |
|
|
|
|
i |
2 |
|
||||
4) |
ε = |
i+2 |
R ; 5) ε = |
|
kT . |
|
||||||
2 |
|
|||||||||||
|
|
|||||||||||
|
2 |
|
|
|
|
|
|
|||||
