
- •Курсовая работа по основам физической химии на тему: « Термохимия и химическая термодинамика»
- •Теоретические сведения.
- •Основные понятия
- •Первый закон термодинамики
- •Второй закон термодинамики
- •Третий закон термодинамики
- •Закон Гесса
- •Закон Кирхгофа
- •Энтальпия
- •Энтропия
- •Термодинамические потенциалы. Свободная энергия Гиббса и Гельмгольца.
- •Константа равновесия
- •Расчетное задание
- •Результаты расчета
- •Расчет параметра .
Константа равновесия
Термодинамическим равновесием называется такое термодинамическое состояние системы, которое при постоянстве внешних условий не изменяется во времени, причем эта неизменяемость не обусловлена каким-либо внешним процессом.
Условием термодинамического равновесия в закрытой системе является минимальное значение соответствующего термодинамического потенциала:
Изобарно-изотермического (P=const, T=const):
∆G=0, dG=0, d2G>0;
Изохорно-изотермического (V=const, T=const):
∆F=0, dF=0, d2F>0.
Учение о равновесных состояниях- один из разделов термодинамики.
Количественной характеристикой химического равновесия является константа равновесия К, которая может быть выражена через равновесные концентрации С или парциальные давления Р реагирующих веществ. Для некоторой реакции:
aA+bB+…mM+nN+…
соответствующие константы равновесия выражаются следующим образом:
Kс=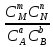
Kp=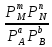
Константа равновесия есть характерная величина для каждой обратимой химической реакции; величина константы равновесия зависит только от природы реагирующих веществ и температуры.
Кроме того, константа равновесия есть отношение констант скоростей прямой и обратной реакций. Отсюда вытекает физический смысл константы равновесия: она показывает, во сколько раз скорость прямой реакции больше скорости обратимой реакции при данной температуре и концентрациях всех реагирующих веществ, равных 1моль/л.
Константа равновесия и энергия изменения Гиббса.
Для реакции, протекающей в изобарно-изотермических условиях, в некотором неравновесном исходном состоянии энергии Гиббса или химические потенциалы реагирующих веществ и продуктов реакции в общем случае не одинаковы, их разность (ΔGT) может быть рассчитана по уравнению:
![]()
где ![]() —
отношение парциальных давлений участников
реакции в исходном состоянии в степенях,
равных их стехиометрическим коэффициентам;
R — универсальная
газовая постоянная.
—
отношение парциальных давлений участников
реакции в исходном состоянии в степенях,
равных их стехиометрическим коэффициентам;
R — универсальная
газовая постоянная.
Это уравнение называют уравнением изотермы химической реакции. Оно позволяет рассчитать изменение энергии Гиббса при протекании процесса и определить направление протекания реакции:
при ![]()
![]() —
реакция идёт в прямом направлении, слева
направо;
—
реакция идёт в прямом направлении, слева
направо;
при ![]()
![]() —
реакция достигла равновесного состояния;
—
реакция достигла равновесного состояния;
при ![]()
![]() —
реакция идёт в обратном направлении.
—
реакция идёт в обратном направлении.
Стандартная константа равновесия связана со стандартной энергией Гиббса реакции соотношением:
![]()
Стандартная энергия Гиббса реакции в газовой смеси — энергия Гиббса реакции при стандартных парциальных давлениях всех компонентов, равных 0,1013 МПа (1 атм).
Стандартная энергия Гиббса
реакции в растворе — энергия Гиббса
при стандартном
состоянии раствора,
за которое принимают гипотетический раствор
со свойствами предельно
разбавленного раствора, но с
концентрацией всех реагентов, равной
единице. Величина стандартной энергии
Гиббса реакции может быть использована
для приближенной оценки термодинамической
возможности протекания реакции в данном
направлении, если начальные условия не
сильно отличаются от стандартных. Кроме
того, сравнивая величины стандартной
энергии Гиббса нескольких реакций,
можно выбрать наиболее предпочтительные,
для которых ![]() имеет
наибольшую по модулю отрицательную величину.
имеет
наибольшую по модулю отрицательную величину.
Зависимость константы равновесия от температуры.
Зависимость константы равновесия реакции от температуры может быть описана уравнением изобары химической реакции (изобары Вант-Гоффа):
![]()
и изохоры химической реакции (изохоры Вант-Гоффа):
![]()
Здесь ![]() и
и ![]() — тепловой
эффект реакции,
протекающей, соответственно, при
постоянном давлении или при постоянном
объёме. Если
— тепловой
эффект реакции,
протекающей, соответственно, при
постоянном давлении или при постоянном
объёме. Если ![]() (тепловой
эффект положителен, реакция эндотермическая),
то температурный коэффициент константы
равновесия
(тепловой
эффект положителен, реакция эндотермическая),
то температурный коэффициент константы
равновесия ![]() тоже
положителен, то есть с ростом температуры
константа равновесия эндотермической
реакции увеличивается, равновесие
сдвигается вправо (что вполне согласуется
с принципом
Ле Шателье).
тоже
положителен, то есть с ростом температуры
константа равновесия эндотермической
реакции увеличивается, равновесие
сдвигается вправо (что вполне согласуется
с принципом
Ле Шателье).
Методы расчета константы равновесия.
Расчётные методы определения константы равновесия реакции обычно сводятся к вычислению тем или иным способом стандартного изменения энергии Гиббса в ходе реакции (ΔG0), а затем использованию формулы:
![]() ,
где
,
где ![]() — универсальная
газовая постоянная.
— универсальная
газовая постоянная.
При этом следует помнить, что энергия Гиббса — функция состояния системы, то есть она не зависит от пути процесса, от механизма реакции, а определяется лишь начальным и конечным состояниями системы. Следовательно, если непосредственное определение или расчёт ΔG0 для некоторой реакции по каким-либо причинам затруднены, можно подобрать такие промежуточные реакции, для которых ΔG0 известно или может быть легко определено, и суммирование которых даст рассматриваемую реакцию (см. Закон Гесса). В частности, в качестве таких промежуточных реакций часто используют реакции образования соединений из элементов.
