
Модуль № 8
(Химия р - металлов, 45 б.)
1. Напишите уравнения химических реакций, протекающих при получении металлического алюминия из бокситов. (3 б.).
2. Минерал MgAl2О4 называется благородной шпинелью. Какова кристаллическая
решетка шпинели? Приведите еще примеры соединений, имеющих структуру
шпинели. (3 б.)
3. Перечислите методы синтеза безводного хлорида алюминия. Какое строение имеет это вещество? Сопоставьте его со строением кристаллогидрата. (3 б.).
4. Напишите уравнения реакций указанных превращений:
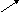 AlBr3(б/в)
AlBr3(б/в)
Al → Na[Al(OH)4]
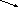
 Al
Al
Al2O3 → алюмокалиевые квасцы

Na[AlF6]
Аl2O3 → Al2(SO4)3 → К[Аl(ОН)4] → Аl2O3 → AlCl3 (б/в). (4 б.).
5. Укажите состав и цвета осадков, получающихся при сливании водных растворов:
а) хлорида гaллия и сульфида аммония;
b) нитрата индия (III) и сероводорода;
с) сульфата таллия (I) и гидроксида бария;
d) гидроксида таллия (1) и брома. (2 б.).
6. При взаимодействии галлия с мышьяком и индия с сурьмой образуются интерметаллические соединения типа AIIIBV, в которых содержание галлия и индия составляет 48,2 и 48,5 % по массе соответственно. Найти формулы интерметaллидов.
(3 б.).
7. Записать сокращенные монно - молекулярные уравнения rидролиза солей Pb(NОз)2, SnCl2, Рb(СН3СОО)2. Указать реакцию среды. (2 б.).
8. Объясните различие температур плавления GаF3 (1000 oC) и GаСlз (78 oC); InF3
(1172 oС) и InCl3, (586 ОC). (2 б.)
9. Рассмотреть закономерности изменения основных свойств в ряду гидроксидов Аl(ОН)3- Gа(ОН)3- In(ОН)3- Tl(OH)3. Расположить в ряд по склонности к гидролизу соли TlCl, Тl(NОз)з, Ga2(SO4)3, Ga(СНзСОО)3. Написать уравнения реакций гидролиза. (2 б.).
10. Как доказать, что PbO2 ‒ оксид, а ВаО2 – пероксид? (1 б.).
11. В какой среде идет леrче окисление Э(II) → Э(lV) и восстановление Э(IV) → Э(II) (Э - элемент подгpуппы германия)? Какие соединения олова и свинца используются в лабораторной практике в качестве окислителей и восстановителей? (2 б.).
12. Написать уравнения реакций, происходящих при зарядке и разрядке свинцового аккумулятора. (3 б.).
13. Предложите реактивы с помощью которых, из сплaва олова со свинцом можно отдельно извлечь только олово и только свинец. (2 б.).
14. Почему при приготовлении раствора хлорида олова (II) твердую соль SnCl2 ∙ 2Н2О вносят не в воду, а в раствор соляной кислоты? (1 б.).
15. Приведите примеры реакций, подтверждающих усиление металлических свойств в ряду Ge - Sn - Рb. (2 б.).
16. Кристаллы ВаSnO3 и SгSnO3, имеют структуру типа пeровскита. Что это за структура?
(2 б.).
17. Как из ЭО2 или Э(ОН)4 (Э - Ge - Sn - Рb) получить: а) оксосоединения,
b) гидроксосоединения? Написать уравнения реакций. (2 б.).
18. Напишите уравнения реакций получения дисульфидов олова и германия, а также
уравнения реакций, иллюстрирующие их кислотно-основные свойства. (2 б.).
19. Закончить уравнения реакций, подобреть коэффициенты:
AlCl3 + Na2S + Н2O→
Tl2SO4 + КМnО4+ Н2SО4 →
К2SnО3 + НСl (конц.) →
Рb3O4 + NaClO →
Ge + NaOН + Н2О2 →
TlNO3 + KOH + Cl2 →
Tl2SO4 + SO2 →
Na2GeO3 + H2O →
Nа[Sn(ОН)3] + NaOН + ВiCl3 →
Рb(СНзСОО)2 + NaОН + Ca(OCl)2 →
РbО2 + HNO3 + Мn(NО3)2 (4 б.).
