
osnfizhim_ycheb-pos_prakt-zan_farm_fak_1-kyrs
.pdfОтметим, что константа равновесия экзотермической реакции уменьшается с ростом температуры, что соответствует принципу Ле - Шателье.
Указание: во всех задачах считать газы идеальными.
1.При 1273 К и общем давлении 30 атм в равновесной смеси
CO2(г) + C(тв) = 2CO(г)
содержится 17% (по объему) CO2. Сколько процентов CO2 будет содержаться в газе при общем давлении 20 атм? При каком давлении в газе будет содержаться 25% CO2?
2. При 2000oC и общем давлении 1 атм 2% воды диссоциировано на водород и кислород. Рассчитать константу равновесия реакции
H2O(г) = H2(г) + 1/2O2(г) при этих условиях.
3.Константа равновесия реакции
CO(г) + H2O(г) = CO2(г) + H2(г)
при 500oC равна Kp = 5.5. Смесь, состоящая из 1 моль CO и 5 моль H2O, нагрели до этой температуры. Рассчитать мольную долю H2O в равновесной смеси.
4.Константа равновесия реакции
N2O4(г) = 2NO2(г)
при 25oC равна Kp = 0.143. Рассчитать давление, которое установится в сосуде объемом 1 л,
вкоторый поместили 1 г N2O4 при этой температуре.
5.Сосуд объемом 3 л, содержащий 1.79 10–2 моль I2, нагрели до 973 K. Давление в сосуде при равновесии оказалось равно 0.49 атм. Считая газы идеальными, рассчитать константу равновесия при 973 K для реакции
10–2 моль I2, нагрели до 973 K. Давление в сосуде при равновесии оказалось равно 0.49 атм. Считая газы идеальными, рассчитать константу равновесия при 973 K для реакции
I2 (г) = 2I (г).
6.Для реакции
PCl5(г) = PCl3(г) + Cl2(г)
при 250oC  rGo = –2508 Дж. моль–1. При каком общем давлении степень превращения PCl5 в PCl3 и Cl2 при 250o C составит 30%?
rGo = –2508 Дж. моль–1. При каком общем давлении степень превращения PCl5 в PCl3 и Cl2 при 250o C составит 30%?
7.Для реакции
2HI(г) = H2(г) + I2(г)
константа равновесия KP = 1.83 10–2 при 698,6 К. Сколько граммов HI образуется при нагревании до этой температуры 10 г I2 и 0.2 г H2 в трехлитровом сосуде? Чему равны парциальные давления H2, I2 и HI?
10–2 при 698,6 К. Сколько граммов HI образуется при нагревании до этой температуры 10 г I2 и 0.2 г H2 в трехлитровом сосуде? Чему равны парциальные давления H2, I2 и HI?
8. Сосуд объемом 1 л, содержащий 0.341 моль PCl5 и 0.233 моль N2, нагрели до 250oC. Общее давление в сосуде при равновесии оказалось равно 29.33 атм. Считая все газы идеальными, рассчитать константу равновесия при 250oC для протекающей в сосуде реакции
PCl5 (г) = PCl3 (г) + Cl2(г)
9.Константа равновесия реакции
CO(г) + 2H2(г) = CH3OH(г)
при 500 K равна KP = 6.09 10–3. Рассчитать общее давление, необходимое для получения метанола с 90% выходом, если CO и H2 взяты в соотношении 1: 2.
10–3. Рассчитать общее давление, необходимое для получения метанола с 90% выходом, если CO и H2 взяты в соотношении 1: 2.
10.При 25oC  fGo (NH3) = –16.5 кДж. моль–1. Рассчитать
fGo (NH3) = –16.5 кДж. моль–1. Рассчитать  rG реакции образования NH3 при парциальных давлениях N2, H2 и NH3, равных 3 атм, 1 атм и 4 атм соответственно. В какую сторону реакция будет идти самопроизвольно при этих условиях?
rG реакции образования NH3 при парциальных давлениях N2, H2 и NH3, равных 3 атм, 1 атм и 4 атм соответственно. В какую сторону реакция будет идти самопроизвольно при этих условиях?
11.Экзотермическая реакция
CO(г) + 2H2(г) = CH3OH(г)
находится в равновесии при 500 K и 10 бар. Если газы идеальные, как повлияют на выход метанола следующие факторы: а) повышение T; б) повышение P; в) добавление инертного газа при V = const; г) добавление инертного газа при P = const; д) добавление H2 при P = const?
12.Константа равновесия газофазной реакции изомеризации борнеола (C10H17OH) в изоборнеол равна 0.106 при 503 K. Смесь 7.5 г борнеола и 14.0 г изоборнеола поместили в сосуд объемом 5 л и выдерживали при 503 K до достижения равновесия. Рассчитать мольные доли и массы борнеола и изоборнеола в равновесной смеси.
13.Равновесие в реакции
2NOCl(г) = 2NO(г) + Cl2(г)

устанавливается при 227oC и общем давлении 1.0 бар, когда парциальное давление NOCl равно 0.64 бар (изначально присутствовал только NOCl). Рассчитать  rGo для реакции. При каком общем давлении парциальное давление Cl2 будет равно 0.10 бар?
rGo для реакции. При каком общем давлении парциальное давление Cl2 будет равно 0.10 бар?
14. Рассчитать общее давление, которое необходимо приложить к смеси 3 частей H2 и 1 части N2, чтобы получить равновесную смесь, содержащую 10% NH3 по объему при 400oC. Константа равновесия для реакции
N2(г) + 3H2(г) = 2NH3(г)
при 400oC равна K = 1.60 10–4.
10–4.
15.При 250oC и общем давлении 1 атм PCl5 диссоциирован на 80% по реакции
PCl5 (г) = PCl3 (г) + Cl2(г).
Чему будет равна степень диссоциации PCl5, если в систему добавить N2, чтобы парциальное давление азота было равно 0.9 атм? Общее давление поддерживается равным 1 атм.
16.При 2000oC для реакции
N2(г) + O2(г) = 2NO(г)
Kp = 2.5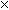 10–3. В равновесной смеси N2, O2, NO и инертного газа при общем давлении 1 бар содержится 80% (по объему) N2 и 16% O2. Сколько процентов по объему составляет NO? Чему равно парциальное давление инертного газа?
10–3. В равновесной смеси N2, O2, NO и инертного газа при общем давлении 1 бар содержится 80% (по объему) N2 и 16% O2. Сколько процентов по объему составляет NO? Чему равно парциальное давление инертного газа?
17.Рассчитать стандартную энтальпию реакции, для которой константа равновесия
а) увеличивается в 2 раза, б) уменьшается в 2 раза при изменении температуры от 298 К до 308 К.
18.Оксид ртути диссоциирует по реакции
2HgO(тв) = 2Hg(г) + O2(г).
При 420oC давление газов равно 5.16 104 Па, а при 450oC 10.8
104 Па, а при 450oC 10.8 104 Па. Рассчитать константы равновесия при этих температурах и энтальпию диссоциации на моль HgO.
104 Па. Рассчитать константы равновесия при этих температурах и энтальпию диссоциации на моль HgO.
19.Для реакции
Ag2CO3(тв) = Ag2O(тв) + CO2(г)
получены следующие данные по зависимости константы равновесия от температуры:
T, K |
350 |
400 |
450 |
500 |
|
|
|
|
|
|
|
|
|
|
KP |
3.98 10–4 |
1.41 10–2 |
1.86 10–1 |
1.48 |
|
|
|
|
|
|
|
|
|
|
Определить стандартную энтальпию реакции в этом температурном интервале.
20. Зависимость константы равновесия реакции 2C3H6(г) = C2H4(г) + C4H8(г) от температуры между 300 К и 600 К описывается уравнением
ln K = –1.04 –1088 /T +1.51 105 /T2.
105 /T2.
Рассчитать  rGo ,
rGo ,  rHo и
rHo и  rSo реакции при 400 К.
rSo реакции при 400 К.
VIII. ПЛАН РАБОТЫ НА ПРЕДСТОЯЩЕМ ЗАНЯТИИ:
1.Контроль и коррекция выполнения домашнего задания.
2.Разбор основных теоретических вопросов темы.
3.Решение задач.
4.Тестовый контроль.
ТЕМА № 7
СВОЙСТВА РАЗБАВЛЕННЫХ РАСТВОРОВ НЕЛЕТУЧИХ НЕЭЛЕКТРОЛИТОВ
I. МОТИВАЦИЯ ЦЕЛИ: Свойства разбавленных растворов, зависящие только от количества нелетучего растворенного вещества, называются коллигативными свойствами. К ним относятся понижение давление пара растворителя над раствором, повышение температуры кипения и понижение температуры замерзания раствора, а также осмотическое давление. С учетом этих свойств, определяющих в частности величину осмотического давления, готовят растворы многих лекарственных препаратов, проводя их изотонирование. Действие многих лекарств само по себе связано с повышением или понижением осмотического давления. Определяя повышение температуры кипения или понижения температуры замерзания раствора по отношению к чистому растворителю, осмотическое давление раствора, можно установить молекулярную массу растворенного вещества, степень и константу диссоциации электролита, частичную (осмотическую) концентрацию вещества в растворе.
В фармацевтической практике для определения молекулярной массы изучаемого вещества широко используется, предлагаемый для освоения на занятии, криометрический метод Раста.
II. ЦЕЛЬ САМОПОДГОТОВКИ: усвоить основные законы для растворов неэлектролитов – закон рауля, закон Вант-Гоффа и его следствия, сущность явлений криоскопии, эбулиоскопии, осмоса, применение метода Раста.
III. ИСХОДНЫЙ УРОВЕНЬ ЗНАНИЙ: способы выражения состава растворов, понятие «давление насыщенного пара», «температура кипения», «температура кристаллизации», механизм явления осмоса.
IV. ПЛАН ИЗУЧЕНИЯ МАТЕРИАЛА ТЕМЫ
1.Растворы – определение. Способы выражения состава растворов: а) массовая доля компонента ( ); б) молярная доля компонента ( );
в) молярная концентрация компонента (С);
г) молярная концентрация эквивалентов компонента (Сэкв или Сeq); д) моляльность компонента (в).
2.Коллигативные свойсва растворов.
3.Насыщенный пар. Давление насыщенного пара над жидкостью, его зависимость от природы жидкости и температуры.
4.Закон Рауля для разбавленных растворов нелетучих неэлектролитов – содержание, словесная и математическая формулировки.
5.Графическая зависимость давления насыщенного пара над растворителем и раствором от температуры, анализ этой зависимости.
6.Физико-химические определения температур плавления (замерзания) и кипения. Нахождение температур замерзания и кипения по графику зависимости давления насыщенного пара от температуры для чистого растворителя и раствора.
7.Криоскопический эффект – определение явлению. Основная закономерность, описывающая это явление (словесная формулировка). Уравнение зависимости понижения температуры замерзания раствора от концентрации растворенного вещества для разбавленных растворов нелетучих неэлектролитов.
8.Криоскопическая постоянная Ккр:
а) физический смысл Ккр; б) факторы, влияющие на величину Ккр; в) способы определения Ккр.
9.Уравнение для расчета молярной массы нелетучего неэлектролита по величине понижения температуры замерзания разбавленного раствора нелетучего неэлектролита.
10.Эбулиоскопический эффект – определение явления. Основная закономерность, описывающая это явление. Уравнение зависимости повышения температуры кипения раствора от концентрации растворенного вещества для разбавленных растворов нелетучих неэлектролитов.

11.Эбулиоскопическая постоянная Кэб: а) физический смысл Кэб; б) факторы, влияющие на величину Кэб;
в) способы определения Кэб.
12.Осмос – определение явлению. Осмотическое давление. Закон Вант-Гоффа – формулировка и математическое выражение для разбавленных растворов нелетучих неэлектролитов.
13.Изотонические, гипертонические, гипотонические растворы. Гемолиз, плазмолиз.
14.Методы определения температуры плавления (замерзания). Капиллярный метод определения температуры плавления веществ.
15.Криометрия, эбулиометрия и осмометрия, как методы исследования разбавленных рас-
творов.
V. ЛИТЕРАТУРА:
1.А.П. Беляева и др. Физическая и коллоидная химия. М.: ГЭОТАР-Медиа, 2008, с. 130-140.
2.Евстратова К. И., Купина Н. А., Малахова Е.Е. Физическая и коллоидная химия М., 1990, с.
68-82.
3.Киреев В. А. Краткий курс физической химии М. 1978, с.290-300.
4.Стромберг А. Г., Семченко Д.П., Физическая и коллоидная химия М., 1999, с. 182-202.
5.Краснов К.С. Физическая химия М., 2001, с. 390-400.
6.Лекционный материал.
VI. ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ: 1. Чему равны:
а) молярная доля; б) массовая доля;
в) молярная концентрация; г) моляльность сахарозы в растворе, полученном при растворении 17,1 г сахарозы (М = 342
г/моль) в 82,9 г воды С12Н22О11 (М = 18 г/моль). Плотность раствора принять равной Н2О 1,067 103 г/л.
Ответ: = 1,08%; = 17,1%; С = 0,53 моль/л; b = 0,6 моль/кг
2. При каком условии жидкость закипит? Какую температуру называют температурой кипе-
ния?
1.При каком условии кристаллизуется жидкость? Какую температуру называют температурой замерзания?
2.Какой пар называют насыщенным? Дайте определение давлению насыщенного пара.
3.Почему при одной и той же температуре давление насыщенного пара над водой выше, чем над водным раствором глицерина с массовой долей глицерина 2%?
4.Имеются два раствора одинаковой моляльной концентрации. Растворенное вещество в первом растворе летучее, а во втором – нелетучее. Над каким раствором давление пара выше?
5.Почему при одном и том же давлении вода замерзает при 0 0С, а раствор глюкозы в воде с массовой долей глюкозы 18% замерзает при 2,27 0С?
6.Почему при нормальном атмосферном давлении бензол кипит при 80,1 0С, а раствор дифениламина в бензоле с массовой долей дифениламина 10% кипит при 80,3 0С?
7.На графике представлены три линии зависимости давления насыщенного пара от температуры:
1 - для жидкой воды
2 - для раствора мочевины в воде
3 - для льда
8. Укажите по графику температуры: а) замерзания воды; б) кипения воды;
в) замерзания раствора мочевины в воде; г) кипения раствора мочевины в воде; 9. Приведите уравнения для расчета:

а) относительного понижения давления насыщенного пара растворителя над раствором нелетучего неэлектролита, молярная доля которого (закон Рауля),
б) понижения температуры замерзания раствора неэлектролита,моляльность которого в растворе равна "в",
в) повышения температуры кипения раствора неэлектролита, моляльность которого равна
"в",
г) осмотического давления раствора неэлектролита с молярной концентрацией "С".
10.Криоскопическая постоянная для воды равна 1,86. Что означает эта величина?
11.Эбулиоскопическая постоянная для воды равна 0,513. Что означает эта величина?
12.Перечислите величины, определяемые природой вещества растворителя разбавленного раствора, от которых зависит значение:
а) криоскопической постоянной, б) эбулиоскопической постоянной.
13.Приведите уравнение, устанавливающее связь между криоскопической постоянной растворителя и его температурой плавления.
14.Имеются два раствора глицерина в воде при нормальном атмосферном давлении. Моляльность первого раствора равна 0,01 моль/кг, второго - 0,02 моль/кг.
а) Над каким из растворов давление насыщенного пара выше?
б) Для какого из растворов выше температура замерзания (температура кипения)?
15.Молярная концентрация водных растворов: а) глюкозы, б) глицерина равна 0,01 моль/л. Сравните осмотические давления этих растворов.
16.Осмотическое давление крови соответствует осмотическому давлению раствора NaCl с молярной концентрацией 0,15 моль/л. Что и почему произойдет с эритроцитами при помещении их
враствор NaCl с концентрацией: а) 0,05 моль/л, б) 0,5 моль/л ?
17.Запишите уравнение для расчета осмотической концентрации (осмомоляльности) рас-
твора неэлектролита по величине понижения температуры замерзания раствора ( t ) по сравнению
счистым растворителем.
18.Назовите физическое явление, лежащее в основе методов криометрии, эбулиометрии и осмометрии.
19.Приведите уравнения, отражающие закономерности, используемую в криометрическом, эбулиометрическом и осмометрическом методах.
20.Какие величины должны быть определены на основе эксперимента при криометрическом, эбулиометрическом и осмометрическом методах исследования?
21.Приведите уравнения для расчета молярной массы растворенного неэлектролита по экспериментально найденной величине в методах эбулиометрии и осмометрии.
22.При растворении 0,412 г нафталина в 10 г камфоры, криоскопическая постоянная для которой равна 40,4, произошло понижение температуры плавления на 130С. Привести уравнение для расчета молярной массы нафталина. Рассчитать эту величину.
Ответ: М = 128 г/моль.
23.Приведите уравнение для расчета молярной массы растворенного вещества неэлектролита при криометрическом ее определении, если известны температура плавления растворителя, его криометрическая постоянная, температура плавления раствора и его количественный состав.
VII. ОБЯЗАТЕЛЬНЫЕ ДЛЯ ВЫПОЛНЕНИЯ ЗАДАНИЯ:
Примеры решения задач Пример 16-1. Раствор 20 г гемоглобина в 1 л воды имеет осмотическое давление 7.52 10–3
10–3
атм при 25oC. Определить молярную массу гемоглобина.
Решение.
= 65 кг. моль–1.
Пример 16-2. Вычислите молекулярную массу вещества, если раствор, содержащий 0,3145 г неэлектролита в 25,30 г воды, при экспериментальном сравнении с температурой замерзания воды показал следующие понижения температуры замерзания (при повторных определениях): 0,306°; 0,307°; 0,304°.
|
|
|
|
|
|
Решение: |
|
|
|
|
t |
|
|
|
0,306 0,307 0,304 |
0,306 |
|||||
зам |
|
|
||||||||
|
|
|
|
|
3 |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
K |
замmB 1000 |
|
1,86 0,3145 103 |
||||||
М |
|
|
|
|
|
|
|
|
|
75,56 |
|
|
|
|
|
|
|
|
|||
|
|
|
tзамmA |
|
0,306 |
25,30 |
||||
Ответ: М = 75,56 г/моль.
16-1. Рассчитать минимальную осмотическую работу, совершаемую почками для выделения мочевины при 36.6o C, если концентрация мочевины в плазме 0.005 моль. л–1, а в моче 0.333 моль. л–1.
16-2. 10 г полистирола растворено в 1 л бензола. Высота столбика раствора (плотностью 0.88 г./см3) в осмометре при 25o C равна 11.6 см. Рассчитать молярную массу полистирола.
16-3. Белок сывороточный альбумин человека имеет молярную массу 69 кг. моль–1. Рассчитать осмотическое давление раствора 2 г белка в 100 см3 воды при 25o C в Па. Считать плотность раствора равной 1.0 г. см–3.
16-4. При 30oC давление пара водного раствора сахарозы равно 31.207 мм рт. ст. Давление пара чистой воды при 30oC равно 31.824 мм рт. ст. Плотность раствора равна 0.99564 г. см–3. Чему равно осмотическое давление этого раствора?
16-5. Плазма человеческой крови замерзает при –0.56oC. Каково ее осмотическое давление при 37oC, измеренное с помощью мембраны, проницаемой только для воды?
16-6. Молярную массу липида определяют по повышению температуры кипения. Липид можно растворить в метаноле или в хлороформе. Температура кипения метанола 64.7oC, теплота испарения 262.8 кал. г–1. Температура кипения хлороформа 61.5oC, теплота испарения 59.0 кал. г-1. Рассчитайте эбулиоскопические постоянные метанола и хлороформа. Какой растворитель лучше использовать, чтобы определить молярную массу с максимальной точностью?
16-7. Рассчитать температуру замерзания водного раствора, содержащего 50.0 г этиленгликоля в 500 г воды.
16-8. Раствор, содержащий 0.217 г серы и 19.18 г CS2, кипит при 319.304 К. Температура кипения чистого CS2 равна 319.2 К. Эбулиоскопическая постоянная CS2 равна 2.37 К. кг. моль–1. Сколько атомов серы содержится в молекуле серы, растворенной в CS2?
16-9. 68.4 г сахарозы растворено в 1000 г воды. Рассчитать: а) давление пара, б) осмотическое давление, в) температуру замерзания, г) температуру кипения раствора. Давление пара чистой воды при 20oC равно 2314.9 Па. Криоскопическая и эбулиоскопическая постоянные воды равны 1.86 и 0.52 К. кг. моль–1 соответственно.
16-10. Раствор, содержащий 0.81 г углеводорода H(CH2)nH и 190 г бромистого этила, замерзает при 9.47oC. Температура замерзания бромистого этила 10.00oC, криоскопическая постоянная 12.5 К. кг. моль–1. Рассчитать n.
16-11. При растворении 1.4511 г дихлоруксусной кислоты в 56.87 г четыреххлористого углерода точка кипения повышается на 0.518 град. Температура кипения CCl4 76.75oC, теплота испарения 46.5 кал. г–1. Какова кажущаяся молярная масса кислоты? Чем объясняется расхождение с истинной молярной массой?
16-12. Некоторое количество вещества, растворенное в 100 г бензола, понижает точку его замерзания на 1.28oC. То же количество вещества, растворенное в 100 г воды, понижает точку ее замерзания на 1.395oC. Вещество имеет в бензоле нормальную молярную массу, а в воде полностью диссоциировано. На сколько ионов вещество диссоциирует в водном растворе? Криоскопические постоянные для бензола и воды равны 5.12 и 1.86 К. кг. моль–1.
16-13. Вычислите величину криоскопической постоянной бензина, если известны следующие величины: tпл = 5,6330С и Н = 126,11 кДж/кг.
Ответ: Кзам = 5,124 К-кг/моль.
16-14. Вычислите величину эбулиоскопической постоянной четыреххлористого углерода, если нормальная температура кипения его равна 76,7 °С и теплота испарения 30,00 кДж/моль.
Ответ: Ккип = 5,225 К -кг/моль.
16-15. Рассчитайте температуру кипения водного раствора глюкозы, содержащего 21%
растворенного вещества, при нормальном давлении. Эбулиоскопическая постоянная воды - 0,516 К·кг/моль.
Ответ: t = 100,603 °С.
16-16. Определите относительное понижение давления пара для раствора, содержащего в 0,5 кг воды 0,05 моля нелетучего неэлектролита. Какова температура замерзания этого раствора?
Ответ: р= 1,797 10-3; t = - 0,l86°C.
16-17. Вычислите молярную массу камфоры, если понижение температуры замерзания раствора, содержащего 0,4484 г камфоры в 30,55 г бензола, составляет 0,4975°. Криоскопическая постоянная бензола 5,16°.
Ответ: М= 155,2.
16-18. Рассчитайте концентрацию раствора глюкозы, если этот раствор имеет температуру кипения 273,962 К. Концентрацию выразите в единицах моляльности и массовых долях (%).
Ответ: b = 1,554 моль/кг; = 21,86%.
16-19. К водным растворам для предотвращения замерзания в зимнее время обычно прибавляют глицерин. Допустив, что закон Рауля применим к растворам такой концентрации, вычислите количество глицерина, которое должно быть добавлено, чтобы раствор, содержащий 0,1 кг воды, замерзал до 268,16 К. Криоскопическая константа для воды 1,86 К кг/моль.
Ответ: m = 24,46 г.
16-20. Температура замерзания чистого бензола 278,5 К, а температура замерзания раствора, содержащего 0,2242 г камфоры в 30,55 г бензола, 278,252 К. Определите молярную массу камфоры. Криоскопическая постоянная бензола 5,16 Ккг/моль.
Ответ: М = 152 г/моль.
16-21. Температура кипения бензола 353,36 К. Его молярная теплота испарения - 30759 Дж/моль. Определите эбулиоскопическую константу бензола.
Ответ: Ккип = 2,61 Ккг/моль, 16-22. Давление пара воды при 313 К составляет 7,375 кПа. Вычислите для данной темпе-
ратуры давление пара над раствором, содержащим 9,2 г глицерина в 360 г воды. Ответ: р = 7,338 кПа.
16-23. При какой температуре будет кипеть раствор тростникового сахара, если при измерении осмотического давления получена величина = 72,38 кПа.
Ответ: Ткип = 373,175 К.
VIII. ПЛАН РАБОТЫ НА ПРЕДСТОЯЩЕМ ЗАНЯТИИ:
1.Контроль и коррекция выполнения домашнего задания.
2.Разбор основных теоретических вопросов темы.
3.Решение задач.
4.Тестовый контроль.
5.Выполнение лабораторной работы: «Микрометод определения молярной массы вещества криометрически (по Расту)».
ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ ПЛАВЛЕНИЯ КАПИЛЛЯРНЫМ МЕТОДОМ.
Температура плавления (замерзания) – температура, при которой давление насыщенного пара над твердой и жидкой фазами равны между собой.
При практическом измерении температуры плавления руководствуются следующим определением:
Под температурой плавления вещества подразумевается интервал температур между началом плавления – появлением первой капли жидкости и концом плавления – полным пе-
реходом вещества в жидкое состояние (Государственная Фармакопея XI, т.I. М., "Медицина", 1987, с.16).
Чистые вещества плавятся при постоянной температуре, значение которой определяется природой вещества. В присутствии примесей образцы плавятся в интервале температур. Измеряя температуру плавления можно идентифицировать вещество, установить степень его чистоты. По разнице в температурах плавления растворителя и раствора вещества в данном растворителе можно определить, например, молярную массу растворенного вещества. Измерение температуры плавления можно использовать и для других целей.

При измерении температуры плавления смесей (в том числе растворов), плавящихся в интервале температур, определяют температуру конца плавления (исчезновения последнего кристалла), при измерении температуры замерзания смесей (растворов) определяют температуру начала замерзания (появления первого кристалла).
Если температуру плавления измерять капиллярным методом, в котором исследуемое вещество находится в стеклянном капилляре, а ртутный резервуар термометра опущен в масляную баню, в момент полного плавления вещества в капилляре температуры бани и внутри капилляра могут не совпадать. Для точного определения температуры плавления в этом случае измеряют температуру исчезновения последнего кристалла при нагревании и температуру появления первого кристалла при охлаждении. Если эти температуры не совпадают (и разница не превышает 20С), за температуру плавления принимают их среднее арифметическое значение.
Устройство установки для определения температура плавления капиллярным методом и последовательность работы с ней.
Установка состоит из масляной (парафиновой) бани; термометра; стеклянного капилляра, заполненного исследуемым веществом; плитки; подставки; штатива.
Исследуемое вещество помещают в капилляр диаметром 1 мм и длиной 6 см, запаянный с одного конца. Заполнение капилляра веществом проводят так: небольшое количество хорошо измельченного вещества помещают на чистую поверхность и, прикасаясь открытым концом капилляра к веществу, вводят его в капилляр небольшими порциями. Затем перемещают вещество к запаянному концу, постукивая этим концом по твердой поверхности, либо бросая капилляр запаянным концом вниз в вертикально расположенную стеклянную трубку высотой не менее 50 см.
Операцию повторяют насколько раз, пока высота слоя вещества не будет равна 3 мм. Необходимо, чтобы столбик вещества в капилляре был плотным без видимых разрывов.
Подготовленный таким образом капилляр с помощью резинового кольца укрепляют на термометре так, чтобы столбик вещества находился на уровне середины ртутного резервуара термометра, а резиновое кольцо при погружении термометра с капилляром в масляную баню не касалось масла. Термометр с капилляром закрепляют в лапке штатива и опускают в предварительно нагретую баню. При этом термометр не должен касаться дна и стенок бани, а уровень жидкости в бане должен быть выше резервуара термометра примерно на 5 мм.
Масляную баню медленно нагревают со скоростью примерно 1,50 С в минуту. Отмечают температуру (t1), когда в капилляре исчезает последний кристаллик исследуемого вещества. Затем отключают плитку, заменяют ее на подставку, следя за тем, чтобы капилляр, закрепленный на термометре, не извлекался из масляной бани. Отмечают температуру (t2), когда в капилляре появится первый кристалл. Если разница в температурах t1 и t2 превышает 20С, опыт следует повторить, уменьшая скорость нагревания и охлаждения. Температуру плавления рассчитывают по формуле:
tпл t1 t2
2
В о п р о с ы д л я с а м о к о н т р о л я п о т е м е:"Определение температуры плавления капиллярным методом".
1.Физико-химическое определение понятия "температура плавления" (замерзания).
2.Определение понятия "температура плавления" по Фармакопее.
3.Какую температуру принимают за температуру плавления для смеси веществ, которая может плавиться в широком интервале температур?
4.Какие (какая) величины измеряются непосредственно в опыте при определении температуры плавления капиллярным методом?
5.Почему при измерении температуры плавления капиллярным методом в опыте определяют две величины: температуру исчезновения последнего кристалла при нагревании и температуру появления первого кристалла при охлаждении?
6.Какая из двух температур: температура исчезновения последнего кристалла при нагрева-
нии t1 или температура появления первого кристалла при охлаждении t2 может быть выше? Почему?
7.Если температура исчезновения последнего кристалла при нагревании t1 и температура появления первого кристалла при охлаждении t2 не одинаковы, то какая разница в значениях этих температур допустима?
8.Если при измерении температуры плавления капиллярным методом, t1 и t2 отличаются между собой более чем на 2 (4) градуса, как добиться допустимой разницы температур?
9.Если в капилляре последний кристалл при нагревании исчезает при температуре t1, а первый кристалл при охлаждении появляется при температуре t2 (t1 = t2), то как по этим двум температурам следует определить tпл ?
10.Состав установки для определения температуры плавления капиллярным методом. 11. Размеры капилляра.
12.Заполнение капилляра веществом. Требования к заполнению.
13.Почему при заполнении капилляра веществом следует следить за тем, чтобы столбик вещества был плотным без видимых разрывов? Как это достигается?
14.Если при расплавлении вещества в капилляре появился пузырек воздуха, как от него освободиться?
15.Требования к закреплению капилляра на термометре.
16.Требования к закреплению термометра с капилляром при погружении их в масляную
баню.
17.Основные этапы определения температуры плавления капиллярным методом.
18.С какой скоростью следует нагревать масляную баню?
19.Какое требование следует соблюдать при перенесении масляной бани с термометром и капилляром с плитки на подставку?
ТЕМА № 8
“Теория растворов есть первый пример и образец для основания истинной физической химии”.
М.В. Ломоносов
КОЛЛИГАТИВЫЕ СВОЙСТВА РАЗБАВЛЕННЫХ РАСТВОРОВ ЭЛЕКТРОЛИТОВ. ТЕОРИИ ОБРАЗОВАНИЯ РАСТВОРОВ ЭЛЕКТРОЛИТОВ
I. МОТИВАЦИЯ ЦЕЛИ: Особенности большинства технологических процессов определяются свойствами водных растворов электролитов. При этом не следует игнорировать и неводные растворы, хотя их применяют значительно реже.
II. ЦЕЛЬ САМОПОДГОТОВКИ: составить представление о растворах электролитов, усвоить основные закономерности и понятия, знать особенности применения электролитов.
III. ИСХОДНЫЙ УРОВЕНЬ ЗНАНИЙ: понятия о составе растворов, механизме их образования, основы теории электролитической диссоциации.
IV. ПЛАН ИЗУЧЕНИЯ МАТЕРИАЛА ТЕМЫ:
1.Коллигативные свойства растворов электролитов.
2.Закон Рауля, следствия закона Рауля и закон Вант-Гоффа для разбавленных растворов нелетучих электролитов.
3.Изотонический коэффициент – определение понятию. Уравнение, связывающее изотонический коэффициент и степень диссоциации слабого электролита. Осмотический коэффициент.
4.Осмотическая концентрация (осмомолярность или осмомоляльность) и ее определение по величине понижения температуры замерзания растворов электролитов.
5.Свойства разбавленных растворов электролитов: понижение температуры плавления (замерзания), повышение температуры кипения, осмос – основа криометрического (криоскопического), эбулиоскопического и осмометрического методов исследования.
6.Криометрическое определение:
а) молярной массы растворенного вещества; б) изотонического коэффициента, степени и константы диссоциации растворенного вещест-
ва, осмотического коэффициента; в) осмотической концентрации и осмотического давления.
7.Разновидности криометрического метода анализа: метод Бекмана и метод Раста.
8.Теория электролитической диссоциации Аррениуса.
9.Закон разбавления Оствальда.
10.Теории Бренстеда-Лоури, Измайлова, Льюиса.
11.Теория Дебая-Хюккеля.
12.Современные представления о растворах электролитов.
V. Л И Т Е Р А Т У Р А:
1.А.П. Беляева и др. Физическая и коллоидная химия. М.: ГЭОТАР-Медиа, 2008, с. 130-140.
2.Евстратова К. И., Купина Н. А., Малахова Е.Е. Физическая и коллоидная химия М., 1990, с.
74-82, 120-121.
3.Киреев В. А. Краткий курс физической химии М. 1978, с.374-391.
4.Стромберг А. Г., Семченко Д.П., Физическая химия М., 1999, с. 181-202.
5.Голиков г.А. Руководство по физической химии М., 1988, с.-201-214.
6.Лекционный материал.
VI. ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ:
1.В чем заключается главное отличие коллигативных свойств электролитов от неэлектро-
литов?
2.Как изменяется давление насыщенного пара над раствором при диссоциации молекул
