
osnfizhim_ycheb-pos_prakt-zan_farm_fak_1-kyrs
.pdf2ZnS + 3O2 = 2ZnO + 2SO2, H20 = -893.5 кДж, 2SO2 + O2 = 2SO3, H30 = -198.2 кДж/моль,
ZnSO4 = ZnO + SO3, H40 = 235.0 кДж/моль.
3-7. Найдите rH0298 для реакции
CH4 + Cl2 = CH3Cl(г) + HCl(г),
если известны теплоты сгорания метана ( cH0(CH4) = -890.6 кДж/моль), хлорметана (cH0(CH3Cl) = -689.8 кДж/моль), водорода ( cH0(H2) = -285.8 кДж/моль) и теплота образования
HCl (fH0(HCl) = -92.3 кДж/моль)).
3-8. Рассчитайте тепловой эффект реакции
NH3 + 5/4O2 = NO + 3/2 H2O(г)
при T = 298 K, если известны следующие данные:
H2O(г) = H2O(ж), H10 = -44 кДж/моль,
1/2N2 + 3/2H2 = NH3, H20 = -46.2 кДж/моль,
H2 + 1/2O2 = H2O(ж), H30 = -285.8 кДж/моль,
NO = 1/2N2 + 1/2O2, H40 = -91.3 кДж/моль.
3-9. При взаимодействии 10 г металлического натрия с водой rH298 = -79.91 кДж, а при взаимодействии 20 г оксида натрия с водой rH298 = -76.76 кДж. Вода берется в большом избытке. Рассчитайте теплоту образования оксида натрия fH0298(Na2O), если fH0298(H2Oж) = -285.8 кДж/моль.
3-10. Энергия связи в молекуле H2 равна 432.1 кДж/моль, а энергия связи в молекуле N2 равна 945.3 кДж/моль. Какова энтальпия атомизации аммиа+ка, если энтальпия образования аммиака равна -46.2 кДж/моль?
3-11. Рассчитайте стандартный тепловой эффект реакции нейтрализации
NaOH + HCl = NaCl + H2O,
протекающей в водном растворе при 298 К.
3-12. Рассчитайте стандартный тепловой эффект реакции при 298 К
CaSO4(тв) + Na2CO3(aq) = CaCO3(тв) + Na2SO4(aq)
3-13. Напишите уравнение Кирхгофа для реакции, протекающей при постоянном объеме. 3-14. Зависимость теплового эффекта реакции CH3OH(г) + 3/2O2 = CO2 + 2H2O(г) от темпера-
туры выражается уравнением:
 (Дж) =
(Дж) =
Рассчитайте изменение теплоемкости Cp для этой реакции при 500 К.
3-15. Стандартная энтальпия образования Al2O3(тв) при 298 К равна -1675 кДж/моль. Рассчитайте стандартную энтальпию образования Al2O3(тв) при 800 К, если даны мольные теплоемкости (в Дж/(моль. К)):
Cp(Al) = 20.67 + 12.39. 10-3T, Cp(O2) = 31.46 + 3.39. 10-3T - 3.77. 105T-2, Cp(Al2O3) = 114.56 + 12.89. 10-3T - 34.31. 105T -2.
3-16. Энтальпия диссоциации карбоната кальция при 900 оС и давлении 1 атм равна 178 кДж/моль. Выведите уравнение зависимости энтальпии реакции от температуры и рассчитайте количество теплоты, поглощенное при разложении 1 кг карбоната кальция при 1000 оС и 1 атм, если
даны мольные теплоемкости (в Дж/(моль. К)):
Cp(СaCO3(тв)) = 104.5 + 21.92.10-3T - 25.94.105T-2, Cp(СaO(тв)) = 49.63 + 4.52.10-3T - 6.95.105T-2,
Cp(CO2(г)) = 44.14 + 9.04.10-3T - 8.53.105T-2.
3-17. Один моль метана, взятый при 25 оС и 1 атм, нагрет при постоянном давлении до удвоения объема. Мольная теплоемкость метана дается выражением:
Cp = 5.34 + 0.0115.T кал/(моль. К).
Рассчитайте U и H для этого процесса. Метан можно считать идеальным газом.
3-18. Человеческий организм в среднем выделяет 104 кДж в день благодаря метаболическим процессам. Основной механизм потери этой энергии - испарение воды. Какую массу воды должен ежедневно испарять организм для поддержания постоянной температуры? Удельная теплота испарения воды - 2260 Дж/г. На сколько градусов повысилась бы температура тела, если бы организм был изолированной системой? Примите, что средняя масса человека - 65 кг, а теплоемкость равна теплоемкости жидкой воды.

3-19. Один моль фтороуглерода расширяется обратимо и адиабатически вдвое по объему, при этом температура падает от 298,15 до 248,44 К. Чему равно значение CV?
VIII. ПЛАН РАБОТЫ НА ПРЕДСТОЯЩЕМ ЗАНЯТИИ:
1.Контроль и коррекция выполнения домашнего задания.
2.Разбор основных теоретических вопросов темы.
3.Решение задач.
4.Тестовый контроль.
5.Выполнение лабораторной работы ―Определение константы калориметра по известному тепловому эффекту процесса‖.
Лабораторная работа №1
«Определение константы калориметра по известному тепловому эффекту процесса»
Экспериментальное определение тепловых эффектов проводят в специальных приборах – калориметрах, имеющих различные конструкции. Калориметры бывают изотермические и адиабатические. Устройство калориметра и сложность калориметрической установки зависят от вида химической реакции, тепловой эффект которой определяют, а также от желаемой точности получаемых результатов. В более простых случаях, когда исходные и конечные продукты реакции жидкие или растворы и объем системы изменяется мало, калориметр может быть построен из двух вставленных один в другой стаканов. В особенно сложных случаях, когда в процессе реакции из твердых веществ или жидкостей образуются газы, реагирующие вещества помещают в герметические калориметрические бомбы, способные выдерживать большие давления. Это позволяет вести реакции при постоянном объеме и получать QV= U, т.к. работа расширения при этом равна 0.
Простейший калориметр состоит из изотермической оболочки с крышкой, в которую помещают калориметрический стакан. В зависимости от целей работы стакан заполняют различной калориметрической жидкостью: водой, раствором щелочи и т. д. В жидкость опускают мешалку и термометр для измерения температуры в ходе калориметрического опыта. На крышке изотермической оболочки имеется отверстие для ввода в калориметр исследуемого вещества. Уравнение теп-
лового баланса калориметрического опыта можно записать в виде:
H K t ,
где H – тепловой эффект процесса, протекающего в калориметре;t - изменение температуры в опыте;
К - постоянная калориметра.
Постоянная калориметра равна количеству теплоты, необходимому для нагревания всех частей калориметра на 10 С:
Если t = 1 C, то К = Н
Величину постоянной калориметра приближенно можно рассчитать как сумму теплоемкостей всех частей калориметра, участвующих в теплообмене.
K mici
i
mi – масса отдельных частей калориметра, участвующих в теплообмене; ci - их удельные теплоемкости.
Постоянную калориметра можно определить, если измерить в калориметрическом опыте изменение температуры t при растворении в заданном объеме растворителя соли массой m с известной интегральной теплотой растворения Hраств.
Тепловой эффект калориметрического опыта при растворении соли будет равен:
H H РАСТВ n H РАСТВ Mm , где
m – масса соли, г
М – молярная масса соли, г/моль.
Постоянную калориметра рассчитывают по формуле:

|
|
|
|
K |
H |
|
|
|
|
|
|
|
|
t |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
ХОД ВЫПОЛНЕНИЯ РАБОТЫ |
|
|
|
|
||||
|
|
|
|
|
|
|
|||
|
ВИД ДЕЙСТВИЯ |
|
|
|
СПОСОБ ДЕЙСТВИЯ |
||||
1. Собрать калориметр |
|
|
1. В стакан емкостью 0,5 л налить 400 мл дис- |
||||||
|
|
|
тиллированной воды. Закрыть калориметр крышкой, |
||||||
|
|
|
чтобы получилась закрытая калориметрическая систе- |
||||||
|
|
|
ма. |
|
|
|
|
|
|
2. |
Провести |
«предварительный |
|
|
1. Медленно размешивая мешалкой воду, запи- |
||||
период» калориметрического опыта. |
сывать в течение 5 мин показания термометра через |
||||||||
|
|
|
каждые 30-60 с. |
|
|
|
|||
3. Провести «главный» и «заклю- |
|
|
1. На 5-й минуте, не отключая мешалку и се- |
||||||
чительный периоды» калориметрического |
кундомер, открыть пробку на крышке калориметра и |
||||||||
опыта, растворив навеску хлорида калия в |
быстро всыпать навеску хлорида калия массой 11,4 г. |
||||||||
воде. |
|
|
Продолжать записывать температуру через каждую |
||||||
|
|
|
минуту до тех пор пока вся соль не раствориться и |
||||||
|
|
|
температура раствора не станет почти постоянной. По- |
||||||
|
|
|
сле этого продолжать запись показаний термометра |
||||||
|
|
|
еще в течение 5 минут. |
|
|
|
|||
4. Определить изменение темпера- |
|
|
1. Данные наблюдения записать в таблицу. |
||||||
туры t калориметрического опыта. |
|
|
2. На основании полученных данных построить |
||||||
|
|
|
на миллиметровой бумаге график (аналогичный, пред- |
||||||
|
|
|
ставленному на рисунке), отложив по оси абсцисс |
||||||
|
|
|
время ( , мин) в масштабе 1 мин=0,5 –1 см, а по оси |
||||||
|
|
|
ординат – температуру (t, С). Выбор масштаба по оси |
||||||
|
|
|
ординат зависит от величины t. При t меньше одно- |
||||||
|
|
|
го градуса выбирают масштаб 10С = 10 см, а при t |
||||||
|
|
|
больше одного градуса – 10С = 5 -10 см. График, отра- |
||||||
|
|
|
жающий зависимость t0 C = f ( ) должен иметь вид: |
||||||
Рис. |
Кривая |
калориметрического |
1 – начальный период |
|
|
|
|||
опыта при экзотермическом процессе. |
2 - |
главный период |
|
|
|
||||
|
|
|
3 – заключительный период |
|
|
||||
|
|
|
|
|
отрезок EF = t. |
|
|
|
|
|
|
|
|
||||||
5. Вычислить постоянную кало- |
|
|
1. Вычисления провести по формуле: |
||||||
риметра. |
|
|
K |
H |
, где H H РАСТВ |
(KCl) |
mKCl |
|
|
|
|
|
t |
M KCl |
|||||
|
|
|
|
|
|
||||
|
|
|
Табличные данные: |
|
|
|
|||
|
|
|
HРАСТВ(KCl) = 14,7 кал/моль; M(KCl) = 74,5 г/моль |
||||||
Приложение
Рекомендации к оформлению лабораторной работы
Оформление лабораторной работы должно осуществляться следующим образом:
1.Название.
2.Цель.
3.Основные теоретические положения, схема установки, расчетные уравнения.
4.Экспериментальная часть:
1)Последовательность выполнения работы.
2)Запись измерения температур во время опыта :
Время от на- |
Предваритель- |
Главный |
|
Заключитель- |
|||||
чала опыта, |
ный период |
период |
|
ный период |
|||||
мин. |
0 |
|
|
|
|
|
|
|
|
t0C |
|
|
|
|
|
|
|
|
|
1.Обработка экспериментального материала:
1)Построение графика,
2)Результаты вычислений.
2.Вывод.
ТЕМА № 4
ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ. ЭНТРОПИЯ И ЕЕ ИЗМЕНЕНИЕ В РАЗЛИЧНЫХ ПРОЦЕССАХ
I. МОТИВАЦИЯ ЦЕЛИ:
Второй закон термодинамики – закон о возможности протекания самопроизвольных процессов. Он устанавливает критерии необратимости термодинамических процессов. На его основании можно предсказать, при каких внешних условиях возможен процесс и в каком направлении он будет протекать, что представляет большой практический и теоретический интерес.
Третий закон термодинамики – закон об абсолютном значении энтропии, который был сформулирован уже в начале XX столетия. На его основе можно вычислить константу равновесия химической реакции, а, следовательно, и максимально возможный выход продукта реакции, не прибегая к опытному ее определению ни при одной из температур.
II. ЦЕЛЬ САМОПОДГОТОВКИ:
1.Усвоить содержание II и III начал термодинамики, знать их различные характери-
стики.
2.Научиться рассчитывать абсолютную и стандартную энтропии, изменение энтропии
вразличных физико-химических процессах.
III. ИСХОДНЫЙ УРОВЕНЬ ЗНАНИЙ:
a.Понятие о термодинамических функциях состояния, системах, параметрах.
b.Первый закон термодинамики.
c.Приемы дифференцирования и интегрирования.
IV. П Л А Н И З У Ч Е Н И Я Т Е М Ы:
1.Самопроизвольный процесс. Признаки самопроизвольного процесса.
2.Равновесные и неравновесные процессы.
3.Обратимые и необратимые процессы. Критерии термодинамически обратимого
процесса.
4.Тепловая машина Карно. КПД тепловой машины. Цикл Карно как основа II начала термодинамики.
5.Второй закон термодинамики: словесные формулировки и математические уравнения, его выражающие. Статистическая природа II начала термодинамики.
6.III закон термодинамики. Абсолютная и стандартная энтропии.
7.Тепловая теорема Нернста.
8.Энтропия – определение понятию. Многоплановый смысл и свойства энтропии:
-функция состояния;
-мера «связанной энергии»;
-мера необратимости процесса;
-мера неупорядоченности в системе;
-критерий направленности и предела самопроизвольного процесса в изолированных систе-
мах.
9.Связь энтропии с термодинамической вероятностью системы в данном состоянии – уравнение Больцмана. Статистический характер энтропии.
10.Изменение энтропии в обратимом и необратимом процессах для изолированной и неизолированной систем.
11.Расчет изменения энтропии в различных процессах.
12.Связь I и II законов термодинамики.
V. ЛИТЕРАТУРА:
1.А.П. Беляева и др. Физическая и коллоидная химия. М.: ГЭОТАР-Медиа, 2008, с. 53-63.
2.Евстратова К. И., Купина Н. А., Малахова Е.Е. Физическая и коллоидная химия М., 1990, с.
15-18, 35-42.
3.Киреев В. А. Краткий курс физической химии М. 1978, с. 202-217.

4.К.С. Краснов Физическая химия. - М., Высшая школа, 2001, с. 235-241, 251-260.
5.Стромберг А. Г., Семченко Д.П. Физическая и коллоидная химия, М. 1999, с. 81-93.
6.Лекционный материал
VI. В О П Р О С Ы Д Л Я С А М О К О Н Т Р О Л Я:
1.Дайте определение энтропии, исходя из соотношения
dS Q T
2.Напишите математическое соотношение между изменением энтропии и теплотой необратимого процесса, протекающего в неизолированной системе.
3.Как изменяется энтропия в изолированной системе при самопроизвольном течении
процесса?
4.В каком соотношении находятся молярные энтропии трех агрегатных состояний одного вещества: газа, жидкости и твердого тела?
5.В изолированной системе самопроизвольно протекает химическая реакция с образованием некоторого количества конечного продукта. Как изменяется энтропия системы?
6.Как изменяется энтропия:
а) при кристаллизации 1 моль жидкой воды; б) при плавлении 1 моль льда;
в) при нагревании 1 моль воды от 20 ОС до 50 ОС.
7.Приведите уравнение для расчета изменения энтропии 1 моль бензола при нагревании его от 0 ОС до 20 ОС. Температура плавления бензола 5,5 ОС.
8.Как изменяется энтропия изолированной системы, в которой обратимо кристаллизуется вещество?
9.Дайте определение:
а) абсолютной энтропии; б) стандартной энтропии.
10.Приведите уравнение Больцмана, устанавливающее связь между энтропией и термодинамической вероятностью состояния системы.
11.Приведите толкование понятия "связанная энтропия" (TS).
12.Как изменяется связанная энергия системы TS при:
а) нагревании газа; б) при конденсации водяного пара в жидкость? Ответ обосновать.
13.К какому значению стремится энтропия правильно образованного кристалла при приближении температуры к абсолютному нулю.
14.Напишите математическое выражение второго закона термодинамики для бесконечно малого изменения состояния в обратимом и необратимом процессах, протекающих в неизолированной системе.
VII. ОБЯЗАТЕЛЬНЫЕ ДЛЯ ВЫПОЛНЕНИЯ ЗАДАНИЯ:
Примеры решения задач
Пример 4-1 Рассчитайте изменение энтропии при нагревании 0.7 моль моноклинной серы от 25 до 200 оС при давлении 1 атм. Мольная теплоемкость серы равна:
Cp(Sтв) = 23.64 Дж/(моль. К),
Cp(Sж) = 35.73 + 1.17. 10-3. T Дж/(моль. К).
Температура плавления моноклинной серы 119 оС, удельная теплота плавления 45.2 Дж/г. Решение. Общее изменение энтропии складывается из трех составляющих: 1) нагревание
твердой серы от 25 до 119 оС, 2) плавление, 3) нагревание жидкой серы от 119 до 200 оС. 4.54 Дж/К.
2.58 Дж/К.

 S =
S = 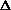 S1 +
S1 +  S2 +
S2 +  S3 = 11.88 Дж/К.
S3 = 11.88 Дж/К.
Ответ. 11.88 Дж/К.
Пример 4-2. Найдите изменение энтропии газа и окружающей среды, если n молей идеального газа расширяются изотермически от объема V1 до объема V2: а) обратимо; б) против внешнего давления p.
Решение. а) Изменение энтропии газа при обратимом изотермическом расширении можно найти с помощью термодинамического определения энтропии с расчетом теплоты расширения по первому закону:
 .
.
Так как расширение обратимое, то общее изменение энтропии Вселенной равно 0, поэтому изменение энтропии окружающей среды равно изменению энтропии газа с обратным знаком:
 .
.
б) Энтропия - функция состояния, поэтому изменение энтропии системы не зависит от того, как совершался процесс - обратимо или необратимо. Изменение энтропии газа при необратимом расширении против внешнего давления будет таким же, как и при обратимом расширении. Другое дело - энтропия окружающей среды, которую можно найти, рассчитав с помощью первого закона теплоту, переданную системе:
 .
.
В этом выводе мы использовали тот факт, что  U = 0 (температура постоянна). Работа, совершаемая системой против постоянного внешнего давления равна: A = p(V2-V1), а теплота, принятая окружающей средой, равна работе, совершенной системой, с обратным знаком.
U = 0 (температура постоянна). Работа, совершаемая системой против постоянного внешнего давления равна: A = p(V2-V1), а теплота, принятая окружающей средой, равна работе, совершенной системой, с обратным знаком.
Общее изменение энтропии газа и окружающей среды больше 0:
 ,
,
как и полагается для необратимого процесса.
Пример 4-3.Расчитайте изменение энтропии 1000 г воды в результате ее замерзания при -5 ОС. Теплота плавления льда при 0оС равна 6008 Дж/моль. Теплоемкости льда и воды равны 34.7 и 75.3 Дж/(моль. К), соответственно. Объясните, почему энтропия при замерзании уменьшается, хотя процесс - самопроизвольный.
Решение. Необратимый процесс замерзания воды при температуре -5 ОС можно представить в виде последовательности обратимых процессов: 1) нагревание воды от -5 ОС до температуры замерзания (0 ОС); 2) замерзание воды при 0 ОС; 3) охлаждение льда от 0 до -5 ОС:
Изменение энтропии в первом и третьем процессах (при изменении температуры) рассчитывается по формуле (4.9):
77.3 Дж/К.

-35.6 Дж/К.
Изменение энтропии во втором процессе рассчитывается как для обычного фазового перехода (4.13). Необходимо только иметь в виду, что теплота при замерзании выделяется:
-1223 Дж/К.
Т.к. энтропия - функция состояния, общее изменение энтропии равно сумме по этим трем процессам:
 S =
S =  S1 +
S1 +  S2 +
S2 +  S3 = -1181 Дж/К.
S3 = -1181 Дж/К.
Энтропия при замерзании убывает, хотя процесс самопроизвольный. Это связано с тем, что в окружающую среду выделяется теплота и энтропия окружающей среды увеличивается, причем это увеличение больше, чем 1181 Дж/К, поэтому энтропия Вселенной при замерзании воды возрастает, как и полагается в необратимом процессе.
Ответ. -1181 Дж/К.
4-1. Приведите пример термодинамического процесса, который может быть проведен как обратимо, так и необратимо. Рассчитайте изменение энтропии системы и окружающей среды в обоих случаях.
4-2. Рассчитайте изменение энтропии при образовании 1 м3 воздуха из азота и кислорода (20 об.%) при температуре 25 оС и давлении 1 атм.
4-3. Рассчитайте мольную энтропию неона при 500 К, если при 298 К и том же объеме энтропия неона равна 146.2 Дж/(моль. К).
4-4. Рассчитайте изменение энтропии при нагревании 11.2 л азота от 0 до 50 оС и одновременном уменьшении давления от 1 атм до 0.01 атм.
4-5. Один моль гелия при 100 оС и 1 атм смешивают с 0.5 моль неона при 0 оС и 1 атм. Определите изменение энтропии, если конечное давление равно 1 атм.
4-64-7. Три моль идеального одноатомного газа (CV = 3.0 кал/(моль. К)), находящегося при T1 = 350 K и P1 = 5.0 атм, обратимо и адиабатически расширяются до давления P2 = 1.0 атм. Рассчитайте конечные температуру и объем, а также совершенную работу и изменение внутренней энергии, энтальпии и энтропии в этом процессе.
4-8. Рассчитайте изменение энтропии при нагревании 0.4 моль хлорида натрия от 20 до 850
оС. Мольная теплоемкость хлорида натрия равна:
Cp(NaClтв) = 45.94 + 16.32. 10-3. T Дж/(моль. К),
Cp(NaClж) = 66.53 Дж/(моль. К).
Температура плавления хлорида натрия 800 оС, теплота плавления 31.0 кДж/моль.
4-9. Рассчитайте изменение энтропии при смешении 5 кг воды при 80 оС с 10 кг воды при 20оС. Удельную теплоемкость воды принять равной: Cp(H2O) = 4.184 Дж/(г. К).
4-10. Рассчитайте изменение энтропии при добавлении 200 г льда, находящегося при температуре 0 оС, к 200 г воды (90 оС) в изолированном сосуде. Теплота плавления льда равна 6.0 кДж/моль.
4-11. Запишите выражение для расчета абсолютной энтропии одного моль воды при температуре 300 0С и давлении 2 атм.
4-12. Нарисуйте график зависимости стандартной энтропии воды от температуры в интервале от 0 до 400 К.
4-13. Рассчитайте изменение энтропии 1000 г метанола в результате его замерзания при - 105 ОС. Теплота плавления твердого метанола при -98 оС (т.пл.) равна 3160 Дж/моль. Теплоемкости твердого и жидкого метанола равны 55.6 и 81.6 Дж/(моль. К), соответственно. Объясните, почему энтропия при замерзании уменьшается, хотя процесс - самопроизвольный.
4-14.Пользуясь справочными данными, рассчитайте стандартное изменение энтропии в ре-
акции H2(г) + ЅO2(г) = H2O(г) а) при 25 оС; б) при 300 оС.
4-15. Теплоемкость некоторого вещества в интервале температур от T1 до T2 изменяется следующим образом:

Постройте график зависимости энтропии вещества от температуры в этом интервале темпе-
ратур.
4-16. Пользуясь справочными данными, приведите пример самопроизвольной химической реакции, для которой стандартное изменение энтропии меньше 0.
VIII. ПЛАН РАБОТЫ НА ПРЕДСТОЯЩЕМ ЗАНЯТИИ:
1.Контроль и коррекция выполнения домашнего задания.
2.Разбор основных теоретических вопросов темы.
3.Решение задач.
4.Тестовый контроль.
5.Выполнение лабораторной работы ―Определение теплоты растворения хорошо растворимой соли‖
Лабораторная работа№2
«Определение теплоты растворения хорошо растворимой соли».
При растворении соли в жидкости имеют место два процесса: разрушение кристаллической решетки – эндотермический процесс и сольватация (гидратация) ионов - экзотермический процесс. В зависимости от соотношения этих тепловых эффектов, которое определяется природой растворенного вещества и растворителя, теплота растворения соли может быть как положительной ( Н > 0), так и отрицательной ( Н < 0) величиной.
Выделяют понятие интегральная теплота растворения – тепловой эффект растворения 1 моль вещества в таком количестве растворителя, который образует раствор определенной моляльности (b).
ВИД ДЕЙСТВИЯ |
СПОСОБ ДЕЙСТВИЯ |
1. Собрать калориметр |
1. Смотреть 1 и 2 этапы работы преды- |
и провести «предвари- |
дущего занятия. |
тельный период» кало- |
|
риметрического опыта. |
|
2. Провести «главный» |
1. На 5-й минуте опыта, не отключая |
и «заключительный |
мешалку и секундомер, открыть проб- |
периоды» калоримет- |
ку и быстро всыпать 5 г хлорида аммо- |
рического опыта. |
ния. |
|
2. Продолжить записывать температу- |
|
ру через каждую минуту до тех пор, |
|
пока вся соль не растворится и не уста- |
|
новится изменение температуры, не |
|
превышающее 0,010С. После этого за- |
|
писать еще 3-4 показания термометра. |
3. Определить измене- |
1. Результаты измерений «предвари- |
ние температуры t |
тельного‖ и ―заключительного перио- |
калориметрического |
дов‖ калориметрического опыта зане- |
опыта. |
сти в таблицу (см. приложение к лабо- |
|
раторной работе №1) |

2. На основании полученных данных построить график t = f( ). По графику определить t.
4. Рассчитать удельную 5. Используя значение постоян- и интегральную теплоной калориметра из предыдущего заняты растворения соли. тия, рассчитать удельную теплоту рас-
творения по формуле:
HУД K t , m
где К – постоянная калориметра, m – масса растворенной соли, г,
а также интегральную теплоту растворения:
HУД K tМ , где m
М – молярная масса соли.
5. Вычислить погрешность опыта, используя табличное значение интегральной теплоты растворения хлорида аммония.
