
Культуральные свойства бактерий
.docxКультуральные свойства бактерий
При росте на жидких питательных средах бактерии чаще всего вызывают равномерное помутнение, иногда — выпадение осадка: крошковатого (стрептококки), хлопьевидного (стрептобациллы), бульон при этом остается прозрачным. Некоторые бактерии образуют пленку на поверхности жидкой среды: сухую чешуйчато-бородавчатую (туберкулезная палочка), тонкую, нежную (холерный вибрион), рыхлую, с отходящими вниз отростками — «сталактитами» (возбудитель чумы). Еще более разнообразен рост бактерий на плотных питательных средах. Образуемые при этом колонии различаются по многим признакам: размерам, форме, консистенции, структуре, прозрачности, цвету и др.
Колонии бывают очень мелкими (0,1-0,5 мм), мелкими (0,5-3,0 мм), средних размеров (3-5 мм) и крупными (более 5 мм в диаметре). Они могут быть круглыми (дисковидными); плоскими; иметь форму, напоминающую львиную гриву («голову Медузы»); ризоидными и т. п.. Края колонии могут быть гладкими, зазубренными, фестончатыми, изрезанными. Поверхность колонии бывает гладкая или шероховатая, влажная или сухая, ровная или складчатая, плоская или выпуклая, а ее консистенция — плотная, рыхлая, слизистая. Колонии могут быть прозрачными, полупрозрачными, непрозрачными и различаться по другим признакам, например у некоторых бактерий центр мутный, а периферическая зона полупрозрачна.
Все эти признаки, как правило, видоспецифичны, поэтому они имеют важное диагностическое значение, т. е. их изучение используется для определения видовой принадлежности исследуемой культуры. Например, при определенных условиях роста колонии Salmonella paratyphi В имеют характерный слизистый валик по периферии, напоминая пуговицу с валиком.
Колонию бактерий можно рассматривать как своеобразный сложный организм. Изучение организации колонии выявило морфологическую и физиологическую гетерогенность входящих в нее клеток. В колониях сосуществуют популяции активно размножающихся, покоящихся клеток и клеток лизирующихся. Видовое своеобразие свойств колоний указывает на регулируемый характер процесса их формирования. Он управляется с помощью контактных, дистантных и, вероятно, иных сигналов и служит проявлением у бактерий апоптоза. Постоянное наблюдение за бактериями на экране монитора требует регулярного обслуживания компьютеров.
Апоптоз (греч. apoptosis — опадание лепестков цветов или листьев дерева) — форма запрограммированной клеточной гибели у эукариот, благодаря которой удаляются определенные клоны дифференцирующихся клеток или «излишки» биологического материала. Апоптоз у бактерий — аналог апоптоза эукариот — пример запрограммированного контроля над клетками на уровне популяции (колония, стационарная культура, популяции в других природных условиях). Суть его сводится к тому, что при исчерпании питательного субстрата голодающая популяция разделяется на две субпопуляции, одна из которых гибнет и подвергается автолизу, а клетки другой субпопуляции, используя продукты автолиза как субстрат, продолжают размножаться.
Механизм генетического контроля апоптоза у Е. coli установлен. Он осуществляется особым опероном из 2 генов: mazE и mazF. Продукт гена mazF — стабильный цитотоксический белок-киллер, а продукт гена mazE — нестабильный белок MazE, разрушающий белок-киллер. Истощение фонда аминокислот в питательной среде приводит к блокированию оперона maz, в результате этого синтез белка MazE прекращается, а белок-киллер вызывает гибель и автолиз части популяции. Фонд аминокислот в среде за счет этого пополняется, синтез белка MazE у оставшихся живых клеток активируется, и они продолжают размножаться. Таким образом, апоптоз регулирует формирование колоний и поведение клеток в стационарных культурах. Возможно, этот механизм причастен и к образованию НФБ.
Культуры некоторых видов бактерий обладают характерным запахом, иногда он связан с разложением органических веществ, которое сопровождается образованием скатола, индола, сероводорода, меркаптана, масляной кислоты, аммиака и т. п. Культуры дизентерийных бактерий при росте на МПА издают запах, напоминающий запах мужского семени. Продукты жизнедеятельности ряда других видов бактерий обладают приятным ароматным запахом, который связан с образованием различных эфиров: уксусно-этилового, уксусно-амилового или диацетила. Возбудитель мочки льна, например, издает запах ананаса. Особые расы молочнокислых бактерий придают аромат пищевым продуктам.
В природе существуют так называемые фосфоресцирующие бактерии, т. е. бактерии, культуры которых светятся в темноте зеленовато-голубоватым или желтоватым цветом. Такие фосфоресцирующие бактерии встречаются, главным образом, в морской и речной воде. Фосфоресценция (люминесценция) продолжается иногда несколько часов и даже суток. Она представляет собой особую форму освобождения энергии возбужденных электронов. Такие бактерии нередко обнаруживаются на мясе, чешуе рыб и других объектах. К светящимся бактериям — фотобактериям — относятся физиологически сходные, но морфологически отличающиеся аэробные бактерии (вибрионы, палочки, кокки).
Биохимические свойства бактерий можно начинать изучать одновременно с выделением культуры, засевая материал на специальные питательные среды, позволяющие судить о биохимической активности выделяемых микроорганизмов.
Наиболее показателен в этом отношении культуральный метод диагностики инфекций, вызываемых энтеробактериями: так как сотни входящих в это семейство видов практически идентичны друг другу по морфологическим и культуральным свойствам, их биохимические свойства играют очень большую роль в процессе идентификации. Именно на этом примере мы и разберем данный вопрос. А. На первом этапе патологический материал засевают на дифференциально-диагностические среды для кишечной группы бактерий. В состав этих сред, наряду с мясопептонным агаром, входит лактоза и индикатор. Если бактерия способна ферментировать лактозу (важный признак для дифференциации различных энтеробактерий), рН среды смещается в кислую сторону и индикатор окрашивает колонию в соответствующий цвет. В нашей стране наиболее распространены среды Эндо, Левина и Плоскирева; в других странах могут использоваться иные среды, принцип действия которых, однако, идентичен этим трем. 1. Среда Эндо (в англоязычной литературе “Endo Agar”) содержит в качестве индикатора основной фуксин, обесцвеченный сульфитом натрия. а. Лактозопозитивные колонии на среде Эндо – красные (кишечная палочка с типичной биохимической активностью образует на этой среде темно-красные колонии с металлическим блеском, схожим с блеском ртути). б. Лактозонегативные колонии на среде Эндо бесцветные, но так как энтеробактерии образуют прозрачные и полупрозрачные колонии, то они могут приобретать оттенок той среды, на которой вырастают. 2. Среда Левина содержит К2НРО4, метиленовый синий и эозин. В англоязычной литературе более употребительное название для этой среды “Eosin Methylene Blue Agar”, иногда – “Eosin Methylene Blue Agar (Levine)”. а. Лактозопозитивные колонии на среде Левина – насыщенного синего цвета. б. Лактозонегативные колонии на среде Левина бесцветные. 3. Среда Плоскирева содержит кроме лактозы и индикатора (нейтрального красного) еще и брилли-антовый зеленый, соли желчных кислот, минеральные соли. Раньше эту среду часто называли «бактоагар Ж». За рубежом аналогом этой среды выступает “MacConkey Agar”. а. Лактозопозитивные колонии на среде Плоскирева – красные. б. Лактозонегативные колонии на среде Плоскирева бесцветные. Б. На II этапе отобранную для дальнейшей работы колонию засевают на среды накопления и первичной дифференциации. Эти среды содержат уже несколько субстратов, по отношению к которым определяется ферментативная активность изучаемой бактериальной культуры, кроме того, эти среды формируются в пробирки так, чтобы получился участок со столбиком и участок скошенного агара. Изучаемая колония засевается в столбик уколом, а на скошенную часть среды – плотным штрихом. 1. Среда Рессела содержит глюкозу и лактозу. а. Если культура ферментирует только глюкозу, не ферментируя лактозу, то измениться цвет только столбика, без изменения цвета скошенной части. б. Если культура ферментирует и глюкозу и лактозу, то изменится цвет всей среды – и столбика и скошенной части. 2. Среда Клиглера содержит не только глюкозу и лактозу, но и ингредиенты, позволяющие определить наличие сероводорода. а. Если культура ферментирует только глюкозу, не ферментируя лактозу, то измениться цвет только столбика, без изменения цвета скошенной части. б. Если культура ферментирует и глюкозу и лактозу, то изменится цвет всей среды – и столбика и скошенной части. в. Если культура продуцирует сероводород, место засева уколом чернеет. 3. Среда Олькеницкого по составу аналогична среде Клиглера, но в нее вводится еще и мочевина (с индикатором щелочения, так как при ферментации мочевины образуется аммиак). Эту среду называют еще «трехсахарным агаром», так как в ее состав входит еще и сахароза, однако отдельно ферментацию сахарозы на этой среде не определяют. а. Если культура ферментирует только глюкозу, не ферментируя лактозу, то изменится цвет только столбика, без изменения цвета скошенной части. б. Если культура ферментирует и глюкозу и лактозу, то изменится цвет всей среды – и столбика и скошенной части. в. Если культура продуцирует сероводород, место засева уколом почернеет. г. Наличие уреазной активности определяется по покраснению среды. В. На III этапе биохимические свойства выделенной культуры изучаются более детально. 1. Сахаролитические свойства изучаются на средах Гисса. Среда Гисса представляет собой столбик полужидкого агара (засевается уколом), в состав которого входит определенный углевод и индикатор. Принцип действия среды Гисса аналогичен принципу действия вышеописанных сред, но так как среда полужидкая, то в положительном случае (ферментации данного углевода) она полностью меняет цвет. Конкретная световая гамма сред Гисса зависит от вводимого в их состав индикатора (индикатор Андреде обуславливает переход от синего, если углевод не утилизируется, к красному, при утилизации углевода; индикатор ВР – водный голубой и розоловая кислота – наоборот, от красного к синему и т.п.). Совокупность сред Гисса, используемых для засева бактериальной культуры, называется рядом Гисса или пестрым рядом. а. Наиболее информативны при дифференциации энтеробактерий пять углеводов: лактоза, глюкоза, манит, мальтоза и сахароза. Пять сред Гисса с этими углеводами называют коротким рядом Гисса (во всех бактериологических лабораториях стран СНГ они располагаются в штативе именно в таком порядке, в котором они здесь перечислены, что позволяет легче визуализировать результат анализа). б. В случае необходимости определяют способность изучаемой культуры ферментировать и большее количество субстратов (моносахаридов, полисахаридов, спиртов). Тогда говорят о длинном ряде Гисса. 2. Протеолитические свойства бактериальной культуры определяют, засевая ее на среды с белковыми субстратами (желатин, пептон и др.). а. Желатин используется как показатель наличия или отсутствия у изучаемой бактериальной культуры протеолитической активности как таковой. 1. Если бактерии обладают протеолитической активностью, то они будут разжижать столбик желатина, засеваемый уколом. При этом для идентификации некоторых видов значение имеет и то, как именно разжижается желатин (послойно, перевернутой елочкой, воронкой и т.п.). 2. Бактерии, не обладающие протеолитической активностью, желатин не разжижают. б. У микробов, обладающих протеолитической активностью, при утилизации белкового субстрата может образовываться (или не образовываться) индол. 1. Для определения продукции бактериальной культурой индола применяется способ Мореля. Культуру засевают в мясопептонный бульон или пептонную воду (лучше с добавлением триптофана, при утилизации которого выделяется значительное количество этого газа) и под пробку помещают фильтровальную бумагу, пропитанную щавелевой кислотой. а. При продукции бактериальной культурой индола нижняя часть бумажки краснеет. б. Если культура не продуцирует индол – бумажка остается бесцветной. 2. Более надежен способ Эрлиха. В пробирку с изучаемой культурой добавляют специальный реактив. а. В присутствии индола реактив краснеет. б. Если индола нет – реактив остается бесцветным. в. У микробов, обладающих протеолитической активностью, при утилизации белкового субстрата может образовываться (или не образовываться) аммиак. Для выявления этого признака под пробку пробирки с засеянной питательной средой помещают лакмусовую бумагу так, чтобы она не касалась поверхности среды. 1. При образовании аммиака лакмусовая бумажка синеет. 2. Если аммиак не образовывается, лакмусовая бумажка цвет не изменяет. г. У микробов, обладающих протеолитической активностью, при утилизации белкового субстрата может образовываться (или не образовываться) сероводород. 1. С этой целью под пробку пробирки с засеянной питательной средой помещают фильтровальную бумагу, пропитанную ацетатом свинца. а. При продукции бактериальной культурой сероводорода нижняя часть бумажки чернеет. б. Если культура не продуцирует сероводород – бумажка остается бесцветной. 2. Однако, метод с использованием бумажки с ацетатом свинца не надежен и в настоящее время практически не используется. Продукцию бактериями сероводорода лучше определять с помощью сред Клиглера или Олькеницкого (см. выше). 2. В ряде случаев для идентификации выделенной бактериальной культуры необходимо определить продуцирует ли она конкретные ферменты. Чаще всего выясняется наличие оксидазной и каталазной активностей. 1. Каталаза, продуцируемая бактериями, будет разлагать перекись водорода на воду и кислород, выделение которого в виде пузырьков и регистрируется. 2. Если каталазной активности у бактериальной культуры нет, пузырьков не будет.
Культуральные признаки микробов определяются характером роста их на питательных средах. Будучи постоянными. для каждого вида микроба, они являются важным диагностическим признаком. Рост микробов на плотной питательной среде. Для изучения свойств колоний микробы культивируют на плотных питательных средах в чашках Петри. При посеве материала •-стараются получить изолированный рост колоний.
МЕТОДЫ ИЗУЧЕНИЯ КУЛЬТУРАЛЬНЫХ СВОЙСТВ МИКРОБОВ
Чашки с посевом просматривают сначала невооруженным глазом или - через лупу, затем помещают их на столик микроскопа вверх. дном и просматривают колонии в проходящем свете с объективом малого увеличения и с суженной диафрагмой. Колонии характеризуют по величине, форме, контуру >края, рельефу, поверхности, цвету, структуре и консистенции. Величина колонии определяется ее диаметром. В зависимости от диаметра различают колонии точечные (диаметр меньше 1 мм), мелкие (диаметр 1—2 мм), средние (диаметр 2—4 мм) и крупные (диаметр 4—6 мм и более). Форма колонии бывает правильная — круглая, неправильная — амебовидная, ризоидная — корневидная, напоминающая переплетающиеся корни деревьев. Характер контура края определяют при рассмотревши колонии под лупой или микроскопом с малым увеличением. Различают ровные края в виде четко выраженной линии и неровные.
Последние делят на: 1) фестончатый край, состоящий из крупных, слегка округлых или уплощенных зубцов правильной формы; 2) волнистый край, который несколько отличается от фестончатого тем, что крупные зубцы его выражены нечетко; 3) эрозированный, илн зазубренный, край, состоящий из--острых зубцов различной величины и формы; 4) бахромчатый край, имеющий нежные ворсинки. В некоторых случаях четко выраженная линия, отграничивающая колонию от поверхности среды, отсутствует. Таков край колонии называется расплывчатым. Рельеф колонии характеризуется приподнятостью ее над поверхностью питательной среды и контуром формы в-вертикальном разрезе. Определяется рельеф колонии невооруженным глазом или с лупой при рассматривании сверху и сбоку.
Различают: 1) каплеобразные и куполообразные колонии правильной круглой формы с различно выраженной степенью выпуклости, которые в вертикальном разрезе представляют собой сегмент шара и отличаются только длиной радиуса. Колонии слабовыпуклые имеют большую длину радиуса; куполообразные — меньшую; 2) колонии плоско-выпуклые с плоским верхом, пологими или круто обрывающимися краями; имеют в вертикальном разрезе форму трапеции; 3) колонии конусообразные, имеющие" в вертикальном разрезе форму треугольника; 4) колонии с приподнятой в виде соска серединой и валиком по периферии; 5) колонии с вдавленным центром; 6)' колонии плоские, стелющиеся по поверхности среды. Поверхность колонии изучают с помощью лупы или под микроскопом при малом увеличении. Поверхность колоний бывает матовая или блестящая с глянцем, сухая или влажная, гладкая или шероховатая. Гладкие колонии обозначают буквой S (smooth), шероховатые — буквой R (rough), что означает соответственно «гладкий» и «шероховатый». Механизм формирования гладких и шероховатых форм колоний обусловлен различием процессов клеточного деления
Микробные клетки в колониях S-форм располагаются, соприкасаясь своими боковыми поверхностями, клетки R-форм, сохраняя при делении цитоплазматические мостики, образуют цепочки, которые, накладываясь друг на друга, обусловливают шероховатую поверхность и неровный край колонии. Переход S-форм в R-формы наблюдается при диссоциации. Явление диссоциации у патогенных микробов наблюдается под действием антибиотико - и химиотерапии, факторов специфического иммунитета, формирующихся в течение инфекционного процесса, а также при попадании микробе в» внешнюю среду. Среди шероховатых форм колоний различают: складчатые, гирозные, по виду напоминающие исчерченную извилинами поверхность мозга; бородавчатые, концентрически или радиально исчерченные; шагреневые, т. е. мелкозернистые. Цвет колонии определяется пигментом, который продуцирует культура микробов. Преобладающее большинство патогенных бактерий пигмента не образует, вследствие чего колонии их бесцветны или молочно-мутного цвета, похожи на опал.
В проходящем свете такие колонии в большей или меньшей степени прозрачны. Пигментообразующие виды микробов дают колонии различных цветов: кремовые, желтые, золотисто-оранжевые, синие, красные, сиреневые, черные и др. Структура колоний определяется в проходящем свете при слабом увеличении микроскопа, суженной диафрагме или при несколько опущенном конденсоре. У пигментированных колоний и колоний, не пропускающих света, она не определяется. По характеру структуры различают следующие виды колоний: 1) гиалиновые — бесцветные, прозрачные, без видимой определенной структуры; 2) зернистые, которые в зависимости от величины зерен разделяются на мелко - и грубозернистые; 3) нитевидные или волокнистые, характеризующиеся наличием длинных, густо переплетающихся нитей в толще колонии. Колонии бывают однородные и неоднородные. Строение первых одинаково во всех частях, у вторых центральная часть отличается от периферической или отдельные сектора имеют строение, неодинаковое с остальной массой.
Консистенцию колонии, определяющую ее физическое состояние, исследуют посредством прикосновения или взятия из нее части материала бактериальной петлей.
Изолят (isolаte) – популяция бактериальных клеток в чистой культуре полученной в лаборатории из одной колонии с питательной среды и идентифицированная до уровня вида. Штамм – изолят или группа изолятов с одинаковыми фенотипическими и/или генотипическими признаками, относящиеся к определенному виду и имеющие отличия от других изолятов этого вида. Авторский штамм (т.е. полученный и описанный определенным автором) называют голотипом. Впервые описанный оригинальный штамм называется неотипом. Клон (отводок) – культура микроорганизмов, полученная в результате размножения одной бактериальной клетки и проявляюшая фенотипические и генотипические признаки свойственные типовому виду. Эпидемически значимые патогенные для человека микроорганизмы, склонные к быстрому распространению в популяции и характеризующиеся повышенной мутабельностью, вирулентностью и резистентностью формируются в естественных условиях и также представляют собой своеобразный клон или клональную группу [4,5,22,23].
Чистая культура – популяция бактерий, состоящая из особей одного вида. Смешанная культура-совокупность популяций бактерий разных видов. Термином «популяция» обозначают совокупность бактерий одного вида, вегетирующих в определенном биотопе или выращенных на искусственной питательной среде из одной или нескольких клеток.
Род – совокупность близкородственных видов. Каждый род имеет типовой вид, на основе которого он формируется. Вид Escherichia coli является типовым для рода Escherichia, а Corynebacterium diphtheria-типовым видом рода Corynebacterium. Триба (колено)-группа близкородственных родов. Например, роды Escherichia и Schigella в семействе энтеробактерий. Семейство – совокупность взаимосвязанных родов. Сходные семейства объединяются в порядок, а они, соответственно, в классы, филии, царство и домен. В практической медицинской бактериологии высшие таксоны – порядок, класс, филия(тип), царство имеют меньшее значение. В 1923 г. американский микробиолог Дэвид Берджи выпустил первый международный определитель бактерий. Н.А. Красильников (1949) в России также издал капитальный труд «Определитель бактерий и актиномицетов». Последующие выпуски определителя бактерий готовились международным комитетом по таксономии бактерий. Последний (одиннадцатый) выпуск состоялся в 2001 г[7]. В соответствии с ним живые организмы подразделяют на три домена – Bacteria (прокариоты или истинные бактерии), Archeae (предковые бактерии) и Eukaria (эукариотические клетки).
Номенклатура – принципы наименования бактерий. Наименования бактерий должны быть стабильными, научно обоснованными и целесообразными[6,7,13]. Различают неформальную (тривиальную, местную) и научную номенклатуру. Неформальная (местная) номенклатура применяется для обозначения изолятов и штаммов бактерий, полученных в лаборатории. Правила научной номенклатуры бактерий изложены в специальном руководстве “International Code for the Nomenclature of Bacteria”. В соответствии с ними вид бактерий обозначается двумя (бинарная номенклатура) латинскими именами – первое характеризует род (genus), а второе-вид (species). Название семейства всегда заканчивается на – aceae. Например, семейство энтеробактерий – Enterobacteriaceae, род-Escherichia, вид-Escherichia coli (E.coli), вариант (серовар) – О157:Н7, штамм-xyz. Подвид имеет тройное название (тринарен). Для его обозначения после видового названия добавляют третье слово-подвид (subspecies). Например, Klebsiella pneumoniae subsp rhinoscleromatis (палочка склеромы, где rhinoscleromatis – название подвида).
В данной статье номенклатура бактерий представлена в соответствии с руководством Д.Берджи по систематической бактериологии[7]. В иерархии клеточных форм жизни различают три домена (империи) – Bacteria (прокариоты, истинные бактерии или эубактерии), Archaea(архибактерии) и Eucaria(эукариоты-грибы, простейшие, животные, растения), имеющие ранг надцарств. В соответствии с ним среди бактерий выделяют следующие таксоносические категории (табл. 1):
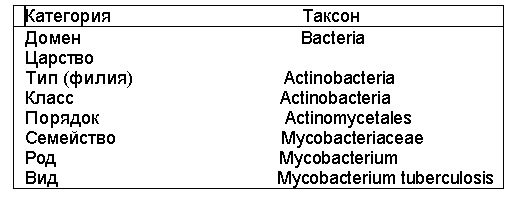
В последнем руководстве Берджи выделено 23 типа (филии) бактерий. В свою очередь в зависимости от строения клеточной стенки они подразделяются на 4 группы-Gracilicutes (бактерии с тонкой клеточной стенкой), Firmicutes (бактерии с толстой клеточной стенкой), Teniricutes (бактерии, лишенные клеточной стенки) и Mendosicutes (бактерии с неправильной клеточной стенкой – архибактерии). Патогенные для человека бактерии относятся к первым трем отделам. В свою очередь они разделены на секции (более 30) в состав которых входят значимые для медицины семейства, роды, виды и подвиды (табл. 2.).
КУЛЬТУРА МИКРООРГАНИЗМОВ, популяция клеток микроорганизмов (бактерии, дрожжи, актиномицеты, плесневые грибы), выращенная в жидкой или на плотной питат. средах. Различают чистую и смешанную К. м. Если на питат. среде вырастают микроорганизмы одного вида, то такая К. м. наз. чистой; при наличии роста микробов двух или большего числа видов — смешанной. Чистоту К. м. определяют путём микроскопии мазков, приготовленных из культур в жидкой и на плотной средах, учитывая при этом однотипность колоний на плотной среде, а также на основе изучения культуральных, биохимич. и антигенных свойств микроорганизмов.
Культура бактериальная — популяция жизнеспособных бактерий, выращенных на питат. среде. Чистая культура бактерий, выделенная из к.-л. источника в определённое время, наз. штаммом. Наиболее типичные штаммы, обладающие характерными физиол. и биол. свойствами, присущими данному виду бактерий, наз. эталонными и используются для сравнения с ними вновь выделяемых культур. Идентификация и дифференциация бактерий могут быть проведены лишь в том случае, когда имеется чистая культура. Поэтому при получении смешанной К. м. прибегают к различным методам очистки её от посторонних микробов. Эталонные штаммы применяют в произ-ве диагностич. и иммунных препаратов (для изготовления антигенов, получения сывороток, вакцин, антитоксинов). Для продолжительного хранения культуры бактерий чаще используют полужидкий (0,25—0,3%) МПА (к полученной культуре добавляют слой стерильного вазелинового масла), мясо-пептонный печёночный бульон с вазелиновым маслом и др. Наиболее надёжная сохранность культур достигается при их лиофиль-ном высушивании. Правила храпения культуры бактерий и порядок их отпуска в учреждения определены спец. инструкцией. На каждый штамм бактерий заполняется паспорт, в к-ром указывают время и источник выделения культуры, свойства и особенности штамма.
Оставшуюся часть колонии переносят в специальные пробирки со скошенным агаром (плотной питательной средой) для накопления чистой культуры с целью последующего полного изучения данной колонии. Все пробирки с агаром ставят на 18—24 ч в термостат. На 2-м этапе бактериологического исследования зачастую учитывают количество образовавшихся колоний микроорганизмов. Это имеет огромное значение при наличии у пациента заболеваний, вызываемых условно-патогенной микрофлорой.
Микробы, или микроорганизмы (бактерии, грибы, простейшие, вирусы), систематизиро¬ваны по их сходству, различиям и взаимо-отношениям между собой. Этим занимается специальная наука — систематика микроор¬ганизмов. Систематика включает три части: классификацию, таксономию и идентифика¬цию. В основу таксономии микроорганизмов поло¬жены их морфологические, физиологические, биохимические и молекулярно-биологические свойства. Различают следующие таксономи¬ческие категории: царство, подцарство, отдел, класс, порядок, семейство, род, вид, подвид и др. В рамках той или иной таксономичес¬кой категории выделяют таксоны — группы организмов, объединенные по определенным однородным свойствам.
Микроорганизмы представлены доклеточными формами (вирусы — царство Vira) и клеточными формами (бактерии, архебактерии, грибы и простейшие). Различают 3 доме¬на (или «империи»): «Bacteria», «Archaea» и «Eukarya»:
□ домен «Bacteria» — прокариоты, пред¬ставленные настоящими бактериями (эубактериями);
□ домен «Archaea» — прокариоты, пред¬ставленные архебактериями;
□ домен «Eukarya» — эукариоты, клетки которых имеют ядро с ядерной оболочкой и ядрышком, а цитоплазма состоит из высоко-организованных органелл — митохондрий, аппарата Гольджи и др. Домен «Eukarya» вклю¬чает: царство Fungi (грибы); царство животных Animalia (включает прстейшие – подцарство Protozoa); царство растений Plante. Домены включают царства, типы, классы, порядки, семейства, роды, виды.
