
Краткий_курс_лекций_Таганович_Кухта
.pdf
7.Синтез гемоглобина. Гемоглобин — сложный белок, состоящий из белка глобина
инебелковой части — гема. Глобин синтезируется как обычный белок, а синтез гема представляет собой сложный многостадийный процесс, поэтому мы выделим в нём только основные этапы. Все клетки, имеющие ядро, могут синтезировать гем, но в количественном плане наиболее интенсивно синтез гема протекает в печени и костном мозге.
Этапы синтеза гема:
1
I. Сукцинил ~ SКоА + глицин  δ-аминолевулиновая кислота (δ-АЛК) КоА — SН + СО2
δ-аминолевулиновая кислота (δ-АЛК) КоА — SН + СО2
1 = δ-аминолевулинатсинтаза (δ-АЛС)
2
II. 2 δ-АЛК  порфобилиноген ( ПБГ) 2Н2О
порфобилиноген ( ПБГ) 2Н2О
2 = δ-аминолевулинатдегидратаза (δ-АЛД)
III. 4 ПБГ  протопорфирин IX (ПП IX) через ряд промежуточных стадий.
протопорфирин IX (ПП IX) через ряд промежуточных стадий.
3
IV. ПП IX + Fe2 |
гем |
вит. В12; Cu2+
3 = гемсинтаза (феррохелатаза)
Регуляция синтеза гема. Фермент, лимитирующий скорость синтеза гема, — δ-АЛС. Она ингибируется гемом по принципу обратной связи, а активируется стероидными гормонами. Также ингибируется гемом δ-АЛД и гемсинтаза. Последняя к тому же очень чувствительна к свинцу, а δ-АЛД — вообще ко всем тяжёлым металлам.
Гем + белок → гемопротеины: гемоглобин, миглобин, цитохромы.
8. Экскреторная функция. Из печени различные вещества эндо- и экзогенного происхождения или поступают в желчные протоки и выводятся с желчью(более 40 соединений), или попадают в кровь, откуда выводятся почками.
БИОХИМИЯ МЫШЕЧНОЙ ТКАНИ
Мышцы составляют у взрослого человека 40 % от массы тела.
Функция мышц — напряжение и укорочение с последующим расслаблением. Значение мышц — обеспечение подвижности организма и сопротивление механиче-
ской силе, в том числе и статические нагрузки.
Механизм работы мышц — превращение химической энергии в механическую.
Кмышечной ткани относятся:
▪скелетная мускулатура;
▪сердечная мышца;
▪гладкая мускулатура.
Скелетная и сердечная мышцы под микроскопом имеют поперечно-полосатое строение, а гладкая — нет. Мышечные клетки состоят из миофибрилл, а функциональной единицей миофибрилл является саркомер.
114

При рассмотрении миофибриллы под электронным микроскопом видны темные и светлые полосы или диски (А и I диски). Центральная зона А диска (H зона) при этом кажется менее оптически плотной, чем остальная его часть. I участок (или I диск) как бы делится на две части очень плотной и узкой Z-линией. Также видны два типа вытянутых нитей. Один тип — это толстая нить, соответствующая А диску. Второй тип — тонкая нить, расположена в I диске и проходит в А диск, не достигая Н зоны.
Около 25 % массы мышц составляют белки. Белки мышц делят на 3 группы:
▪миофибриллярные (сократительные) белки;
▪белки саркоплазмы;
▪белки стромы.
МИОФИБРИЛЛЯРНЫЕ (СОКРАТИТЕЛЬНЫЕ) БЕЛКИ
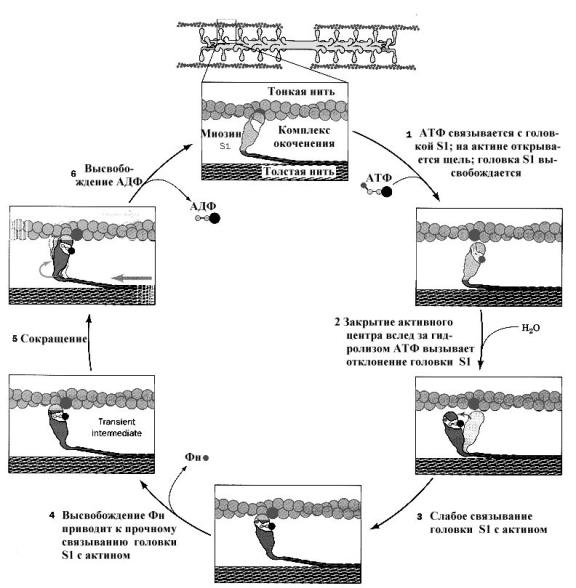
1. Миозин — основа толстых нитей. Молекулярная масса ≈ 500.000 Да. Молекула миозина имеет вытянутую часть, состоящую из двух спиралей, накрученных одна на другую. Каждая спираль имеет на одном конце глобулярную головку и называетсятяжёлой цепью. Возле головок спиралей располагается по 2 лёгких цепи.
При обработке ферментами молекула миозина распадается на2 больших фрагмента: тяжёлый меромиозин (обе головки и часть двойной спирали) и лёгкий меромиозин (остальная часть двойной спирали).
Функции миозина:
▪структурная — около 400 молекул миозина соединяются между собой«хвост» в «хвост» и образуют толстую нить;
▪каталитическая — головка миозина способна расщеплять АТФ;
▪контактная — соединяется с актином своими головками, которые в таком случае называются «поперечные мостики».
2. Актин — белок тонких нитей. Молекулярная масса — 42.000 Да. Форма молекул — шаровидная, поэтому он и называетсяG-актин (от англ. globular). Молекулы G-актина соединяются между собой и образуют F-актин (фибриллярный) в виде двойной спирали.
115
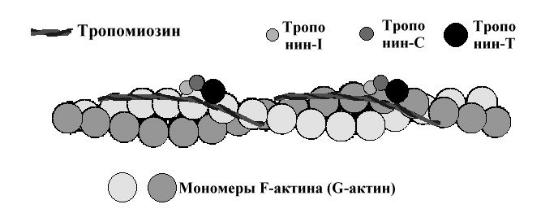
3.Тропомиозин — также белок тонких нитей. Молекулярная масса — 65.000 Да. Состоит из двух α-спиралей в форме палочки. Располагается в бороздках, идущих вдоль обеих сторон актина. Каждая его молекула лежит на 7 молекулах актина.
4.Тропонин — ещё один белок тонких нитей. Молекулярная масса — 80.000 Да. Состоит из 3 субъединиц: С — для связывания с ионами кальция; I — ингибиторная, которая блокирует преждевременное соединение головок миозина с актином; Т — для связывания с тропомиозином.
5.α-актинин. Входит в Z-линию и фиксирует там тонкие нити.
6.β-актинин. Регулирует длину тонких нитей.
7.М-белок. Входит в М-линию и фиксирует там толстые нити.
8.С-белок. Регулирует длину толстых нитей.
9.Десмин. Содержится между Z-линиями соседних миофибрилл, обеспечивая совпадение границ всех их саркомеров.
Белки саркоплазмы. К ним относятся миоглобин, ферменты гликолиза, тканевого дыхания, кальмодулин и кальсеквестрин, способные обратимо связываться с ионами кальция.
Белки стромы. Это коллаген и эластин.
Мышцы, помимо белков, содержат небелковые азотистые соединения — АТФ, КФ
(креатинфосфат), фосфолипиды, глутамат, глутамин, карнозин и анзерин (два последних способны увеличивать амплитуду мышечного сокращения); безазотистые соединения —
гликоген, лактат, пируват, нейтральные жиры, холестерол. Остальная масса — Н2О.
Молекулярный механизм мышечного сокращения
В ответ на нервный импульс происходит выброс ионов кальция из саркоплазматического ретикулума (СПР). Эти ионы связываются с лёгкими цепями миозина, при этом в головке расщепляется АТФ и головка готова присоединиться к актину. Ионы кальция затем связываются с тропонином С и меняют его конформацию. Эти изменения в силу эффекта кооперации передаются на субъединицу I и блокируют её. Далее изменения достигают субъединицы Т, которая и сдвигает в сторону молекулу тропомиозина, освобождая сразу 7 молекул актина. Головка миозина соединяется с актином, и образуется «поперечный мостик». Как только это произошло, АДФ и Фн уходят, головка наклоняется в сторону М-линии и тянет за собой тонкую нить. Затем к головке миозина присоединяется новая молекула АТФ, головка отделяется от нити актина, а гидролиз АТФ возвращает головку в вертикальное положение. Далее всё повторяется. Информацией о конце сокращения служит снижение концентрации ионов кальция в СПР. Тогда кальциевый насос и белок кальсеквестрин убирают избыток ионов кальция из цитоплазмы в СПР. Мышца переходит в состояние покоя.
116
Особенности гладких мышц:
▪их сократительный аппарат не содержит тропониновой системы, а содержит специальный белок кальдесмон, который выполняет функцию тропонина;
▪их миозиновая АТФазная активность в 10 раз ниже;
▪их миозин может соединяться с актином только при условии фосфорилирования лёгких цепей;
▪богаты белками стромы, но бедны фосфолипидами и макроэргами.
Гладкие мышцы — медленные, но способны длительно поддерживать напряжение. Кроме того, они похожи на сердечную мышцу тем, что сокращаются непроизвольно.
Источники энергии мышечного сокращения
В состоянии покоя. Свободные жирные кислоты (СЖК) и кетоновые тела (КТ).
При умеренной нагрузке. СЖК + КТ + глюкоза крови.
При максимальной нагрузке. СЖК + КТ + глюкоза крови + гликоген мышц.
Механизмы энергообеспечения мышечного сокращения
1. Основной регулятор энергетики мышечной клетки— это отношение
[АТФ]/[АДФ]·[Фн]. В покое концентрация АТФ высокая, а АДФ — низкая, в результате чего тормозится активность ключевых ферментов гликолиза, цикла Кребса и работа дыхатель-
117
ной цепи. С началом работы мышц концентрация АТФ падает, а АДФ возрастает, что приводит к активации вышеназванных процессов.
2.Накапливающийся при работе мышц лактат поступает из крови в печень, где пу-
тём глюконеогенеза превращается в глюкозу, которая поступает сначала в кровь, а затем в мышцы, где восстанавливает запас гликогена.
3.Аденилаткиназная (миокиназная) реакция:
2 АДФ ↔ АТФ + АМФ.
АТФ используется для мышечного сокращения, а АМФ стимулирует гликолиз. 4. Креатинкиназная реакция:
Креатин + АТФ↔КФ + АДФ.
Покоящиеся мышцы содержат в 10–20 раз больше КФ, чем АТФ, но КФ, в отличие от АТФ, не может использоваться мышцами для сокращения. Роль КФ заключается в том, что он является не только транспортной формой энергии в мышцах, но и отдаёт свою богатую энергией связь АДФ для образования АТФ, который и расходуется при сокращении. Это система быстрого реагирования: она включается первой при нехватке АТФ в мышцах. Запаса КФ хватает только на 10 с, но за это время запускаются 1–3-й механизмы. Особенно эта система важна для миокарда, так как он очень чувствителен к недостатку кислорода и имеет исключительно аэробный характер обмена в отличие от скелетной мускулатуры.
118
