
Краткий_курс_лекций_Таганович_Кухта
.pdf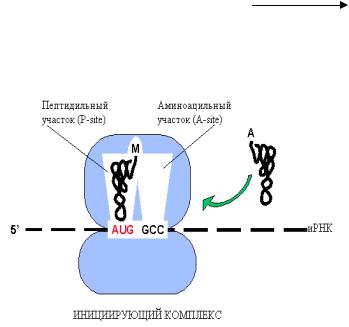
сплайсинге участвует малая ядерная РНК, которая содержит последовательности, комплементарные интронам.
Созревание тРНК. От предшественника тРНК отщепляются дополнительные олигонуклеотиды на 3’- и 5’- концах, вырезаются интроны, достраивается акцепторный участок (ЦЦА), формируется петля антикодона, проводится модификация нуклеотидов (образуются псевдоуридин, дигидроуридин и т. п.).
Созревание рРНК. рРНК синтезируется в виде крупных предшественников, из которых затем удаляются интроны, молекулы разрезаются на фрагменты разного размера, метилируются, объединяются с белками (образуются малая и большая субъединицы рибосом).
Ингибиторы транскрипции:
▪актиномицинД — препятствует раскручиванию ДНК и продвижению РНК-поли-
меразы;
▪рифампицин — ингибирует РНК-полимеразу прокариот на этапе инициации;
▪α-аманитин (токсин бледной поганки) — ингибирует РНК полимеразу II эукариот.
БИОСИНТЕЗ БЕЛКА
Трансляция — биосинтез белка на матрице иРНК. Участники трансляции: иРНК, рибосомы, белковые факторы инициации, элонгации и терминации, ГТФ, аминоацил-тРНК.
Последовательность нуклеотидов иРНК определяет последовательность включения аминокислот в синтезируемый белок. При этом одну аминокислоту кодирует последовательность из трех нуклеотидов (триплет, кодон). Существует 43 = 64 кодона (3 из них не кодируют аминокислоты — бессмысленные или нонсенс-кодоны). Общий набор кодонов составляет генетический код. Свойства генетического кода: триплетность; специфичность (1 кодон — 1 аминокислота); вырожденность (или избыточность, 61 кодон для 20 аминокислот); однонаправленность; неперекрываемость; отсутствие знаков препинания; универсальность.
Роль тРНК в биосинтезе белка: 1) транспорт аминокислот на рибосомы; 2) адапторная функция, т. е. тРНК является посредником при переводе с языка нуклеиновых кислот(последовательность нуклеотидов) на язык белков (последовательность аминокислот). Адапторная функция осуществляется благодаря наличию в структуре тРНК акцепторного участка для аминокислоты и антикодона для связи с иРНК.
Рекогниция — процесс узнавания аминокислотой своей тРНК. Специфичность связывания обеспечивает фермент АРСаза(аминоацил-тРНК-синтетаза), который катализирует 2 реакции:
NH2 – CH – COOH + АТФ |
NH2 – CH – CO ~ АМФ + ФФн |
|
|
||||
│ |
1 |
│ |
|
|
|
|
|
R Аминокислота |
2 |
R Аминоацил-аденилат |
|
|
|||
|
¯ + тРНК |
|
|
|
|
||
|
NH2–CH – CO ~ тРНК + АМФ |
|
|||||
|
│ |
|
|
|
|
|
|
|
R Аминоацил-тРНК |
|
|
|
|||
|
|
Собственно |
трансляция проходит |
в |
|||
|
три |
этапа: |
инициация, |
элонгация |
и |
||
|
терминация. |
|
|
|
|
|
|
|
|
Инициация: иРНК поступает на ма- |
|||||
|
лую субъединицу рибосомы 5/-концом, к |
||||||
|
инициирующему кодону (АУГ) |
присоеди- |
|||||
|
няется первая аминоацил-тРНК (мет-тРНК), |
||||||
|
и |
комплекс «закрывается» |
большой |
||||
|
субъединицей |
рибосомы. |
В образовании |
||||
|
инициирующего |
комплекса |
участвуют |
||||
84
белковые факторы инициации (IF-1, 2, 3) и используется энергия ГТФ.
Элонгация: в аминоацильный участок поступает следующая аминоацил-тРНК. Фер-
мент пептидилтрансфераза образует пептидную связь между активированной- |
карбо |
ксильной группой первой аминокислоты и аминогруппой второй аминокислоты. Образован- |
|
ный при этом дипептид «зависает» в аминоацильном центре. Затем с помощью транслоказы и энергии ГТФ рибосома перемещается по иРНК на один кодон, аминоацильный участок ос-
вобождается, туда поступает новая аминокислота. |
Образование пептидной связи |
Терминация наступает тогда, когда в аминоа- |
|
цильном участке оказывается один из терминирую- |
|
щих (нонсенс) кодонов. К таким кодонам присоеди- |
|
няются специальные белки(рилизинг-факторы), ко- |
|
торые высвобождают синтезированный пептид и вы- |
|
зывают диссоциацию субъединиц рибосомы. |
|
Многие белки синтезируются в неактивном |
|
виде (в виде предшественников) и после схождения с |
|
рибосом подвергаются постсинтетической модифика- |
|
ции. Виды модификации белков: |
|
1)частичный протеолиз (удаление N-конце- вого мет и сигнального пептида, образование активных форм ферментов и гормонов);
2)объединение протомеров и формирование четвертичной структуры белков;
3)образование внутри- и межцепочечных S–S
связей;
4)ковалентное присоединение кофакторов к ферментам (пиридоксальфосфат, биотин);
5)гликозилирование (гормоны, рецепторы);
6)модификация остатков аминокислот:
-гидроксилирование про и лиз (коллаген);
-йодирование тир (тиреоидные гормоны);
-карбоксилирование глу (факторы свертывания крови);
7)фосфорилирование (казеин молока, регуляция активности ферментов);
8)ацетилирование (гистоны);
9)пренилирование (G-белки).
Регуляция биосинтеза белка в клетке
Синтез белка в клетке можно регулировать на этапе транскрипции, созревания иРНК, транспорта ее из ядра в цитоплазму, изменяя стабильность иРНК, в процессе трансляции и посттрансляционной модификации. Регуляция на самых ранних этапах(на уровне экспрессии генов) является наиболее выгодной и потому широко используется.
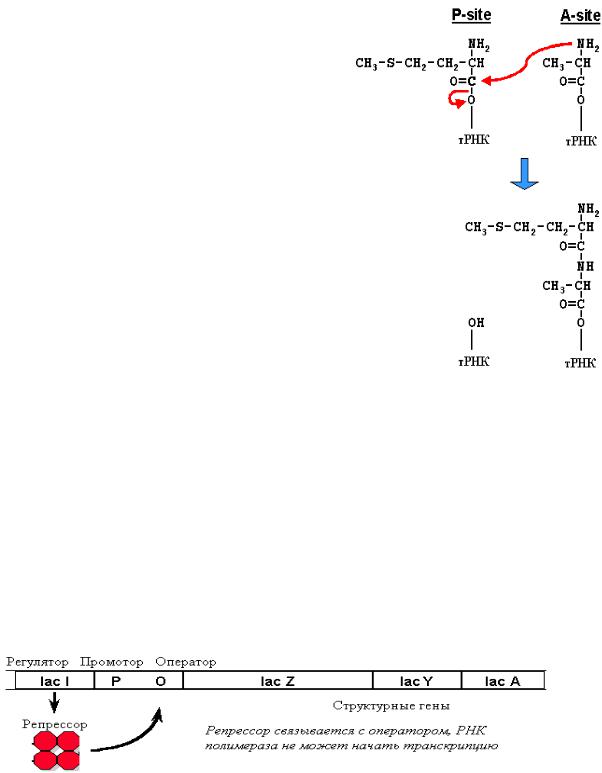
Примером регуляции экспрессии генов является работа lac-оперона у E. coli. Lac-опе- рон содержит 3 структурных гена ферментов, участвующих в метаболизме лактозы. В отсутствие лактозы оперон заблокирован белком репрессором.
В присутствии индуктора (лактозы) репрессор меняет свою конформацию и отсоединяется от ДНК. Однако если в этот момент в среде имеется глюкоза (более доступный источ-
85

ник энергии), транскрипция не идет. В том случае, если глюкоза отсутствует, в клетке увеличивается уровень цАМФ(сигнал «голода») и цАМФ в комплексе со специальным белком (catabolite activator protein) связывается с промотором. Только в присутствии этого белка РНК-полимераза может образовать прочную связь с промотором и начать транскрипцию.
Белковые факторы, которые способствуют связыванию РНК-полимеразы с промотором, называются факторами транскрипции.
Регуляторная часть генов эукариот устроена более сложно. Имеются энхансеры (элементы, усиливающие транскрипцию), сайленсеры (ослабляющие), адапторные элементы. Факторы транскрипции могут связываться с любым из этих элементов, тем самым регулировать функции генов. В качестве индукторов биосинтеза белка на генетическом уровне могут выступать не только субстраты (лактоза для лактазы), но и стероидные гормоны, витамин Д, тиреоидные гормоны, ионы металлов и др.
СОВРЕМЕННЫЕ МЕТОДЫ МОЛЕКУЛЯРНОЙ БИОЛОГИИ
Основными инструментами в работе молекулярного биолога с нуклеиновыми кислотами являются ферменты. Используют рестриктазы (эндонуклеазы, которые узнают специфические последовательности в ДНК и разрезают молекулу ДНК в этом ), местеДНК-
полимеразы, ДНК-лигазы, экзонуклеазы и др.
В настоящее время в основе большинства методов ДНК-диагностики лежитполиме-
разная цепная реакция(ПЦР). Она позволяет быстро получить большое количество копий молекул ДНК(или их фрагментов), достаточное для их дальнейшего анализа.
Этапы проведения:
▪нагревание до 90°С (денатура-
ция ДНК);
▪добавление праймера и охлаждение до 55°С (присоединение или «отжиг» праймера);
▪добавление нуклеотидов (субстратов для синтеза) и ДНК-полимеразы, которая проводит удвоение ДНК; затем цикл повторяется.
86
Метод широко используется для диагностики инфекционных заболеваний(туберкулез, хламидиоз, цитомегаловирусная инфекция, СПИД и др.). ПЦР позволяет обнаружить возбудителя в биологическом материале даже тогда, когда другие методы оказываются неэффективны. Второе направление использования метода ПЦР— генетическое тестирование (обнаружение мутаций в генах и диагностика наследственной патологии).
Клонирование — способ получения большой популяции идентичных молекул, клеток, организмов — потомков одного предка.
Проводятся эксперименты по клонированию стволовых клеток человека и их использованию в стоматологической практике (заместительная клеточная терапия).
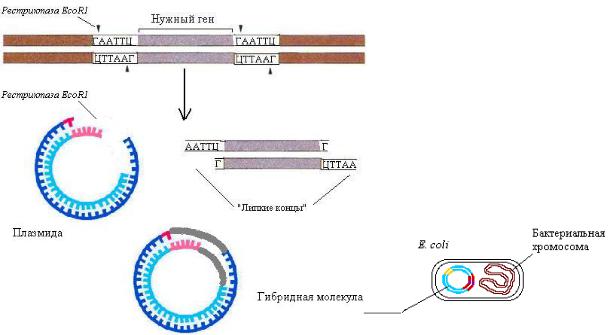
Для клонирования отдельных генов используются технологии рекомбинантных ДНК: нужный ген на специальном носителе вводят в бактериальную клетку. В процессе размножения бактерий получают огромное число копий гена.
Вектор — носитель (плазмида или бактериофаг), в который может быть введена чужеродная ДНК с целью клонирования.
Плазмида — небольшая кольцевидная двухцепочечная ДНК, которая реплицируется независимо от ДНК хозяина.
Принципиальный подход к клонированию генов: в плазмиде создают дефект (брешь) с помощью рестриктазы. С помощью этой же рестриктазы вырезают участок ДНК с нужным геном. Благодаря «липким концам» происходит включение чужеродной ДНК в вектор, ДНКлигаза восстанавливает целостность плазмиды и образованная гибридная молекула помещается в бактериальную клетку.
Экспрессия гена, закодированного в чужеродной ДНК, приводит к образованию бактериями нужного белка, его можно выделить и использовать. Технологии рекомбинантных ДНК позволяют получать для медицинской практики вакцины, инсулин, соматотропный гормон, интерфероны, эритропоэтин, белки эмали и др.
ГОРМОНЫ. ОБЩИЙ МЕХАНИЗМ ДЕЙСТВИЯ ГОРМОНОВ
Гормоны — это класс регуляторных молекул, синтезируемых специальными клетками.
Особенности биологического действия: 1) низкая концентрация в крови(10–6–10–12 М); 2) обязательная связь с рецептором– (R), включающим каскадный механизм усиления гормонального сигнала; 3) изменение скорости синтеза ферментов или их активности; 4) регуляция секреции по принципу прямой и (или) обратной связи.
Взаимодействие гормона и (R) характеризуется высокой специфичностью, которая обеспечивается комплементарностью между структурой гормона и активного центра (R). В результате эффекта кооперативности, возникающего при взаимодействии гормона и(R), существенно изменяется активность (R) — это есть феномен амплификации (усиления) гормонального сигнала. Механизм амплификации включает участие специальных ферментов и
87
молекул — вторичных посредников. Гормональный сигнал способен«выключаться» в результате инактивирования (R) путём его фосфорилирования, либо удаления (R) с поверхности клетки (эндоцитоз) и т. д. Множество разных сигналов, воспринимаемых клеткой, суммируется в один определённый ответ.
Клеточные (R) в зависимости от их локализации делятся на 2 большие группы: 1) (R)
плазматической мембраны; и 2) внутриклеточные (R).
(R) плазматической мембраны клеток обеспечивают узнавание, связывание и передачу регуляторного сигнала внутрь клетки. Среди них различают:
1. 7-ТМС-(R) — это интегральные мембранные белки с семью трансмембранными спиральными сегментами, соединенными гидрофильными внеклеточными и внутриклеточными петлями. Внутриклеточные петли этих (R) содержат центры связывания G-белка.
2.1-TMС-(R) — это интегральные мембранные белки с одним трансмембранным сегментом и глобулярными доменами на вне- и внутриклеточной поверхностях мембраны. Внеклеточный домен содержит участок узнавания и связывания гормона, внутриклеточный обладает каталитической активностью. Когда (R) активируется гормоном, его внутриклеточный домен катализирует образование внутриклеточных вторичных посредников.
3.Каналообразующие (R) — состоят из белковых субъединиц, каждая из которых содержит несколько трансмембранных сегментов.
Внутриклеточные (R) расположены в цитозоле или ядре клетки. После связывания с гормоном они изменяют скорость транскрипции и трансляции определённых генов.
По химической природе гормоны делят на:
1)пептиды (глюкагон, котрикотропин) и белки (сложные белки — тиреотропин, гонадотропины; простые белки — соматотропин, инсулин);
2)производные аминокислот (адреналин, серотонин, тироксин);
3)стероиды (альдостерон, кортизол, половые гормоны, витамин Д и ретиноевая ки-
слота);
4)производные липидов (эйкозаноиды).
МЕХАНИЗМ ДЕЙСТВИЯ ГОРМОНОВ, ВЗАИМОДЕЙСТВУЮЩИХ С 7-ТМС-РЕЦЕПТОРАМИ
Первый этап действия гормона заключается во взаимодействии гормона с7-ТМС-(R) (к ним относятся α- и β-адренергические (R), (R) гистамина, серотонина, соматостатина, гликопротеиновых гормонов, глюкагона, паратирина, кальцитонина, гормонов гипоталамуса).
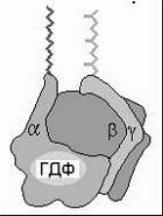
Второй участник передачи гормонального сигнала— G-белки. Обнаружены: 1) большие, состоящие из нескольких субъединиц G-белки (связаны с мембранами); 2) низкомолекулярные, состоящие из одной полипептидной цепи(цитозольные). Все G-белки обладают ГТФ-азной активностью, и их конформация зависит от того, связаны ли они в данный момент с ГДФ или ГТФ. Мембранный G-белок состоит из 3 субъединиц: α, β и γ.
В неактивном состоянии три субъединицы соединены вместе, и α -субъединица связана с ГДФ. После присоединения гормона к 7-ТМС-(R) и взаимодействия гормон-рецепторного комплекса с G-белком в последнем происходит замена ГДФ на ГТФ, вследствие чего G-белок диссоциирует с образованием свободной α-субъединицы и димера субъединиц β, γ. Затем
α- субъединица перемещается по мембране и взаимодействует с мембраносвязанными ферментами (аденилатциклазой или фосфолипазой С), катализирующими образование низкомолекулярных вторичных посредников. Продолжительность эффекта G-белка определяется ГТФ-азной активностью его α-субъединицы: после гидролиза ГТФ до ГДФ действие субъединицы прекращается и G-белок возвращается в исходное тримерное состояние
88
Аденилатциклаза. Различные типы аденилатциклаз реагируют с α-субъединицами, выполняющими разные функции: если связывание осуществляется с αs-субъединицей G-белка, то фермент активируется, если с αI-cубъединицей, то ингибируется. Аденилатциклаза катализирует образование цАМФ из АТФ. Уровень цАМФ в клетках очень низок, но при активировании аденилатциклазы он может быстро и значительно увеличиваться. Однако это повышение кратковременно. Распад цАМФ катализируется цАМФ-фосфодиэстеразами (ФДЭ), гидролизующими фосфодиэфирную связь в молекуле цАМФ. ФДЭ — регулируемый фермент (его ингибирует кофеин, что приводит к повышению уровня цАМФ).
цАМФ является аллостерическим регуляторомпротеинкиназы А (существуют разные типы этих ферментов). Протеинкиназы — это гетеромеры, состоящие из двухкаталитических и одной регуляторной субъединиц. Присоединение цАМФ к регуляторной субъединице высвобождает каталитические субъединиц. Последние переносят фосфорный остаток с АТФ на серин или треонин некоторых ферментов, которые при этом переходят в активное или неактивное состояние (это зависит от свойств данного фермента: так, фосфорилирование гликогенфосфорилазы активирует ее, а фосфорилирование гликогенсинтазы её угнетает). цАМФ регулирует также открытие цАМФ-зависимых ионных каналов. Повышение уровня цАМФ может приводить к транскрипции определенных генов.
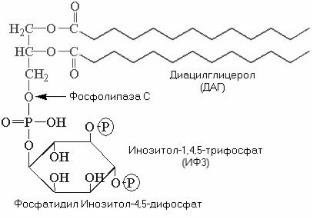
Фосфолипаза С. Субстратом этого фермента является фосфатидилинозитол-4,5- дифосфат. Фосфолипаза С катализирует образование двух мощных посредников: диацилглицерола (ДАГ) и инозитол-1,4,5-трифосфата (ИТФ).
ИТФ связывается с(R) кальцисом, что приводит к открытию лиганд-зависимых кальциевых каналов кальцисом. В результате в цитозоле резко увеличивается концентра-
ция |
2+Са. |
Высвободившийся |
2+Са |
захватывается |
специальными кальций-связывающими белками, например, калмодулином. |
||
Когда |
уровень |
2+ |
повышается, кальций-калмодулиновый комплекс |
внутриклеточного Са |
|||
присоединяется к различным белкам-мишеням, что сопровождается изменением их активности. Кальмодулин-зависимые протеинкиназы регулируют активность многих ферментов. Они также способны проникать в ядро клетки, где фосфорилируют белки, ответственные за активацию транскрипции.
Таким образом, ИТФ повышает концентрацию Са2+ в цитозоле. ДАГ остается в плазматической мембране и либо гидролизуется с образованием арахидоновой кислоты(необходимой для синтеза простагландинов), либо активирует протеинкиназу С. При низком внутриклеточном уровне Са2+ и отсутствии ДАГ протеинкиназа С находится в цитоплазме в неактивном состоянии. При связывании ДАГ конформация протеинкиназы С изменяется, уве-
2+
личивается её сродство к Са и она начинает активировать разнообразные белки-мишени (так, С-киназа фосфорилирует и тем самым активируетNa+/H+ обменный насос плазматической мембраны, контролирующий внутриклеточный рН). Активная С-киназа способна усиливать транскрипцию генов.
МЕХАНИЗМ ДЕЙСТВИЯ ГОРМОНОВ, ВЗАИМОДЕЙСТВУЮЩИХ
С1-ТМС-РЕЦЕПТОРАМИ
К1-TMС-(R) относятся гуанилатциклазы, катализирующие образование цГМФ из ГТФ. Первый тип гуанилатциклаз, локализующийся в плазматической мембране, активируется внеклеточными лигандами(предсердным натрийуретическим фактором); второй —
89
۟
цитозольный фермент, активируемый оксидом азота (NO◌). Оксид азота вызывает расслабление гладкой мускулатуры сосудов, в том числе коронарных.
Гормон, присоединившись к 1-TMС-(R), его активирует. Этот гормон-рецепторный комплекс проявляет гуанилатциклазную активность, катализируя образование цГМФ из ГТФ. цГМФ (вторичный посредник) активирует протеинкиназу С, которая начинает фосфорилировать остатки Сер и Тре в белках-мишенях, что приводит эти белки в функционально активное состояние. цГМФ является также активатором фосфодиэстераз, катализирующих распад цАМФ (т. е. цГМФ и цАМФ – антагонисты). Конечный эффект цГМФ проявляется в изменении транспорта ионов и воды в почках и кишечнике; в сердечной мышце цГМФ способствует мышечному расслаблению; в палочках и колбочках сетчатки глаза цГМФ стимулирует открытие ионных каналов.
Самой распространённой группой 1-TMС-(R) являются рецепторные тирозинкиназы. В их структуре имеется 4 домена: внеклеточный (связывает гормон), трансмембранный, внутриклеточный с тирозинкиназной активностью, внутриклеточный регуляторный. Важнейшей тирозинкиназой является(R) инсулина. Присоединение инсулина вызывает аутофосфорилирование киназного домена (R). При этом ускоряется фосфорилирование остатков тирозина в особом белке — IRS-1 (инсулин-рецепторный субстрат). Активный IRS-1 включает целый каскад реакций, усиливающих гормональный сигнал. Это протеинкиназные реакции с участием, в первую очередь, МАП-киназ (митоген-активируемые протеинкиназы). МАП-киназы изменяют активность многих ферментов путём их фосфорилирования.
В передаче сигнала с участием1-TMС-(R) |
есть свои выключатели. Это Ras-белки, |
|||||
относящиеся |
к семейству |
мономерных |
|
|
|
|
ГТФ-аз. Ras-белки могут быть актив- |
|
Неактивная форма |
|
|||
ными, если к ним присоединяется ГТФ, |
Фн |
|
|
|||
и становиться неактивными при замене |
|
Ras |
ГТФ |
|||
ГТФ на ГДФ. |
Однако Ras-белки ката- |
|
||||
|
|
|||||
|
ГДФ |
|
||||
лизируют гидролиз ГТФ очень медлен- |
БАГ |
|
||||
но. Существует специальный белок, ус- |
|
Sos |
||||
коряющий |
гидролиз ГТФ, — |
БАГ |
|
|
|
|
(белок, активирующий ГТФ-азу). Дру- |
|
|
ГДФ |
|||
гой специальный белок— SOS-белок |
|
Ras |
|
|||
(фактор, высвобождающий |
гуанило- |
|
|
|||
|
|
|
||||
вые нуклеотиды) — препятствует этому |
|
ГТФ |
|
|||
гидролизу, заменяя ГДФ на ГТФ, |
по- |
|
Активная форма |
|
||
этому он оказывает активирующий эф- |
|
|
||||
фект на Ras-белок.
МЕХАНИЗМ ДЕЙСТВИЯ ГОРМОНОВ, ВЗАИМОДЕЙСТВУЮЩИХ С ВНУТРИКЛЕТОЧНЫМИ (R)
Витамин Д, ретиноевая кислота, стероидные и тиреоидные гормоны взаимодействуют |
|
|||||
непосредственно с внутриклеточными (R), поскольку они, будучи гидрофобными, свободно |
|
|||||
диффундируют |
через |
плазматическую |
мембрану. Эти |
рецепторы |
делятся : |
на |
1) (R) стероидных гормонов(минералокортикоидов, андрогенов, прогестерона); 2) (R) ти- |
|
|||||
реоидных гормонов (в том числе витамина Д и ретиноевой кислоты). |
|
|
||||
(R) стероидных гормонов находятся в цитозоле. Они образуют комплексы с белками |
|
|||||
теплового шока hsp (heat shock proteins), которые присоединяются к (R) таким образом, что |
|
|||||
закрывают его ДНК-связывающий домен. Кода гормон взаимодействует с(R), то белок- |
|
|||||
ингибитор hsp |
отделяется от (R), в результате чего (R) активируется. Активированный гор- |
|
||||
мон-рецепторный комплекс перемещается в ядро, где он взаимодействует со строго опреде-
ленными гормон-узнающими элементами ДНК (hormone response element).
90
(R) тиреоидных гормонов находятся в ядре в связанном с хроматином состоянии(за исключением рецепторов эстрогенов, которые в ядре образуют комплексы hsp)с . После взаимодействия с гормоном изменяется конформация (R), что повышает его сродство к ДНК, т. е. (R) может связываться со специфическими генами в ядре, регулируя их экспрессию.
ГОРМОНЫ — ПРОИЗВОДНЫЕ БЕЛКОВ, ПЕПТИДОВ И АМИНОКИСЛОТ
ГОРМОНЫ ГИПОТАЛАМУСА
Нейроны гипоталамуса синтезируют гормоны и секретируют их в капиллярную сеть, доставляющую гормоны к клеткам гипофиза. Эти гормоны являются пептидами. Они делятся на: 1) гормоны, усиливающие (высвобождающие, либерины) секрецию и выделение соответствующих тропных гормонов передней доли гипофиза, и 2) угнетающие (ингибирующие, статины) эти процессы.
Гормоны |
Эффект |
|
|
Кортиколиберин |
Стимулирует образование кортикотропина и липотропина |
|
|
Гонадолиберин |
Стимулирует образование лютропина и фоллитропина |
|
|
Пролактолиберин |
Способствует выделению пролактина |
|
|
Пролактостатин |
Ингибирует выделение пролактина |
|
|
Соматолиберин |
Стимулирует секрецию гормона роста |
|
|
Соматостатин |
Ингибирует секрецию гормона роста и тиреотропина |
|
|
Тиролиберин |
Стимулирует секрецию тиреотропина и пролактина |
|
|
Меланолиберин |
Стимулирует секрецию меланоцит-стимулирующего гормона |
|
|
Меланостатин |
Ингибирует секрецию меланоцит-стимулирующего гормона |
|
|
Либерины действуют на клетки гипофиза, мембраны которых имеют 7-ТМС-(R). После связывания 7-ТМС-(R) с гормоном активируется аденилатциклазный каскад передачи сигнала в клетку. Таким образом, либерины стимулируют синтез и высвобождение тропных гормонов гипофиза посредством цАМФ (может включаться также ИТФ-механизм).
ГОРМОНЫ АДЕНОГИПОФИЗА
Это гормоны белково-пептидной природы.
Гормоны |
Эффект |
СТГ (соматотропин, |
Стимулирует рост организма, синтез белка в клетках, образование глюкозы и |
гормон роста) |
распад липидов |
Пролактин |
Регулирует лактацию у млекопитающих, инстинкт выхаживания потомства, диф- |
|
ференцировку различных тканей |
ТТГ (тиреотропин) |
Регулирует биосинтез и секрецию гормонов щитовидной железы |
Кортикотропин |
Регулирует секрецию гормонов коры надпочечников |
|
|
ФСГ (фоллитропин) и |
ЛГ регулирует синтез женских и мужских половых гормонов, стимулирует рост |
ЛГ (лютеинизирующий |
и созревание фолликулов, овуляцию, образование и функционирование желтого |
гормон) |
тела в яичниках |
|
ФСГ оказывает сенсибилизирующее действие на фолликулы и клетки Лейдига к |
|
действию ЛГ, стимулирует сперматогенез |
|
|
Гормон роста (СТГ). Многие эффекты СТГ опосредуются соматомединами— тканевыми факторами, секретируемыми под влиянием гормона роста. Соматомедины-факторы сульфатирования усиливают использование сульфата и синтез коллагена хрящевой тканью;
91
соматомедины-факторы роста (особенно схожие по строению с инсулин-рецепторными субстратами IRS-1 и IRS-2) активируют рост клеток и тканей.
Связываясь с IRS, гормон роста оказывает разнообразное влияние на метаболизм. Основное действие СТГ — обеспечить рост и развитие организма. Под влиянием гормона усиливается синтез белков и нуклеиновых кислот в костях, хрящах, мышцах, печени и других внутренних органах; ускоряется транспорт аминокислот внутрь клеток. Одновременно тормозится катаболизм белков, что проявляется снижением уровня остаточного азота и мочевины в крови, положительным азотистым балансом.
СТГ стимулирует липолиз. Образующаяся при этом энергия используется на процессы анаболизма. СТГ участвует в регуляции уровня глюкозы в крови— это «контринсулярный» гормон (он снижает использование глюкозы жировыми и мышечными клетками и активирует глюконеогенез в печени). Секреция СТГ увеличивается при преимущественно белковом питании и голодании, физических упражнениях, стрессе, сразу же после засыпания.
Избыточная секреция СТГ у детей и подростков приводит к развитиюгигантизма (рост костей пропорционален). У взрослых избыток СТГ проявляется акромегалией (диспропорциональным ростом костей скелета, мягких тканей, внутренних органов).
Тиреотропин — основной регулятор функции щитовидной железы. Синтезируется базофильными клетками передней доли гипофиза.
Гонадотропины, как и тиреотропин, являются гликогликопротеинами. К гонадотропинам относятся фолликулостимулирующий гормон (ФСГ, фоллитропин), лютеинизирую-
щий гормоном (ЛГ, лютропин), а также хорионический гонадотропин. Мембраны гонадо-
трофов содержат 7-ТМС-(R), взаимодействующие с гонадолиберином гипоталамуса. Последний стимулирует высвобождение гонадотропинов гипофиза.
Гонадотропины у мужчин и женщин выполняют разные функции. ФСГ у женщин обеспечивает созревание фолликулов яичников, которые начинают активно синтезировать эстрадиол. Повышение секреции эстрадиола оказывает тормозящее действие на образование и секрецию ФСГ передней долей гипофиза (механизм обратной связи). После овуляции разрушенный фолликул развивается в желтое тело, продолжительность функции которого зависит от стимулирующего эффекта ЛГ. Падение уровня ЛГ приводит к снижению стероидогенеза, что становится причиной наступления менструации. В семенниках ФСГ и ЛГ активируют сперматогенез и увеличивают образование тестостерона.
АКТГ (кортикотропин) — это пептид (39 аминокислот). АКТГ регулирует стероидогенез и поддерживает оптимальную массу надпочечников. (R) кортикотропина относятся к 7-ТМС-(R), включающим механизм синтеза цАМФ. цАМФ, активируя протеинкиназу А, влияет на ключевую реакцию синтеза стероидных гормонов из холестерола. Влияние на поддержание массы надпочечников также опосредуется 7-ТМС-рецеторным действием АКТГ, что в итоге приводит к активации протеинкиназ. Протеинкиназы участвуют в биосинтезе нуклеиновых кислот и активируют стероидогенез.
АКТГ усиливает липолиз, стимулирует поглощение аминокислот и глюкозы мышечной тканью, вызывает гипогликемию вследствие ускорения высвобождения инсулина из поджелудочной железы. АКТГ усиливает пигментацию кожи, поэтому при заболеваниях, сопровождающихся высоким содержанием АКТГ в плазме(болезнь Аддисона), наблюдается избыточная пигментация.
Секреция АКТГ изменяется в течение суток и регулируется по принципу обратной связи. Она усиливается при действии стрессовых факторов.
Меланоцит-стимулирующие гормоны синтезируются клетками промежуточной доли гипофиза млекопитающих. У человека эта доля редуцирована, но единичные клетки, характерные для средней доли, локализуются в дистальной части гипофиза.
Липотропины. На С-конце молекулы β- липотропина расположены пептидные фрагменты, обладающие особой биологической активностью. Это — эндогенные опиоиды
92
(экефалины и эндорфины). Они обладают обезболивающим действием, спазмолитической активностью, участвуют в половом поведении, питании, обучении, памяти.
ГОРМОНЫ ЗАДНЕЙ ДОЛИ ГИПОФИЗА
Окситоцин и вазопрессин принято считать гормонами задней доли гипофиза, хотя они образуются и секретируются нейронами гипоталамуса. Эти нанопептиды схожи по строению. Свое название вазопрессин получил из-за способности повышать артериальное давление, а название «окситоцин» связано со способностью гормона ускорять роды.
Вазопрессин, помимо сосудосуживающего действия, обеспечивает сохранение воды в организме, стимулируя её реабсорбцию в почечных канальцах. Регулятором секреции гормона является изменение осмотического давления и объёма циркулирующей крови.
Окситоцин усиливает сокращение мышц матки во время родов, стимулирует лактацию, регулирует поведенческую активность, связанную с беременностью, лактацией и уходом за потомством. Обнаружено участие окситоцина в механизмах памяти. Главными стимулами высвобождения окситоцина являются эстрогены и нервные импульсы, возникающие при раздражении грудных сосков. Прогестерон ингибирует продукцию окситоцина. У мужчин окситоцин стимулирует семявыносящие протоки (эякуляцию), влияет на поведенческую активность, связанную с половой функцией.
Недостаточность вазопрессина проявляется в форме несахарного диабета, главными симптомами которого являются жажда и полиурия, но, в отличие от сахарного диабета, моча при недостаточности вазопрессина не имеет сладкого вкуса, а её удельный вес низкий.
ГОРМОНЫ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Тиреоидные гормоны оказывают влияние на фундаментальные физиологические процессы: клеточную дифференцировку, рост и метаболизм тканей.
В фолликулах щитовидной железы (ЩЖ) образуются 2 основных гормона: Т3 и Т4, которые действуют на клетки через внутриклеточные ядерные (R).
Особенностью гормонов ЩЖ является присутствие в их молекуле йода. В основе их структуры лежит тирониновое ядро, состоящее из двух конденсированных молекул L- тирозина. В ядро могут включаться 3 или 4 атома йода: 3,5,3’,5'-тетрайодтиронин (Т4, тироксин) и 3,5,3'-трийодтиронин (Т3). Третье производное тиронина — 3,3',5-T3 — не обладает гормональной активностью. Это «обратный Т3». Несмотря на то что Т3 намного активнее, чем Т4, в ЩЖ синтезируется главным образом Т4. Трийодтиронин образуется из Т4 путём дейодирования последнего в периферических тканях. Т3 обладает на порядок более высоким сродством к (R) периферических тканей, чем Т4.
Синтез гормонов ЩЖ осуществляется в 4 этапа. Во-первых, включение йода в ЩЖ с помощью йодного насоса, в работе которого принимает участие Na+-K+-зависимая АТФ-аза. Во-вторых, синтез тиреоидных гормонов, который начинается с включения йода в молекулы тирозинов, входящих в состав тиреоглобулина. Тиреоглобулин — главный белок коллоида, заполняющего фолликулы. Процесс йодирования тирозинов осуществляется с помощью тиреопероксидазы и H2О2 и стимулируется ТТГ. В-третьих, конденсация моно- и дийодтиронинов с образованием Т3 из Т4 под влиянием тиреопероксидазы. По мере йодирования остатков тирозина молекулы тиреоглобулина перемещаются в просвет фолликула, где они накапливаются «про запас». В-четвертых, секреция гормонов, которые освобождаются из тиреоглобулина при участии гидролаз лизосом эпителиальных клеток.
Регуляция синтеза гормоновЩЖ осуществляется гипоталамо-гипофизарной системой по принципу обратной связи: повышение уровня Т3 ингибирует высвобождение и синтез тиреотропина в гипофизе и тиреолиберина в гипоталамусе.
Влияние на метаболизм. Гормоны ЩЖ необходимы для нормального роста и развития организма. Они контролируют образование тепла, скорость поглощения кислорода, уча-
93
