
- •Методы исследования
- •Методы исследования в микробиологии
- •Список сокращений
- •Техника безопасности при работе с биологическим материалом
- •Характеристика уровней биобезопасности
- •Забор, хранение и транспортировка материала для микробиологического исследования
- •Микроскопический (бактериоскопический)
- •Сложные методы окраски клеточных структур бактерий
- •Сравнение электронного и светового микроскопов
- •4 Этап бсми. Заключение.
- •Культивирование микроорганизмов на питательных средах
- •Классификации питательных сред
- •I. По происхождению:
- •II. По составу:
- •III. По консистенции:
- •IV. По назначению:
- •Наиболее часто используемые индикаторы рН в питательных средах
- •Признаки колоний микроорганизмов
- •Методы выделения чистых культур аэробных и факультативно-анаэробных микроорганизмов
- •I. Методы механического разобщения бактерий.
- •Методы выделения чистых культур облигатно-анаэробных микроорганизмов
- •Культуральный (бактериологический) метод исследования
- •I. Этапы блми при выделении чистой культуры аэробов и факультативных анаэробов.
- •1 Этап.
- •2 Этап.
- •3 Этап.
- •Признаки, учитываемые при идентификации микроорганизмов (критерии вида)
- •4 Этап.
- •II. Этапы блми при выделении чистой культуры облигатных анаэробов.
- •1 Этап.
- •2 Этап.
- •1 2 3 5 4
- •1 2
- •6 3
- •5 4
- •Биохимическая идентификация микроорганизмов
- •Определение биохимических свойств микроорганизмов
- •Идентификация микроорганизмов без выделения чистой культуры
- •Принципы молекулярно-генетического анализа
- •Классификация молекулярно-генетических методов
- •Примеры некоторых рестриктаз и их рестрикционных сайтов
- •Методы, основанные на гибридизации нуклеиновых кислот.
- •III. Методы, основанные на амплификации нуклеиновых кислот.
- •Характеристика стадий пцр
- •Анализ результатов пцр
- •IV. Методы анализа амплифицированных фрагментов.
- •V. Методы, основанные на определении последовательности нуклеотидов в днк, рнк и аминокислот в белках.
- •VI. Методы, основанные на модификации генетической информации.
- •Характеристика штаммов e. Сoli, участсвующих в процессе конъюгации
- •Определение факторов патогенности бактерий
- •5. Капсула.
- •7. Изучение неизвестных токсинов и других факторов патогенности микроорганизмов, механизмы действия которых недостаточно изучены.
- •Методы изучения чувствительности бактерий к антибиотикам
- •Классификация методов определения чувствительности микроорганизмов к антибиотикам
- •Основные понятия
- •Дискодиффузионный метод
- •Пропорционален антибиотикочувствитель-ности микроорганизма
- •Метод разведений в агаре
- •Метод разведений в жидких средах
- •Е-тест (эпсилометрический метод)
- •Ускоренный метод
- •Автоматизированнный метод с использованием автоматических микробиологических анализаторов
- •Генетические методы
- •Некоторые резистентные формы микроорганизмов, получающие эпидемическое распространение.
- •1 Этап эсми. Взятие и обработка материала.
- •2 Этап эсми. Выбор и заражение лабораторного животного.
- •3 Этап эсми.
- •Общие принципы серологического метода исследования
- •I. Достоинства слми:
- •II. Недостатки слми:
- •Общие принципы аллергологического метода исследования
- •I этап алми. Сбор аллергологического анамнеза с целью:
- •II. Недостатки алми:
- •Литература
- •Электронные источники научной информации
- •Оглавление
1 2
3 4 5
Рис.
37.
Электрофореграмма продуктов ПЦР при
диагностике возбудителя бактериальной
инфекции:
1- маркер
молекулярного веса; 2 - положительный
контроль; 3 – результат положительный;
4 - результат отрицательный; 5 –
отрицательный контроль
Рис.
24.
Электрофореграмма
продуктов ПЦР при диагностике возбудителя
бактериальной инфекции: 1-3
– результат положительный; 4, 5 –
результат отрицательный; 6 – отрицательный
контроль; 7
– положительный
контроль.
Таблица 14
Образцы
Светящиеся
оранжевые полосы определенной
молекулярной массы
Отрицательный
контроль
должны
отсутствовать
Положительный
контроль
должны
присутствовать
Опытные образцы
положительные
присутствуют
Опытные образцы
отрицательные
отсутствуют
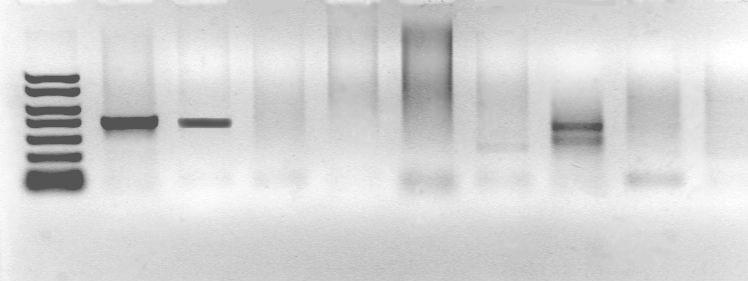
Анализ результатов пцр
При интерпретации результатов ПЦР следует помнить, что могут быть получены как ложноположительные, так и ложноотрицательные результаты.
Ложноположительные результаты могут наблюдаться в результате контаминации при нарушении правил проведения ПЦР. Ложноотрицательные результаты могут наблюдаться в результате снижения чувствительности ПЦР при ингибировании реакции компонентами биологических образцов.
Модификации ПЦР:
классическая (specific PCR) - амплификация участков ДНК размером до 5000 п.о. с использованием одной пары праймеров.
мультипраймерная (multiplex PCR) – одновременное использование нескольких пар праймеров в одной реакционной пробирке. Это позволяет проводить одновременную амплификацию ДНК различных возбудителей, что сокращает время и расход реактивов. Например, мПЦР для диагностики гнойных менингитов одновременно определяет ДНК наиболее вероятных возбудителей бактериальных менингитов: Neisseria meningitides, Haemophilus influenzae, Streptococcus pneumoniae.
широкодиапазонная использование универсальных праймеров, взаимодействующих с высоко консервативными участками ДНК, встречающимися у многих микроорганизмов. Применяют для выявления в клиническом материале от больного микроорганизмов, в том числе неизвестных и некультивируемых. Обычно мишенью для ПЦР являются гены, кодирующие рибосомы 16S и 23S, имеющие сходную структуру у различных прокариот.
с обратной транскрипцией – используется для обнаружения РНК у РНК-вирусов. Первоначально при помощи РНК-зависимой ДНК-полимеразы (обратной транскриптазы или ревертазы) синтезируют комплементарную ДНК, которую затем используют в стандартной ПЦР.
гнездовая – обладает большей чувствительностью и специфичностью, т. к. проводится последовательно с двумя разными парами праймеров. ДНК продукты, образуемые в первой ПЦР, взаимодействуют со второй парой праймеров.
в реальном времени – используется для определения точечных мутаций, количественного содержания ДНК в пробе, а также для определения уровня экспрессии генов. Этот тип ПЦР находит все большее распространение, так как выявление ампликонов осуществляется по флюоресценции зондов либо красителя SybrGreen и не требует проведения электрофореза (сокращается время и трудоёмкость анализа).
ПП-ПЦР или ПЦР с использованием произвольных праймеров (RAPD-анализ полиморфизма случайно амплифицированной ДНК) – основана на использовании коротких праймеров, длиной 9–10 п. о., способных связаться с разными участками ДНК при низкой температуре отжига. В результате RAPD-анализа происходят амплификации нуклеотидных последовательностей в различных областях генома и образуются многочисленные фрагменты разной длины, по количеству и размерам которых судят о групповой или видовой принадлежности микроорганизма.
ассиимметричная – один из праймеров берут в концентрации в 10 раз большей, чем другой, чем добиваются преобладания среди продуктов реакции одноцепочечных ДНК над дуплексами.
