
- •Лекция №9 электромагнетизм магнитное поле. Индукция магнитного поля
- •Линии магнитной индукции
- •Магнитный поток.
- •Теорема гаусса для магнитного поля
- •Работа по перемещению проводника с током в магнитном поле
- •Явление электромагнитной индукции
- •Закон электромагнитной индукции.
- •Лекция №10 индуктивность
- •Индуктивность соленоида
- •Явление и закон самоиндукции
- •Энергия магнитного поля
- •Электромагнитное поле вихревое электрическое поле
- •Ток смещения
- •Уравнения максвелла
- •Электромагнитные волны
- •Волновые свойства света
- •Интерференция волн
- •Лекция №13 принцип гюйгенса
- •Оптическая пирометрия
- •Лекция № 14 опыт резефорда. Планетарная модель атома
- •Постулаты бора
- •Линейчатые спектры и закономерности в них
- •Боровская теория атома водорода
- •Гипотеза де бройля
- •Корпускулярно-волновой дуализм
- •Принцип неопределённостей гейзенберга
- •Уравнение шрёдингера
- •Лекция №16 элементы ядерной физики состав атомного ядра
- •Ядерные силы.
- •Энергия связи ядра
- •Радиоактивность
- •Закон радиоактивного распада
- •Ядерные реакции и законы сохранения
- •Ядерная цепная реакция
- •Термоядерные реакции
Линейчатые спектры и закономерности в них
Изучая соотношение частот разных спектральных линий в видимой области спектра атома водорода, Бальмер вывел эмпирическую формулу, которая описывала наблюдаемые частоты и позволила предсказать ряд других, ранее не наблюдавшихся. Позднее другими исследователями были получены аналогичные соотношения для частот спектральных линий, входящих в другие области спектра водорода (ультрафиолетовую и инфракрасную). С учётом всех этих данных обобщённая формула Бальмера имеет вид:
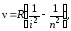 (4)
(4)
где — частота, испускаемого света; i = 1, 2, 3, 4 — целое число, характеризующее серию линий; n = i +1, i + 2, ... — целое число, характеризующее конкретную линию серии; R = 3,28·1015 с–1 — постоянная Ридберга. При i = 1 описывается так называемая серия Лаймана в ультрафиолетовой области, при i = 2 — серия Бальмера в видимой области, при n = 3, 4, 5 — серии Пашена, Брэкета и Пфунда в инфракрасной области.
Простота формулы Бальмера и точность описания спектра предполагала, что эта формула не формальна, а имеет глубокий смысл, т.е. её можно получить теоретически. Бор рассмотрел атом водорода с учётом предложенных постулатов.
Боровская теория атома водорода
Электрон, двигаясь по круговой орбите радиусом r, обладает центростремительным ускорением a = 2/ r. Между электроном и ядром действует кулоновская сила притяжения F = e2/(4r2). По второму закону Ньютона запишется:
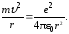 (5)
(5)
Здесь m и — масса и скорость электрона; e — заряд электрона и ядра по абсолютной величине; 0 — электрическая постоянная. Из второго постулата Бора = nh/(2mr). Подставляя это значение в выражение (4), находим, что
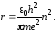 (6)
(6)
Отсюда следует, что электрон движется лишь по орбитам вполне определённого, а не любого радиуса. При n = 1 получаем радиус первой боровской орбиты
r1 = h2/(me2). (7)
Тогда радиусы остальных орбит определяются из соотношения
r = r1n2 . (8)
Формула (7) позволила оценить размеры атома водорода (~10–10 м), который определяется радиусом вращения электрона.
Полная энергия W атома при движении электрона по орбите радиуса r складывается из кинетической энергии Wk электрона относительно ядра и потенциальной энергии Wp взаимодействия электрона с ядром, т.е. W = Wk + Wp. Уравнение (5) преобразуем к виду:
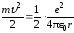 илиWk
=
(1/2)Wp, (9)
илиWk
=
(1/2)Wp, (9)
поскольку
Wp
=
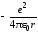
потенциальная энергия взаимодействия
двух зарядов и m2/2 = Wk
кинетическая энергия электрона. Учитывая
это и выражение (9), получаем, что
W= (1/2)Wp =
потенциальная энергия взаимодействия
двух зарядов и m2/2 = Wk
кинетическая энергия электрона. Учитывая
это и выражение (9), получаем, что
W= (1/2)Wp = 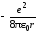 .
Подставляя в эту формулу соотношение
(6), находим:
.
Подставляя в эту формулу соотношение
(6), находим:
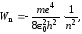 (10)
(10)
где n может принимать только целые значения 1, 2, 3, ... . Величину n в квантовой физике называют главным квантовым числом.
На основе выше сказанного можно объяснить природу линейчатых спектров. Согласно третьему постулату Бора, энергия испущенного или поглощённого кванта с учётом (10) равна:
h = Wn Wi = 
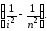 (11)
(11)
Отсюда частота кванта
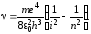 (12)
(12)
Сравнивая
это выражение с соотношением (4), видим,
что теоретическим путём была получена
формула Бальмера. Постоянная Ридберга
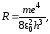 вычисленная по формуле и найденная
экспериментально совпадают.
вычисленная по формуле и найденная
экспериментально совпадают.
Таким образом, теория Бора позволила вычислить энергию атома водорода, его размеры и объяснить происхождение линейчатых спектров. Слабой стороной теории Бора была внутренняя логическая противоречивость: с одной стороны, она использовала классическую теорию (закон Ньютона), с другой новые квантовые представления (постулаты Бора). После открытия волновых свойств вещества стало совершенно ясно, что теория Бора явилась только переходным этапом на пути создания новой последовательной теории атомных явлений квантовой механики.
