
лекции для нехимиков-1
.pdfШарлай Е.В.
ЛЕКЦИИ ПО КУРСУ
«НЕОРГАНИЧЕСКАЯ ХИМИЯ»
Рекомендуемая литература:
1.Глинка, Н.Л. Общая химия.
2.Ахметов, Н.С. Общая и неорганическая химия.
3.Угай, Я.А. Общая и неорганическая химия.
4.Коровин, Н.В. Общая химия.
5.Хаускрофт, К., Констебл, Э. Современный курс общей химии.
6.Шрайвер, Д. Эткинс, П. Неорганическая химия.
7.Гринвуд Н., Эрншо А. Химия элементов.
8.Неорганическая химия. Под ред. Третьякова Ю.Д.

Тема №1.
ВВЕДЕНИЕ. ОСНОВНЫЕ ЗАКОНЫ И ПОНЯТИЯ ХИМИИ
1.1. Предмет химии
Корни слова «химия» уходят в древность и навряд ли мы когда-нибудь точно узнаем, где оно точно возникло, хотя гипотез очень много. Термин «химия» в сегодняшнем понимании вошли в науку с начала 17 века.
Химия относится к числу естественных наук и определяется по-разному. Наиболее общепринятым определением является следующее: химия – наука о составе, строении, свойствах веществ и законах их превращения, связанных с изменением электронного окружения атомных ядер.
Т.о., главным предметом изучения химии являются вещества и их превращения. Существует множество разделов химии, но ее фундаментом считаются четыре: не-
органическая, органическая, физическая и аналитическая. Для любой науки характерны два взаимообратных процесса: дифференциация на более мелкие составляющие (химия карбидов, гидридов, фосфора и др.) и интеграция с другими науками, появление новых, гибридных разделов в смежных областях (бионеорганическая химия, элементоорганическая, нанохимия и др.).
Вещество – вид материи, обладающий массой покоя и проявляющийся в виде частиц (атомов, молекул, электронов, протонов т.д.).
Поле – форма материи, связывающая частицы вещества, осуществляющая взаимодействие этих частиц, частицы поля не имеют массы покоя (фотоны, W- и Z-бозоны и т.д.). Полевая форма материи не является непосредственным объектом изучения химии, но изучается как энергетические характеристики химических реакций.
Под химической реакцией понимается превращение одних веществ (исходных) в другие (продукты) при неизменяющихся ядрах атомов веществ. При этом разрываются старые химические связи и образуются новые.
Следует помнить, что разделение материи на вещество и поле весьма условно, и доказано это в 1905 г. А. Эйнштейном выводом известной формулы Е=mc2. Аннигиляция электрона и позитрона (частицы вещества) дает два фотона (частицы поля), при этом возможен и обратный процесс.
Постоянным параметром остается энергия системы, которая может видоизменяться, но не может исчезать и появляться ниоткуда. Энергию можно определить как меру движения материи. Разным видам движения материи соответствуют разные формы энергии. Химический вид движения материи проявляется в химических реакциях. Химическая энергия – мера внутренних изменений в веществах при химической реакции.
Как возникло вещество? На этот вопрос отвечает, хотя и со множеством оговорок теория Большого Взрыва. По этой теории предполагается, что вся материя Вселенной некогда была сосредоточена в очень небольшом объеме с огромной плотностью (~1096 г/см3) и температурой (~1032 К), который по каким-то причинам взорвался и стал расширяться, распространяя вещество. По мере расширения Вселенная охлаждалась, что позволило дифференцироваться четырем основным взаимодействиям (поле) и привело к образованию материальных частиц (вещество). То, что происходило до времени Планка, непосредственно после Взрыва (1,33·10–43 с), научным подсчетам пока не поддается, это время, в течение которого ФВ были интегрированы и равносильны, это время инфляционного расширения Вселенной. Через 10–43 с (Т=1031 К), отделилась гравитация, через 10– 35 с (1028 К) отделилось сильное ядерное взаимодействие. Через 10–10 с (1015 К) после БВ дифференцировались слабое ядерное и электромагнитное взаимодействие. К 10–6 с (1012 К) из кварков образовались протоны и нейтроны, затем, на орбиталях атомов (водорода, дейтерия и гелия) стабилизировались электроны, т.е. стали образовываться элементы.
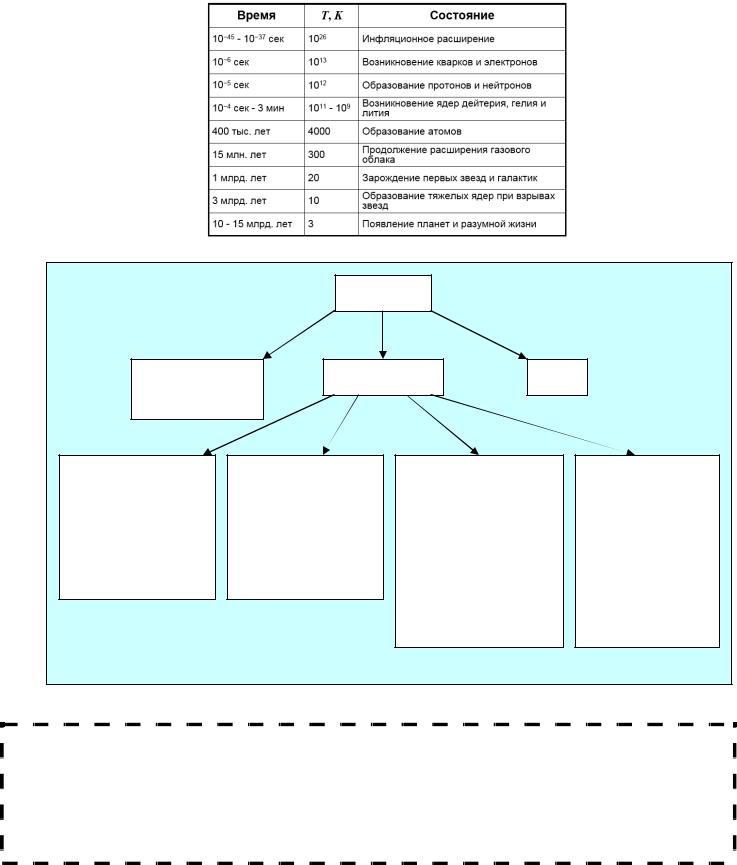
В течение первых 8 минут после Взрыва было сформировано около четверти всей массы ядер гелия, три четверти вещества были представлены водородом. 10–3% представляли собой ядра дейтерия и 10–6% – ядра лития. Это процентное содержание сохраняется в среднем, по Вселенной, до сих пор. Никакая другая космологическая теория не может объяснить такое распределение вещества.
Наша Вселенная не стационарна, она до сих пор расширяется, и экстраполяция скорости расширения в прошлое указывает на примерную дату возникновения вселенной: около 15 мрд лет назад.
Понятие вещество классифицируют по множеству оснований (рис. 1). |
|||||
|
|
материя |
|
|
|
физический |
вещество |
поле |
|
||
вакуум |
|
|
|
|
|
|
различные основания классификации понятия «вещество» |
||||
1. простое |
1. дальтониды |
|
1. атомы |
(5. конденсат |
|
О3, Р4, Ar |
ZnO(тв), H2O(тв), |
|
С(алмаз), Fe(тв) |
Бозе- |
|
2. сложное |
|
N2(тв) |
|
2. молекулы |
Эйнштейна?) |
|
|
|
1. твердое |
||
H2O, C2H5OH, |
2. бертоллиды |
О2(г), С6Н12О6(тв) |
тело |
||
C6H6 |
|
Ti0,7O, Pb0,9S |
|
3. ионы |
2. жидкость |
|
|
|
|
3. газ |
|
|
|
|
NaCl(тв), CuSO4(тв) |
4. плазма |
|
Рис. 1. Связь основных понятий, которыми оперирует химия |
|||||
Физический вакуум (1927 г, англ. Поль Дирак) – состояние системы, в котором формально нет ни одной возбужденной частицы, флуктуирующее электромагнитное поле виртуальных частиц. Оно возникает вследствие квантовой природы материи и проявляется, например, эффектом Казимира.
Конденсат Бозе-Эйнштейна – агрегатное состояние материи, основу которой составляют атомные пары– бозоны, охлаждённые до температур, близких к абсолютному нулю (меньше миллионной доли градуса выше абсолютного нуля). В таком сильно охлаждённом состоянии достаточно большое число атомов оказывается в своих минимально возможных квантовых состояниях, и квантовые эффекты начинают проявляться на макроскопическом уровне.
Плазма – одно из агрегатных состояний вещества, ионизированный газ.
Простые вещества состоят из атомов одного вида. Сложные – из различных атомов. Атом – наименьшая частица химического элемента, носитель его свойств.
В качестве атомной единицы массы Ar (а.е.м.) в настоящее время принята 1/12 часть массы атома изотопа углерода 12С. Численные значения атомных масс элементов пересматриваются Комиссией по атомным массам и распространенности изотопов ИЮПАК каждые 2 года. Масса «плавает», чаще всего, из-за естественных вариаций в относительной распространенности изотопов. Наиболее трудной задачей (по вполне понятным причинам) является определение относительной атомной массы радиоактивных элементов.
Химический элемент – совокупность атомов с определенным зарядом ядра. В свободном состоянии существует в виде простого вещества. В настоящее время известны 118 химических элементов. Из 92 элементов от водорода до урана, за исключением технеция и прометия, построено все вещество на Земле, что мы видим (технеций обнаружен на некоторых звездах).
Важной характеристикой химического элемента является его валентность – свойство атомов данного элемента присоединять или замещать в соединении определенное число других атомов или атомных групп.
Молекула – микрочастица, образованная из двух или большего числа атомов, способная к самостоятельному существованию.
Относительная молекулярная масса Mr складывается из относительных атомных масс элементов, входящих в ее состав. [Mr]=а.е.м. ([M]=г/моль – молярная масса).
Моль – единица количества вещества, содержащая столько формульных единиц, сколько их находится в 12 г изотопа углерода 12С (Число Авогадро NA=6,02·1023). Фор-
мульная единица – это атомы, молекулы, ионы, а также любая совокупность химических частиц, передаваемая химической формулой, например, формульная единица кристалла хлорида натрия – NaCl.
Ионы – одноатомные или многоатомные частицы, несущие электрический заряд. Положительные названы катионами (Na+, NH4+), отрицательные – анионами (Cl–, SO42–).
В свободном состоянии существуют в виде газовой плазмы.
Основу химии составляют атомно-молекулярное учение, стехиометрические законы, газовые законы, периодический закон, теория строения вещества.
1.2. Стехиометрические и газовые законы
Стехиометрия – совокупность расчетов, связанных с применением хим. формул и уравнений.
Закон сохранения массы. Первая формулировка дана в 1756 г. М.В. Ломоносовым на основе экспериментов по обжигу металлов в запаянных сосудах. В 1774 г. закон «переоткрыл» для Европы француз Антуан Лоран Лавуазье, который изучил большое число реакций окисления.
Суммарная масса продуктов реакции равна суммарной массе исходных веществ.
Закон сохранения энер-
гии. В 1760 г. М.В. Ломоносов сформулировал в письме другу первую догадку о
М. В. Ломоносов |
Юлиус Роберт Майер |
Антуан Лоран Лавуазье |
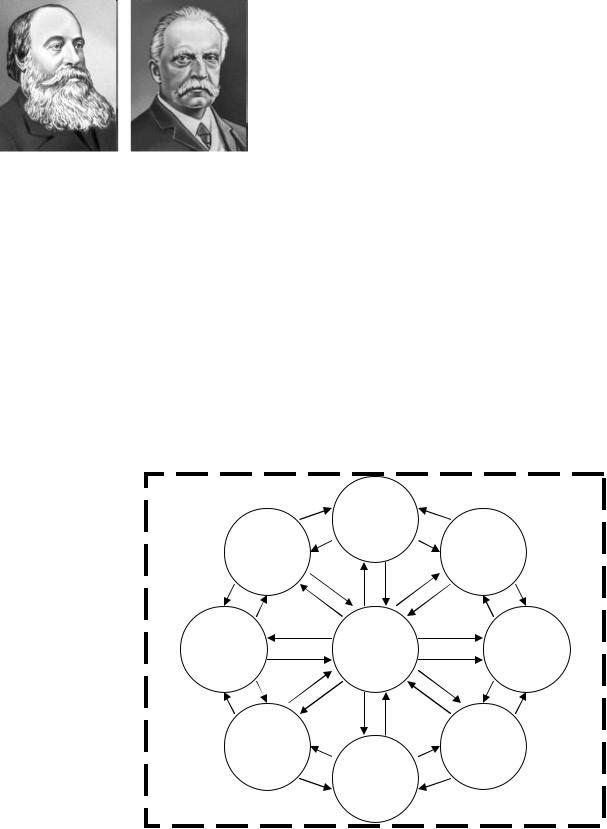
сохранении массы-энергии: «Все перемены, в натуре случающиеся, такого суть состояния, что сколько чего у одного тела отнимается, столько же присовокупится к другому. Так, ежели где убудет несколько материи, то умножится в другом месте… Сей всеобщий естественный закон распространяется и в самые правила движения, ибо тело, движущее своею силою другое, столько же оныя у себя теряет, сколько сообщает другому, которое от него движение получает».
Первым известным видом энергии, которым вплотную занялся англичанин с пивоварней Джеймс Прескотт Джоуль, была тепловая энергия. Он же догадался, что тепло – не единственная форма энергии, существует еще, как минимум, механическая. Джоуль впервые вывел меру связи энергии (в эргах) и теплоты (в калориях)
– одна калория теплоты получается при затрате приблизительно 4,18·107 эргов энергии. Позднее в честь Джоуля Дж.П Джоуль Г.Л.Ф. Гельмгольц установили единицу энергии. Джоуль равен 107 эргов,
т.о., в настоящее время принято, что 1 кал=4,184 Дж. В 1842 г. немец Роберт Майер высказал предположение, что различные виды энергии могут переходить друг в друга (причем любой вид энергии может быть превращен только в ограниченное количество теплоты) и определил эквивалентные соотношения между различными видами энергии, указав, что при переходах энергия не исчезает и не возникает неоткуда, но на его работы внимания почти не обратили. В 1847 с подобным утверждением выступил немец Герман Людвиг Фердинанд Гельмгольц и его услышали. Закон сохранения Е часто называют 1- вым законом термодинамики (движение тепла).
При любых процессах, происходящих в изолированной системе, ее полная энергия не изменяется. Изолированной называют систему, которая никак не взаимодействует с внешней средой.
|
химическая |
ядерная |
биохимическая |
механическая |
тепловая |
электрическая |
потенциальная |
магнитная |
|
световая |
Рис. 2. Связь между различными видами энергии по Р. Майеру

Закон эквивалентов. Впервые сформулирован в 1792 г. нем. ученым Иеремией Вениамином Рихтером на основе богатого экспериментального материала, полученного англичанином Генри Кэвендишем в результате изучения реакций нейтрали-
зации.
Химические элементы входят в состав молекулярных соединений в строго определенных соотношениях масс, называемых эквивалентами. Химический эквивалент элемента – число единиц его массы, которое соединяется с единицей массы водорода или с 8 единицами массы кислорода или замещает эти же количества в их соединениях.
Например, в Н2О на одну массу Н приходится 8 масс О, в HCl на одну массу Н приходится 35,5 масс Cl.
В качестве единицы массы можно выбрать любую, поэтому эквивалент элемента – безразмерен. Масса эквивалента элемента в граммах называется грамм-эквивалентом ([Мэкв]=г), в приведенных примерах эквивалентная масса О равна 8 г, хлора – 35,5 г.
Эквивалент элемента – величина переменная.
Э(Эл)=Ar/B. Ar – относительная атомная масса элемента в а.е.м., B – валентность или степень окисления элемента в соединении.
Существует понятие эквивалент соединения:
1)Экислоты=Мr(кислоты)/основность кислоты.
2)Эоснования=Мr(основания)/кислотность основания.
3)Эсоли=Мr(соли)/суммарный заряд катионов.
4)Эоксида=Э(О)+Э(Эл)=8+ Э(Эл).
При вычислении эквивалентов необходимо учитывать конкретный состав продуктов
реакции. |
|
Н2SO4+NaOH=NaHSO4+H2O |
Мэкв(Н2SO4)=98 г. |
Н2SO4+2NaOH=Na2SO4+2H2O |
Мэкв(Н2SO4)=98/2=49 г. |
В расчетах по закону эквивалентов часто применяется следующая его формулиров-
ка: массы реагирующих веществ прямо пропорциональны их эквивалентам или эквивалентным массам.
 m1/m2=Э1/Э2.
m1/m2=Э1/Э2.
Закон постоянства состава и свойств вещества. Выведен в результате многолет-
ней полемики (1801-1807 гг.) между Жозефом-Луи Прустом и Клодом-Луи Бертолле. В дискуссии в то время победили воззрения Пруста, Бертолле проиграл по причине преждевременности его концепции.
|
|
Каждое химически чистое соеди- |
|
|
нение независимо от метода его полу- |
|
|
чения имеет одни и те же свойства и |
|
|
состоит из одних и тех же элементов, |
|
|
массовые соотношения между кото- |
|
|
рыми постоянны (при условии строгой |
|
|
определенности |
Жозеф-Луи Пруст |
Клод-Луи Бертолле |
изотопного состава веществ). |
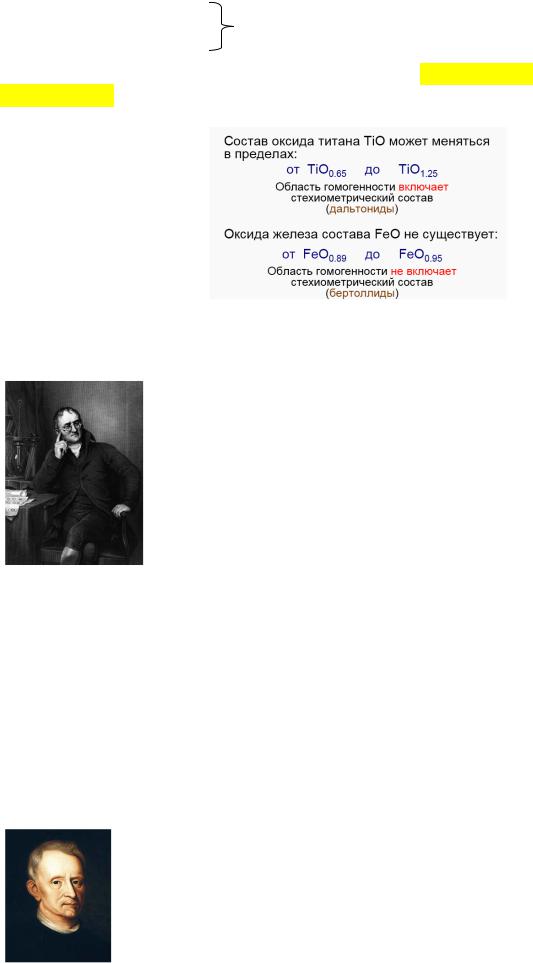
2Zn+O2+2ZnO |
80,34% Zn |
ZnCO3=ZnO+CO2↑ |
19,66% O |
Вещества, подчиняющиеся закону были названы дальтонидами, не подчиняющиеся
– бертоллидами. К последним относятся практически все вещества немолекулярного строения: различные оксиды, сульфиды, нитриды, гидриды и т.д., например, ZrN0,89.
Закон кратных отношений. Впервые сформулирован в 1803 г. англ. Джоном Дальтоном.
В случае, когда два элемента образуют между собой несколько химических соеди-
|
нений молекулярного строения, имеет место отношение массы |
||||
|
одного их элементов, приходящееся в этих соединениях на одну и |
||||
|
ту же массу другого, как небольших целых чисел. |
||||
|
Н2О |
|
Н2О2 |
||
|
1 моль |
|
1 моль |
||
|
Σm=18 г |
|
Σm=34 г |
||
|
m(Н)=2 г |
|
m(Н)=2 г |
||
|
m(О)=16 г |
|
m(О)=32 г |
||
|
16 |
: |
32 |
|
|
Джон Дальтон |
|
1 |
: |
2 |
|
Газовые законы
В древности люди быстро сообразили, что то невидимое, чем они дышат и то, что разрушает их дома в бурю, не может быть пустотой. Долгое время эту субстанцию считали единым целым и называли просто «воздухом». Алхимики, наблюдая выделение пузырьков в какой-либо реакции так и писали: выделился воздух. Один талантливый алхимик, Ян Баптист ван Гельмонт в 1630 году перестал удовлетворяться просто «воздухом», так как видел, что не все, что что выделяется в газообразном виде, похоже на воздух (азотная кислота+серебро, известняк+уксус+горение). Он сделал вывод, что разных воздухов довольно много. Бельгиец Ван Гельмонт назвал эти «воздухи» греческим словом
«хаос» на фламандский манер – получилось слово «газ».
Собирая газы в перевернутый сосуд через ртуть, т.к. быстро обнаружилось, что некоторые газы растворяются в воде, которую использовали в начале, английский священник Джозеф Пристли открыл кислород, диоксид азота, сернистый газ, аммиак, хлористый водород и т.д. Особенно ему понравилось содинение СО2 с водой – первая содовая.
Основными характеристиками газа являются его давление, Я.Б. ван Гельмонт температура и объем, соотношения между которыми определяются га-
зовыми законами.
1. Закон Бойля-Мариотта
|
|
Давление определяется как сила, действую- |
|
|
щая на единицу поверхности: |
|
|
p=F/S. |
Роберт Бойль |
Эдм Мариотт |
Единицей для давления в СИ является паскаль. |
ИЮПАК (Международный союз теоретической и прикладной химии) рекомендует в качестве стандартного давления 1 бар (105 Па). Иногда давление измеряют в атмосферах (1
атм=101325 Па).
Когда давление газа фиксированной массы растет, объем уменьшается по закону Бойля–Мариотта обратно пропорционально:
р1/р2=v2/v1.
2. Закон Гей-Люссака
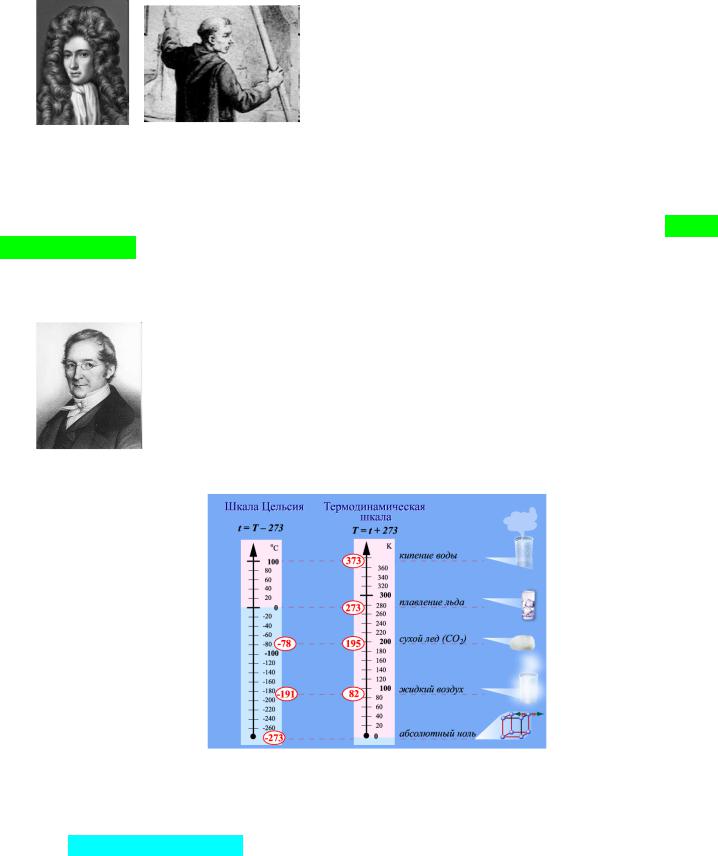
Температура – это мера нагретости тела. В химии чаще всего применяются две шкалы: Цельсия, где реперными точками приняты температуры замерзания и кипения чистой воды и Кельвина, которая линейно соотносится со шкалой Цельсия и ведет отсчет от абсолютного минимума температур. Пересчет из одной шкалы в
Жозеф-Луи Гей-Люссак другую ведется по формуле:
К=С+273,15.
За стандартную температуру при расчетах принимают 298,15 К (по ИЮПАК –
273,15 К).
Закон Б-М применим только при постоянной температуре, т.к. объем газа зависит от температуры и давления одновременно. Объем и температура фиксированной массы газа связаны законом Гей-Люссака прямо пропорционально:
v1/v2=T1/T2.
Комбинация законов дает взаимосвязь всех трех параметров (объединенный газовый закон):
P1V1/T1=P2V2/T2.
Это соотношение используется для приведения параметров газа к нормальным условиям.
3. Закон Авогадро
Впервые сформулирован итал. физиком Амедео Авогадро в 1811 г. и основан на экспериментальных исследованиях по изучению химических реакций между газами Гей-Люссака и его же законе объемных отношений (1808): при неизменных температуре и давлении объемы вступающих в реакцию газов относятся друг к другу, а также к объемам образующихся газообразных продуктов как небольшие целые числа.
В равных объемах любых газов при одинаковых условиях содержится одинаковое число молекул.
Следствия:
одинаковое число молекул различных газов при одинаковых условиях (давлении и температуре) занимает одинаковый объем;
один моль любого газа при определенных условиях занимает определенный объем (молярный объем).
При н.у. (Т=273 К и Р=101,325 кПа) 1 моль газа занимает объем 22,4 л.
Молекулярную массу газа можно вычислить несколькими способами.
1.При н.у. М=D·22,4, где D – плотность газа в г/л.
2.М=2·DH2 M=29·Dвозд, где DH2, Dвозд – относительная плотность газа по водороду или воздуху. В расчете молярной массы воздуха используется формула
Мср=М1φ1+М2φ2+…+Mnφn, где φ – объемная или мольная доля компонента газовой смеси. 4. Уравнение Менделеева-Клапейрона. Если газ можно считать за идеальный, т.е.
пренебречь взаимодействием между молекулами или атомами газа, его параметры можно рассчитывать по уравнению М-К (уравнение состояния идеального газа):
PV=nRT или PV=(m/M)RT.
Где универсальная газовая постоянная R=8,314 Дж/(моль·К).
5. Закон Дальтона
Суммарное давление смеси газов, равно сумме парциальных давлений отдельных компонентов газовой смеси. Это закон парциальных давлений Джона Дальтона:
р=рa+pb+…,
где р – суммарное давление смеси газов; рa – парциальное давление компонента А и т.д. Парциальное давление газа пропорционально числу его молей:
px=(nx/nΣ)·pΣ.
Парциальные давления часто используются при расчете констант равновесия газофазных реакций.
