
лекции для нехимиков-1
.pdf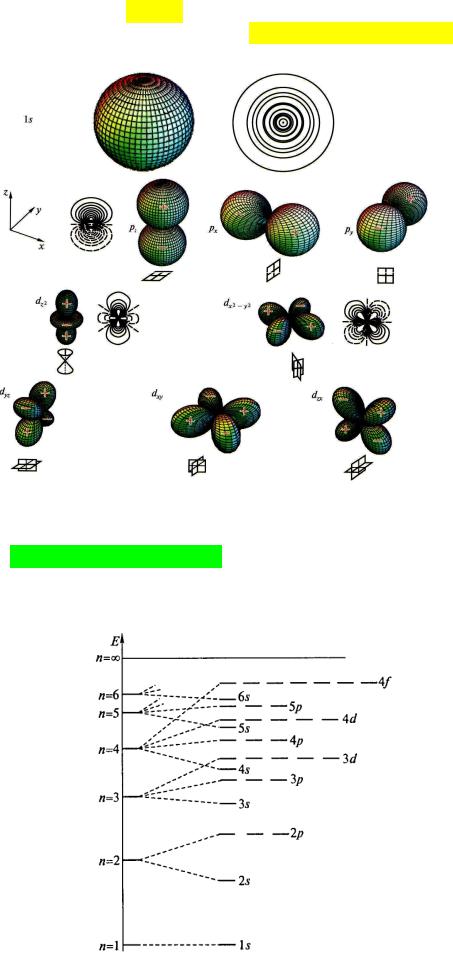
Количество максимумов возрастает с увеличением главного квантового числа. 3sорбиталь, например, имеет три максимума, т.е. существует вероятность нахождения электрона ближе к ядру, чем на расстоянии, соответствующем радиусу 3-ей боровской орбиты. Точки, в которых радиальная составляющая волновой функции обращается в ноль, называются радиальными узлами. Поверхности, на которых угловые части волновых функций проходят через нуль, называются узловыми поверхностями. Электрон в таких точках пространства атома теоретически обнаружить нельзя.
Энергии орбиталей водородоподобного атома сменяются сложным образом. Наблюдающиеся начиная с 4s-/3d-орбиталей «ужимки и прыжки» обусловлены электронэлектронным взаимодействием внутри реальных многоэлектронных атомов. При этом вводится понятие эффективного заряда ядра: на электрон внешнего уровня действует заряд, меньший истинного заряда ядра, т.к. внутренние электроны экранируют внешние. Это приводит к понижению энергии соответствующих орбиталей с увеличением заряда ядра.
Е = 0 приписывается электрону, не связанному с ядром, что соответствует n = ∞. Чем ближе к ядру расположена орбиталь, тем более отрицательно значение энергии электрона на ней. По мере возрастания n разница в энергии уровней уменьшается.
Как уже отмечалось, уравнение Шредингера точно решается только в случае водорода и водородоподобных атомов. Для более сложных случаев необходимо учитывать взаимодействие электронов друг с другом и использовать различные приближенные методы. Волновую функцию сложного атома можно выразить через одночастичные волновые функции. Если пренебречь энергией взаимодействия электронов, то запись упрощается до произведения волновых функций отдельных частиц, которые подобны волновым функциям атома водорода и характеризуются подобными квантовыми функциями. Набор значений n и l для всех электронов атома называют его электронной конфигурацией.
При заселении атома электронами (построении электронной конфигурации) кроме квантовых чисел используется ряд важных положений квантовой физики.
В 1924 г Вольфганг Паули сформулировал один из важнейших постулатов теоретической физики – принцип запрета: на одной орбитали (в одном энергетическом состоянии) не может одновременно находиться более двух электронов, да и то только в том случае, если их спины противоположно направлены. Другие формулировки: две тождественные частицы не могут находиться в одном квантовом состоянии; в одном атоме не может быть двух электронов с совпадающими значениями всех четырех квантовых чисел. Это правило можно рассматривать, как дополнительный ограничитель решений уравнения Шредингера.
Еще одним важным принципом является принцип заполнения (наименьшей энергии), выражаемый в правилах n+l (Клечковского). Электроны в основном состоянии заполняют орбитали в последовательности повышения их энергии. Энергия электронов (АО) растет с увеличением суммы n+l, в случае одинаковой суммы n+l, энергия электрона (АО) растет с увеличением n. Из этого правила есть исключения f-элементы).
При заполнении электронами подуровней используется правило Гунда. В пределах одного подуровня электроны распределяются так, чтобы суммарный спин был максимален, или, вырожденные (с одинаковой энергией) орбитали заполняются одиночными электронами с одинаково направленными спинами, лишь после этого идет заполнение электронами с противоположно направленными спинами согласно принципу Паули. Это значит, что для спаривания электронов требуется дополнительная энергия.
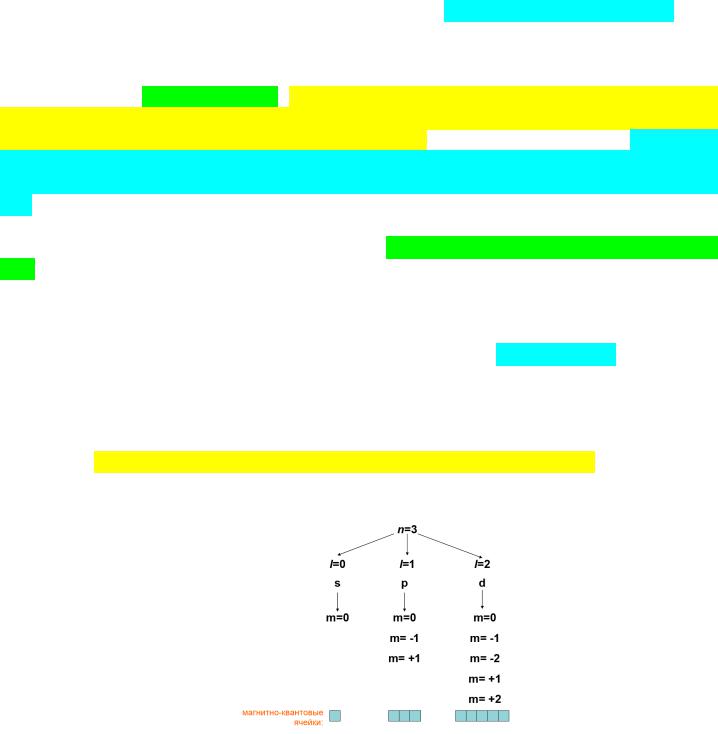
Разберем детально на примере 3-го энергетического уровня заполнение его электронами.
К 1927 г. была в целом построена электронная структура всех известных к тому времени 92 элементов. Создание учения о строении электронных оболочек атомов позволило разработать теорию периодической системы, объяснившую причины периодичности свойств элементов и их соединений, а также создать первые теории химической связи.
2.5. Атомное ядро
Атом является сложной, в целом электронейтральной частицей.
Строение атома:
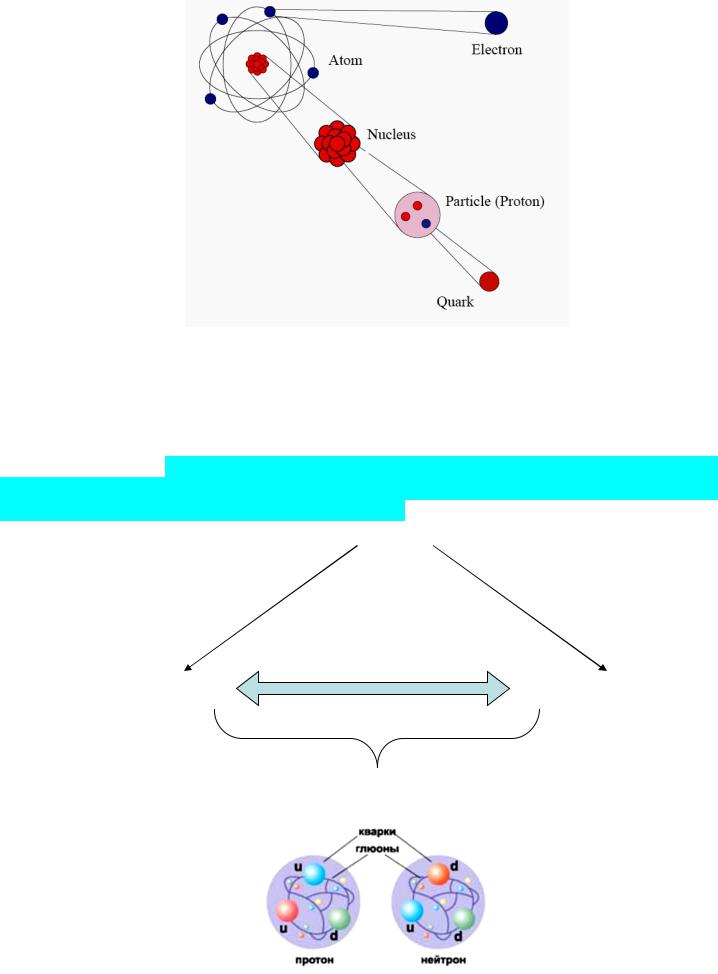
атом состоит из ядра и движущихся вокруг электронов. Ядро состоит из протонов и нейтронов (нуклонов). Каждый нуклон состоит из трех кварков (uud для протона и udd для нейтрона).
Кварк u имеет заряд +2/3 заряда электрона, кварк d имеет заряд –1/3. Кварки связаны в одну систему
сильным ядерным взаимодействием, переносчиками которого являются глюоны.
Атомное ядро состоит из нуклонов: протонов и нейтронов, которые занимают объем от 1 до 10 фм. Заряд ядра, равный порядковому номеру элемента в таблице Д.И. Менделеева, совпадает с числом протонов (и электронов): массовое число ядра равно суммарному количеству протонов и нейтронов.
ЯДРО
СИЛЬНОЕ ЯДЕРНОЕ ВЗАИМОДЕЙСТВИЕ
ПРОТОНЫ |
(глюоны) |
НЕЙТРОНЫ |
|
(р+) uud |
(n0) udd |
(НУКЛОНЫ)
За связь нуклонов в ядре, как и за связь кварков в нуклонах отвечает сильное ядерное взаимодействие – одно из фундаментальных взаимодействий, переносчиками которого являются глюоны.
Основные свойства ядерных сил:
1)являются силами притяжения;
2)являются короткодействующими: проявляются, когда расстояние между нуклонами не более 10–15 м;
3)обладают зарядовой независимостью (не являются электрическими): одинаковы между парами протон-протон, протон-нейтрон и нейтрон-нейтрон;
4)имеют способность к насыщению: каждый нуклон взаимодействует только с несколькими соседями;
5)зависят от взаимной ориентации спинов взаимодействующих нуклонов: протон и нейтрон, например, образуют ядро дейтерия только при условии параллельности их спинов;
6)не являются центральными силами: их нельзя представить в виде сил, действующих от одного центра.
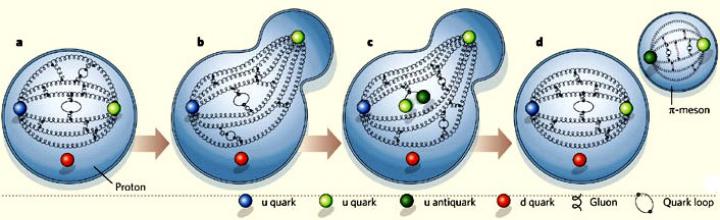
Как было выяснено экспериментально, протон и нейтрон, имеющие сложную структуру, «невозможно» разделить на составляющие, т.к. при попытке «вынуть» какой либо кварк, из протона вылетает не он, а кварк-антикварковая пара (π-мезон). Механизм этого процесса сложен, изучается до сих пор и связан тесно с кварками и порождаемым ими глюонным полем.
Сравнительные характеристики элементарных частиц и, отдельно, протона с нейтроном, приведены в таблицах.
|
|
кварки |
|
|
|
|
лептоны |
|
|
|
|||||
|
обозначение |
|
|
электрический |
|
|
название |
|
|
обозначение |
|
|
электрический |
|
|
|
|
|
заряд |
|
|
|
|
|
|
заряд |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
u |
|
|
|
+2/3e |
|
электрон |
|
e |
|
–e |
||||
|
c |
|
|
|
+2/3e |
|
|
мюон |
|
|
μ |
|
|
–e |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
t |
|
|
|
+2/3e |
|
таон |
|
τ |
|
–e |
||||
|
d |
|
|
|
–1/3e |
|
|
электронное |
|
|
νe |
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
нейтрино |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
s |
|
|
|
–1/3e |
|
|
мюонное |
|
|
νμ |
|
|
0 |
|
|
|
|
|
|
|
нейтрино |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
b |
|
|
|
–1/3e |
|
|
таонное |
|
|
ντ |
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
нейтрино |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
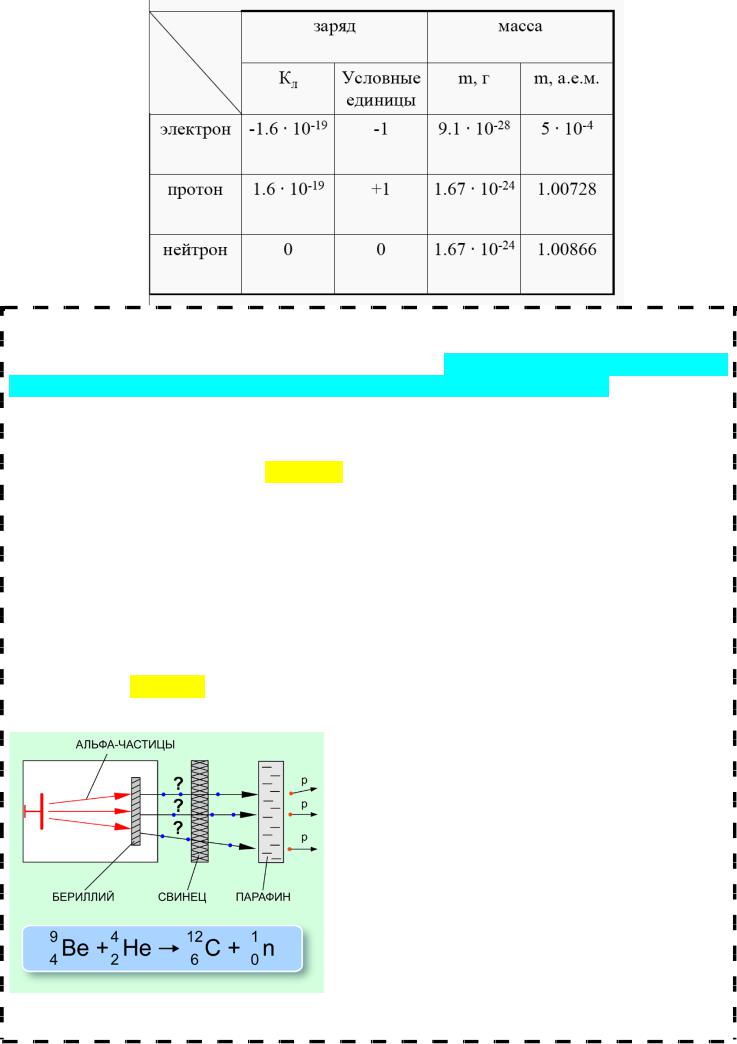
Открытие протона и нейтрона
В1913 г. Э. Резерфорд выдвинул гипотезу, что одной из частиц, входящих в ядро атома любого химического элемента должно быть ядро атома водорода, т.к. было известно, что массы атомов химических элементов превышают массу атома водорода в целое число раз. Резерфорд поставил опыт по исследованию взаимодействия альфа-частиц
сядрами атома азота. В результате взаимодействия из ядра атома азота вылетала частица, которую Резерфорд назвал протоном и предположил, что это ядро атома водорода. Позднее с помощью камеры Вильсона было доказано, что эта частица действительно является ядром атома водорода.
В1920 г. Резерфорд высказал предположение, что должна существовать частица массой, равной массе протона, но не имеющая электрического заряда. Однако, обнаружить такую частицу Резерфорду не удалось.
В1930 г. Виктор Амазаспович Амбарцумян и Дмитрий Дмитриевич Иваненко показали, что ядро не может, как считалось в то время, состоять из протонов и электронов, что электроны, вылетающие из ядра при бета-распаде, рождаются в момент распада, и что кроме протонов, в ядре должны присутствовать некие нейтральные частицы.
Открытие нейтрона (1932) принадлежит англ. физику Джеймсу Чедвику, за которое он получил Нобелевскую премию по физике в 1935 году.
В1930 г. Вальтер Боте и его студент Герберт Бекер, работавшие в Германии, обнаружи-
ли, что если высокоэнергетичные α-частицы, испускаемые 210Ро, попадают на некоторые лёгкие элементы, в особенности на Ве или Li, образуется излучение с необычно большой проникающей способностью. Сначала считалось, что это — γ-излучение, но выяснилось, что оно обладает гораздо большей проникающей способностью, чем все известные γ -лучи. Важный
вклад сделали в 1932 г. Ирен и Фредерик Жо- лио-Кюри. Они показали, что если это неизвестное излучение попадает на парафин или любое
другое соединение, богатое водородом, образуются протоны высоких энергий. Само по себе это ничему не противоречило, но численные результаты приводили к нестыковкам в
теории.
Позднее в том же 1932 г. английский физик Джеймс Чедвик провёл серию экспериментов, в которых он показал, что γ-лучевая гипотеза несостоятельна. Он предположил, что это излучение состоит из незаряженных частиц с массой, близкой к массе протона, и произвёл серию экспериментов, подтвердивших эту гипотезу. Эти незаряженные частицы были названы нейтронами от латинского корня neutral и обычного для частиц суффикса on (он). В том же 1932 г. Д. Д. Иваненко и затем В. Гейзенберг предположили, что атомное ядро состоит из протонов и нейтронов.
Всвободном состоянии нейтрон нестабилен – τ1/2=12 мин (n→p+e–+ν~).
Вработе химиков с понятиями «атомное ядро» и «атом» вводятся следующие сим-
волы:
Z – зарядовое число атома = число протонов в ядре = порядковый номер элемента в ПСЭ;
А – массовое число атома = суммарному числу протонов и нейтронов в ядре;
N – число нейтронов в ядре N = А–Z.
С учетом этих обозначений, конкретный атом элемента в записи представляется так: AZX, например, 199F.
Очень часто ядра атомов называют «нуклидами».
2.6. Изотопы, изобары, изотоны
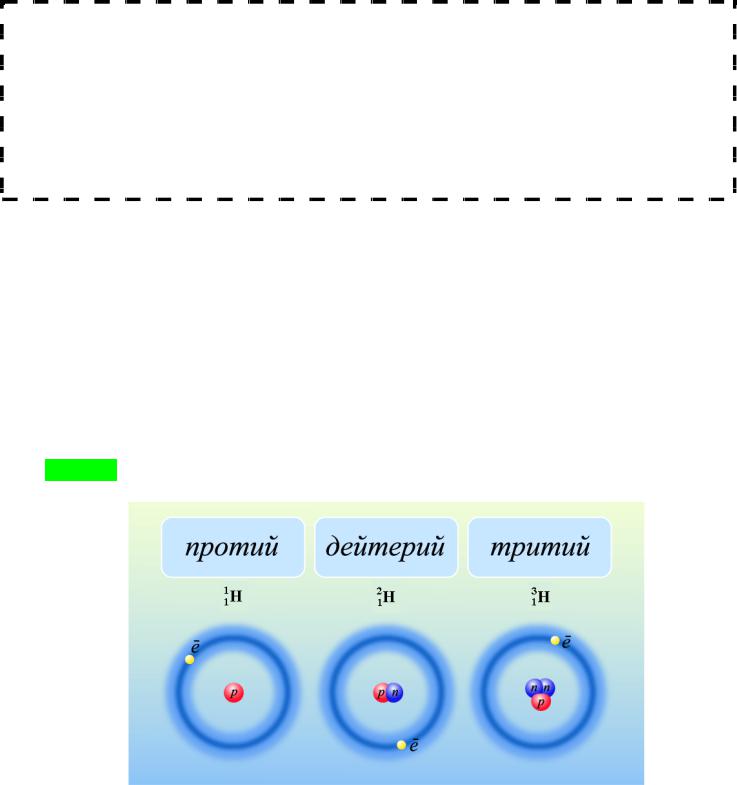
Изотопы – атомные ядра одного и того же элемента с различным числом нейтронов. Изотопы имеют одинаковое число Z, но различное N, а следовательно и А.
Изотопы атома водорода
Элементы, существующие в природе в виде одного единственного изотопа, называют монотопами (3115Р, 5927Со).
Относительные атомные массы атомов, приведенные в таблице Менделеева, являются средневзвешенным относительных атомных масс известных изотопов:
ω%1 ω%2 ω%3 Ar = ------·A1 + ------·A2 + ------·A3 100 100 100
ω%n – массовый процент n-го изотопа элемента, Аn – относительная атомная масса n-го изотопа элемента.
Изобары – атомные ядра различных элементов с одинаковым массовым числом А, но разным Z. Например, 104Ве, 105В, 106С.
Изотоны – атомные ядра различных элементов с одинаковым числом нейтронов N, но различными Z и A. Например, 146C, 157N, 168O.
2.7. Характеристики ядра
Радиус ядра может быть выражен следующей эмпирической формулой: R = R0A1/3,
где R0 = 1,3…1,5 фм. Следовательно, объем ядра пропорционален числу нуклонов в ядре.
Поскольку масса ядра также пропорциональна числу нуклонов, все ядра имеют приблизительно одинаковую плотность (1017 кг/м3). Фантастически высокая плотность по сравнению с плотностью атомов 103 кг/м3 является следствием того, что практически вся масса атома сконцентрирована в области, размеры которой составляют только приблизительно 10–5 от размеров атома.(Масса 1 мм3 ядерного вещества составляет 200000 т, что примерно равно массе заполненного нефтью супертанкера.
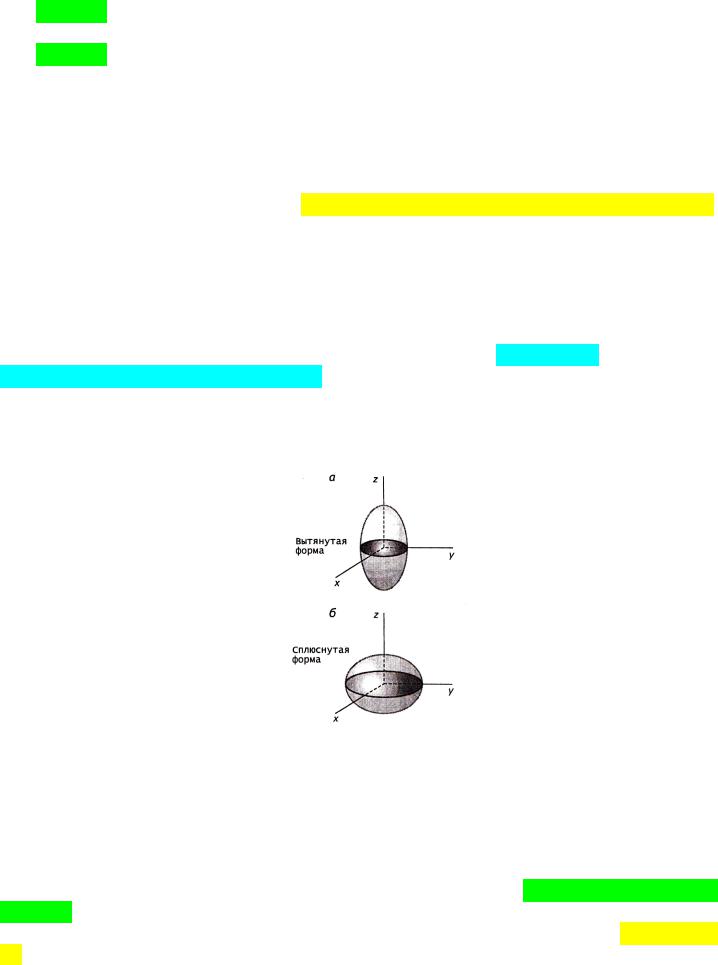
Форму атомных ядер в первом приближении считают сферической. Большинство несферических (эллипсоидальных) ядер у редкоземельных элементов (Z=57…71). У этих нуклидов волновые функции внутренних электронов проникают в ядра, и отклонение формы ядра от сферической с соответствующим распределением плотности заряда ядра проявляются в небольших изменениях энергии электронных уровней атома (искл. из правил Клечковского!).
Формы несферических ядер: а «дыни» и б «тыквы»
Атомное ядро обладает квантованным спином (комбинацией спинов нуклонов) и магнитным моментом (комбинацией магнитных моментов нуклонов), который почти в 2000 раз меньше магнитного момента электрона, вследствие чего магнитные свойства атома определяются в основном магнитными свойствами его электронов. Взаимодействие магнитного момента ядра с магнитным полем атомных электронов обусловливает дополнительное расщепление спектральных линий атомов – сверхтонкую структуру спектров. Спины отдельных нуклонов равны 1/2.
Масса атомного ядра меньше суммы масс составляющих его нуклонов. Дефект массы обусловлен выделением энергии системой нуклонов при их связывании в ядро.
Энергия связи ядра из Z протонов и N нейтронов:
Bяд = Zmpc2 + Nmnc2– MAc2 = Δmc2,
где mp – масса протона; mn – масса нейтрона; MA – масса атома и Δm – масса, эквивалентная энергии связи Bяд. Среднее значение В/А (энергия связи на один нуклон) примерно равна 8,3 МэВ/нуклон при А>16, что свидетельствует о насыщаемости ядерных сил, их короткодействии.
2.8. Радиоактивность
Среди более чем 3000 известных нуклидов только 266 стабильны в основном состоянии. Все остальные нестабильны, подвергаются радиоактивному распаду и превращаются в ядра других элементов.
Радиоактивность – способность некоторых атомных ядер самопроизвольно превращаться в другие ядра с испусканием различных частиц. Различают естественную радиоактивность (для неустойчивых природных изотопов) и искусственную (для синтезированных изотопов).
Энергия связи нуклонов в ядре уменьшается из-за кулоновского отталкивания между протонами, которое является дальнодействующим в отличие от ограниченного сильного ядерного взаимодействия. Для тяжелых ядер это имеет драматические последствия. Ядерные связи между нуклонами наиболее прочны, когда числа протонов Z и нейтронов N одинаковы, что и наблюдается у легких элементов, когда силы Кулона в ядре еще не играют особой роли. У тяжелых ядер для обеспечения устойчивости увеличено число N, «разбавляющих» протоны с их кулоновским отталкиванием. Ядра тяжелее свинца содержат уже столько протонов, что их полная стабильность становится невозможной.
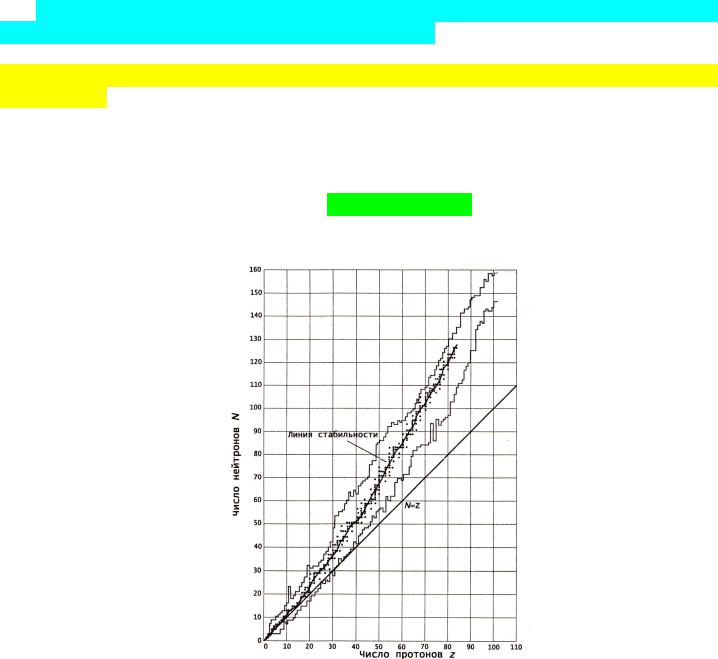
Наиболее устойчивы и распространены в природе ядра (нуклиды), у которых число протонов и нейтронов равно одному из магических чисел: 2, 8, 20, 28, 50, 82, 126. Если
магичны и число протонов и число нейтронов в ядре, оно является особенно устойчивым: 42He, 168O, 4020Ca, 20882Pb (объясняется в оболочечной модели ядра).
N=f(Z).
Стабильные изотопы указаны черными точками.
На площади, ограниченной ломаными линиями, расположены радиоактивные нуклиды. Сплошная линия, проведенная через точки, соответствующие стабильным нуклидам, называется линией стабильности.
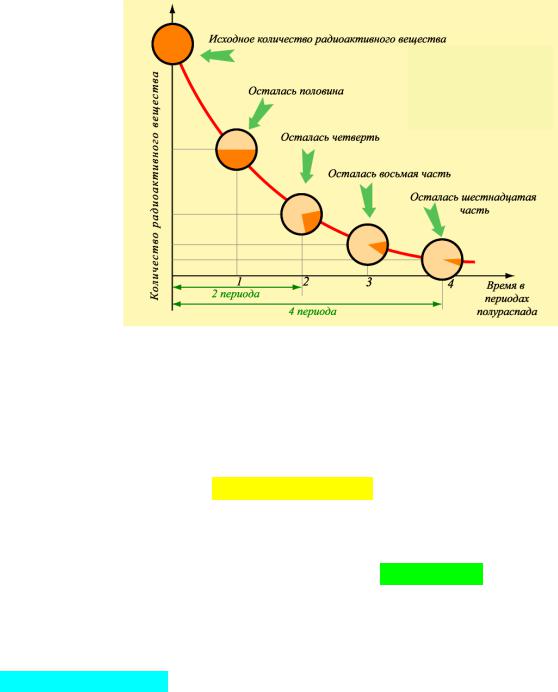
Скорость испускания радиоактивным веществом частиц не остается постоянной, а экспоненциально убывает во времени, что указывает на случайную природу процесса.
При распаде любого ядра, происходящем случайно, количество ядер, распавшихся за небольшой промежуток времени dt, пропорционально этому промежутку времени и числу имеющихся ядер. Если N(t) – число нераспавшихся ядер в момент времени t и –dN
– число ядер, распадающихся за время dt (знак минус необходим, т.к. число ядер уменьшается), то
–dN = λNdt,
где λ – константа, называемая постоянной распада. λ – вероятность распада любого ядра
в единицу времени. Решение этого уравнения имеет вид: N(t) = N0e–λt,
где N0 – число ядер в начальный момент (t = 0).
Число распадов в единицу времени называется активностью: R = –dN/dt = λN0e–λt = R0e–λt.
Число ядер и активность уменьшаются экспоненциально со временем. Среднее время жизни радиоактивного ядра обратно постоянной распада:
τ = 1/λ
Период полураспада τ1/2 определяется как время, за которое распадается половина
первоначального количества ядер:
τ1/2 = ln2/λ = (ln2)τ = 0,693/λ = 0,693τ.
За время, равное периоду полураспада, количество нераспавшихся ядер в образце и его активность уменьшаются наполовину от первоначального значения.
Единицей активности в СИ является беккерель (Бк), равный одному распаду в секунду.
1Бк = 1 распад/с.
Внесистемной часто используемой единицей активности служит кюри (Ки) (число
распадов в одном грамме радия в секунду):
1 Ки = 3,7·1010 распад/с = 3,7·1010 Бк.
Радиоактивные изотопы распадаются одним из, по крайней мере, девяти различных видов распада; но большинство из них – альфа, бета, гамма. Все распады подчиняются законам сохранения: 1) массы-энергии; 2) электрического заряда; 3) импульса; 4) углового момента; 5) числа нуклонов; 6) числа лептонов.
2.10. Модели ядра
Существует множество моделей атомного ядра, наиболее известны две.
Капельная модель. Создана в 1936 г. Н. Бором и Яковом Ильичом Френкелем. Базируется на аналогии в поведении нуклонов в ядре и молекул в капле жидкости. Ядро считается каплей электрически заряженной несжимаемой жидкости, которая подчиняется квантовым законам.
Модель позволила рассчитать энергию связи нуклонов в ядре, объяснила механизм ядерных реакций, но наличие магических ядер.
Оболочечная модель. Создана в 1940-1950 гг. польск. физиком Марией ГеппертМайер и нем. физиком Хансом Йенсеном.
По этой модели отдельные нуклоны движутся в усредненном поле окружающих нуклонов (самосогласованное поле). Состояние отдельного нуклона описывается квантовыми числами. Главному ядерному квантовому числу соответствует определенная оболочка ядра. Нуклоны распределены по ядерным уровням согласно принципу Паули и ядра с заполненными оболочками считаются наиболее устойчивыми (магические ядра).
Эта модель объяснила спины и магнитные моменты ядер, устойчивость магических ядер и др. факты, но не все, поэтому в нее до сих пор вносятся коррективы.
2.11. Периодическое изменение свойств химических элементов и их соединений
Периодичность свойств элементов нашла отражение в периодическом законе и периодической системе Д.И. Менделеева (1869 г.): химические свойства элементов и их соединений находятся в периодической зависимости от заряда их ядер (в современной формулировке).
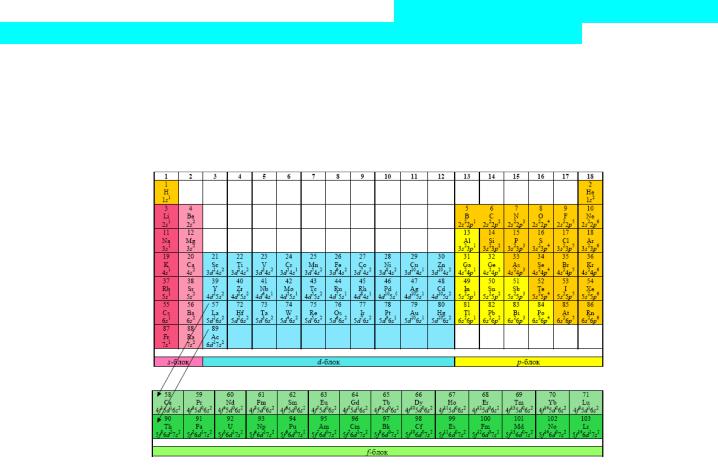
Существует несколько вариантов периодической системы: короткопериодный вариант, полудлиннопериодный и длиннопериодный. Распределение по группам производится в соответствии с количеством валентных электронов. По рекомендации ИЮПАК группы нумеруются арабскими цифрами от 1 до 18. В короткопериодном варианте группы делятся на главные и побочные.
Полудлиннопериодный вариант ПС
Горизонтально элементы делятся на периоды (большие и малые) и ряды (четные и нечетные). Все элементы таблицы Менделеева входят в одно из 4-х семейств. Принадлежность химического элемента к тому или иному семейству определяется по местоположению последнего электрона в атоме (с максимальной энергией), распределенного в
