
лекции для нехимиков-1
.pdf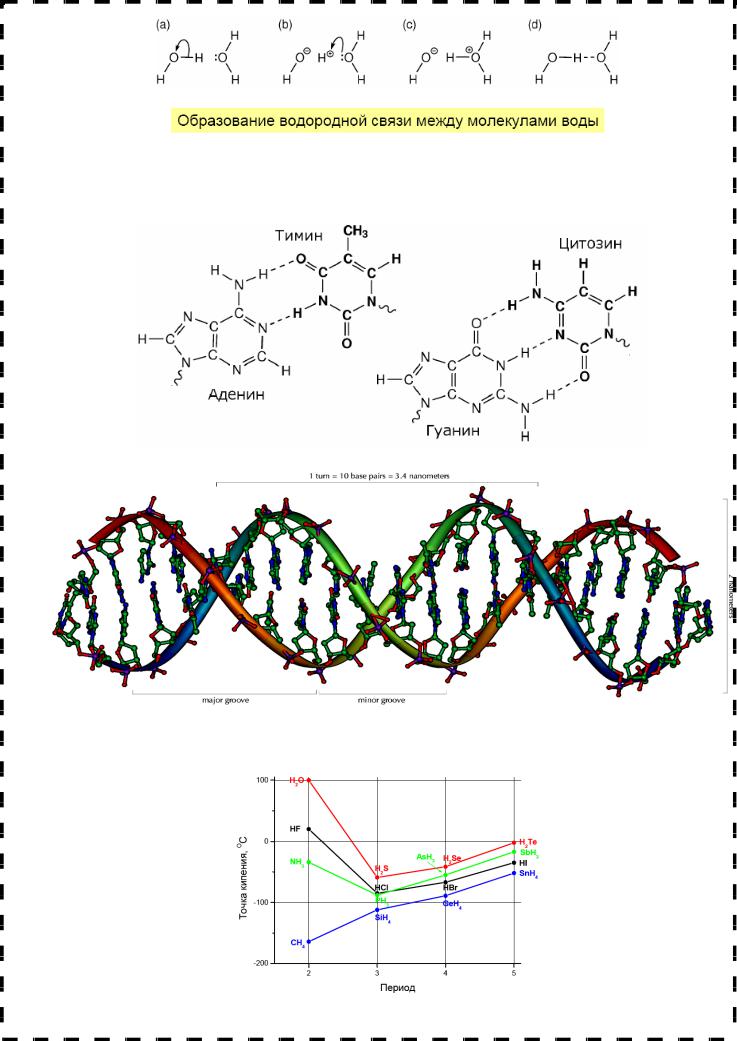
Энергия водородной связи на порядок меньше ковалентных связей и тем не менее она играет важную роль в строении молекул различных веществ, особенно органических (особая структура белков, молекулы ДНК)
Водородные связи между основаниями ДНК
и значительно изменяет физико-химические свойства веществ (например, повышает температуры плавления и кипения веществ), что видно из следующего графика.
Влияние наличия водородной связи на температуру кипения веществ

Силы взаимодействия между молекулами, которые называют ван-дер-ваальсовыми или межмолекулярными, обусловлены тремя видами взаимодействия: ориентационным, индукционным и дисперсионным.
Если молекулы полярны, происходит их электростатическое взаимодействие, называемое ориентационным эффектом. Если неполярны, то ориентационный эффект отсутствует, но под действием окружающих частиц (атомов, молекул, ионов) неполярные молекулы поляризуются (деформируются электронные оболочки) и в них возникают индуцированные (наведенные) дипольные моменты, что и обуславливает индукционный эффект. Дисперсионный эффект обусловлен возникновением и исчезновением мгновенных дипольных моментов в любых молекулах (флуктуациями электронной плотности по молекуле), поэтому он проявляется даже в системе состоящей исключительно из неполярных частиц, т.е. он универсален. Ван-дер-ваальсовы связи самые слабые из всех известных.
Межмолекулярное взаимодействие тем сильнее, чем больше полярность (разница в электроотрицательностях) и поляризуемость молекул (способность деформировать свое электронное облако под действием внешних электростатических взаимодействий).
С ростом относительных молярных масс силы межмолекулярного взаимодействия возрастают, т.к. увеличивается поляризуемость, и, как следствие, повышаются температуры плавления и кипения веществ.
