
Методичка Органическая химия
.pdfОборудование: круглодонная колба вместимостью 50 мл; обратный воздушный холодильник, делительная воронка, стакан на 100 мл, водяная баня, термометр; мешалка.
В круглодонной колбе смешивают 1 г фенола, 10 мл 25%-ного раствора гидроксида натрия и 2,4 г хлоруксусной кислоты. Осторожно, хлоруксусная
кислота вызывает ожоги кожи!
Смесь нагревают на кипящей водяной бане с воздушным обратным холодильником в течение 1 ч, а затем охлаждают 6 мл 10%-ной соляной кислоты до рН 3-5 и экстрагируют дважды эфиром порциями по 5 мл. Эфирные вытяжки осторожно смешивают в стакане с 10 мл раствора карбоната натрия. После прекращения выделения углекислого газа смесь встряхивают в делительной воронке. Эфирный слой отбрасывают, а водный медленно и осторожно при размешивании в стакане подкисляют концентрированной соляной кислотой до рН 3-5. Выпавшую феноксиуксусную кислоту отфильтровывают, промывают водой и высушивают на воздухе. Перекристаллизовывают из воды.
Определите выход полученного вещества, температуру плавления, растворимость и проведите ТСХ и сравните полученные результаты с теоретическими данными. Сделайте соответствующий вывод.
Феноксиуксусная кислота представляет собой бесцветные пластинки или иглы. Т. пл. 990С, плохо растворима в воде, хорошо – в этиловом спирте, диэтиловом эфире, бензоле, уксусной кислоте.
Хроматография: бумага типа «быстрая» или адсорбент: Sorbfil, элюент: изопропиловый спирт – раствор аммиака - вода (6:1:1). Проявление в сушильном шкафу при 140-1500С в течение 30 мин, в результате появляется желтое пятно. Rf=0.58.
Определяют выход полученного вещества, температуру плавления, растворимость и проводят ТСХ и сравнивают полученные результаты с теоретическими данными. Делают соответствующий вывод.
91

Использование реакций нуклеофильного замещения.
Реакции нуклеофильного замещения. Например, алкилгалогениды с
нуклеофилами реагируют по схеме:
R-H + Y- → R – Y + Hal-
R – Hal + HY: → R – Y+H + Hal- → R-Y + HHal
Нуклеофильное замещение представляет собой разрыв связи R – Hal и образование новой связи R – Y. Эти процессы могут идти или одновременно (синхронно) или последовательно (асинхронно).
Замещения галогена на алкоксильную группу: R-X + H – O - Alk → R - O – Alk + HX
Простой эфир Замещения галогена на нитро группу:
R-X + NaNO2 → R – NO2 + NaX
нитроалкан Замещения галогена на аминогруппу:
R-X + NaNH2 → R – NH2 + NaX
аминоалкан Замещения галогена на нитрильную группу:
R-X + NaC≡N → R – C≡N + NaX
алкилнитрил
Синхронный (SN2) механизм.
Замещения галогена на гидроксильную группу:
CH3 – CH2 – C*H – CH3 + NaOH → CH3 – CH2 – C*H – CH3 + NaCl
Cl |
OH |
втор - бутилхлорид |
втор – бутиловый спирт |
* - асимметричный атом углерода, то есть атом углерода с четырьмя разными заместителями.
Нуклеофил (ОН-) атакует асимметрический атом углерода субстрата с «тыла» по отношению к галогену (так легче подойти, отсутствует межатомное отталкивание от атома галогена). По мере приближения нуклеофила все три заместителя, отталкиваясь от него, «уходят» по другую сторону плоскости, проходящей через асимметрический атом углерода и перпендикулярной линии связи С-Hal. В переходном состоянии три заместителя оказываются в этой плоскости, а атом углерода, атакуемый нуклеофилом, переходит в sр2-гибридное состояние, его р - орбиталь перекрывается одновременно с атомными орбиталями кислорода и хлора. Максимальное перекрывание в этом случае возможно при расположении атомов О, С, О на прямой, перпендикулярной плоскости, в которой располагаются три заместителя. Формирование обычной двухэлектронной двухцентровой связи О - С продукта реакции приводит к перемещению трех заместителей по другую сторону плоскости, и таким образом продукт реакции
92
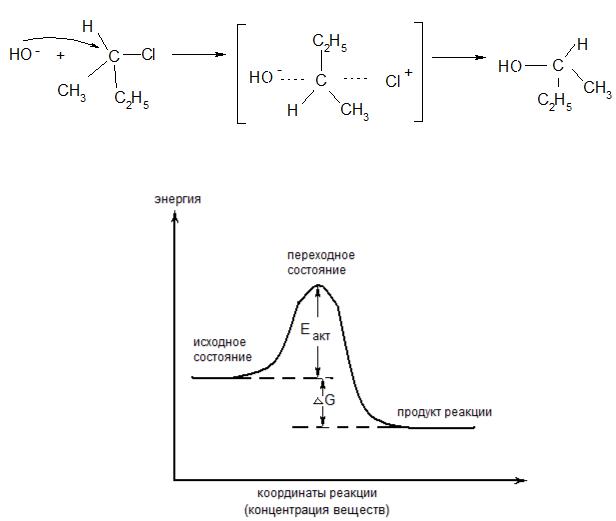
образуется в виде энантиомера, относящегося к противоположному по отношению к исходному соединению конфигурационному ряду. Происходит обращение конфигурации. Энергетический профиль SN2:
(R) – втор- |
(переходное состояние) |
(S) – втор - бутиловый |
бутилхлорид |
|
спирт |
Рис. 3.26 . Энергетический профиль реакции, протекающей по механизму SN2.
Еакт – энергия (энтальпия) активации; ∆G – энтальпия реакции.
Асинхронный (SN1) механизм. Согласно этому механизму реакция протекает в 2 стадии.
Первая стадия: диссоциация, которая протекает под действием полярного растворителя, характеризуется максимальной энергией активации, поэтому протекает с минимальной скоростью:
RX = [Rδ+ ·····Xδ-] = R+ + X- (лимитирующая)
Вторая стадия: образование новой связи RY R+ + Y- → RY
Данные процессы относят к мономолекулярным поскольку скорость такой химической реакции будет определяться концентрацией исходного соединения
RХ:
υx.p. = k [RX]
93
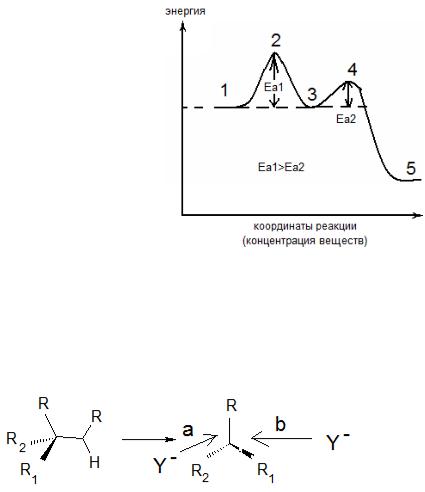
1 - RX
2 – разрыхление связи
RX [Rδ+ ·····Xδ-] 3 - R+ + X-
4 – образование связи RY R+ + Y- → [Rδ+ ·····Yδ-]
5 - → RY
Рис. 3.27. Энергетический профиль реакции, протекающей по механизму SN1.
Еа1 – энергия (энтальпия) активации первой стадии; Еа2 – энергия (энтальпия) активации второй стадии.
Cтереохимия данного процесса.
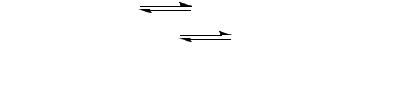
Атака нуклеофила может идти с двух сторон: а и b с равной вероятностью:
В случае а – происходит обращение конфигурации продукта относительно исходной конфигурации. В случае b – обращения конфигурации не происходит. Следовательно, продукт химических реакций, протекающих по механизму SN1 – рацемат (смесь двух оптических изомеров, имеющих разную конфигурацию).
Лабораторная работа №18 «Ацилирование»
Замена атома водорода аминоили гидроксигруппы остатком кислородсодержащей минеральной, карбоновой или сульфокислоты называется ацилированием.
В практике ацилирования наиболее широкое применение получили кислоты, среди которых особое значение имеет муравьиная, уксусная щавелевая, реже бензойная кислота. Чаще применяют уксусные и фталевые ангидриды, а из неорганических оксид серы (VI). Большое значение реакциях ацелирования приобрели галогенангидриды, в частности хлорангидриды, например, хлористый бензоил С6Н5СОСl и ряд его замещенных.
94
Практическая часть
Фениловый эфир бензойной кислоты
Реактивы: фенол, хлористый бензоил, гидроксид натрия, этиловый спирт. Оборудование: колба плоскодонная вместимостью 50, пробка, нутч-фильтр.
Фенол, попадая на кожу, может вызывать сильные ожоги! Работы с фенолом проводят в вытяжном шкафу!
В плоскодонной колбе готовят раствор 1 г едкого натрия в 10 мл воды и растворяют в нем 0,6 г фенола. Затем туда же добавляют 1-2 мл хлористого бензоила и колбу энергично встряхивают в течение 15-20 мин до исчезновения запаха хлористого бензоила. При встряхивании постепенно выпадают кристаллы фенилового эфира бензойной кислоты. Осадок отфильтровывают, промывают водой и сушат.
Перекристаллизацию ведут из этилового спирта, не доводя его до кипения. Т.
пл. 700С.
Определяют выход полученного вещества, температуру плавления, растворимость и сравнивают полученные результаты с теоретическими данными. Делают соответствующий вывод.
Использование реакций окисления и восстановления.
Лабораторная работа №19 «Окисление»
Процессы, сопровождающиеся отнятием от субстрата электронов, называют окислением. В этих реакциях окислителями являются соединения, обладающие большим сродством к электрону (электрофильностью), а субстратами – соединения, имеющие склонность к отдаче электронов (нуклеофильность).
Процессы окисления связаны либо с присоединением кислорода, либо с дегидрированием – отнятием водорода (точнее, двух электронов и двух протонов).
Наиболее распространенными окислителями являются вещества с сильно выраженными электрофильными свойствами: азотная кислота, кислород и пероксидные соединения (пероксид водорода, пероксиды металлов, неорганические и органические надкислоты), сера, бром, хлор. Кислородные кислоты галогенов и их соли. К эффективным окислителям относятся соединения металлов в высших степенях окисления: соединения железа (III), перманганат калия, диоксид марганца, хромовая кислота и ее ангидрид.
95
Практическая часть
|
|
Антрахинон |
|
|
|
|
O |
2CrO + 6CH COOH |
|
+ 4H2O + 2Cr(CH3COO)3 |
|
|
|||
3 |
3 |
|
|
O
Реактивы: антрацен, оксид хрома (VI), уксусная кислота (ледяная). Оборудование: колба двухгорлая вместимостью 50 мл; обратный холодильник, стакан на 100 мл, колба коническая на 100 мл.
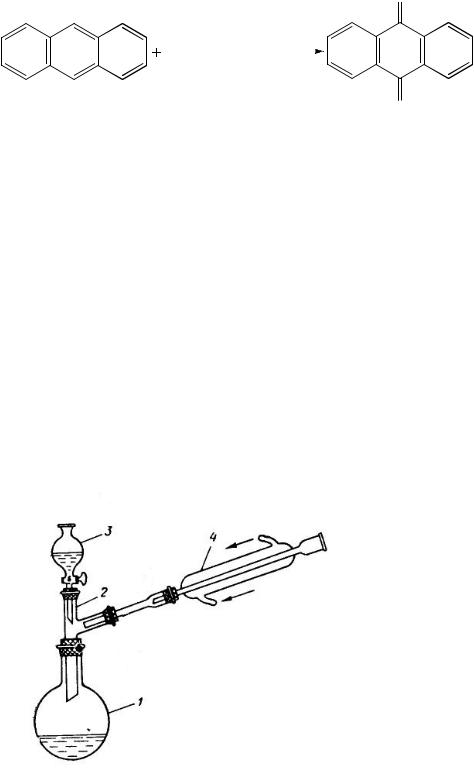
Собирают прибор (рис.3.28.). В двугорлой колбе, снабженной капельной воронкой и обратным холодильником (или в колбе снабженной двурогим форштосом) (рис. 29), растворяют при нагревании 0.32 г (0,0018 моль) антрацена в 12 мл ледяной уксусной кислоты. Содержимое доводят до легкого кипения и из капельной воронки медленно приливают окислительную смесь. Ее готовят заранее из 1 г (0,01 моль) оксида хрома (VI), 1 мл воды и 4 мл уксусной кислоты. После введения всего раствора окислителя, на что требуется приблизительно 1 ч, реакционную массу выдерживают при температуре кипения 15 мин (на окончание реакции указывает окрашивание массы в зеленый цвет). Смесь выливают в стакан с 6 мл воды и оставляют на ночь. Выпавший за это время осадок отфильтровывают, промывают водой и влажный перекристаллизовывают из ледяной уксусной кислоты.
Рис.3.28. |
Установка |
для |
|
окисления антрахинона. |
|
||
1 |
– реакционная колба; |
|
|
2 |
– двурогий форштос; |
|
|
3 |
– капельная воронка с |
|
|
окислительной смесью; |
|
||
4 – обратный холодильник |
Либиха. |
||
96

Антрахинон – кристаллическое вещество в виде светло-желтых ромбов, нерастворимых в воде, трудно растворим в спирте, эфире, хорошо – в анилине, горячем толуоле, концентрированной серной кислоте. Т. пл. 2860С. Хроматография: элюент: гексан – этилацетат (17:1). Rf=0.42.
Идентификации полученного соединения провести с помощью инфракрасной спектроскопии (см. раздел 3.5).
Определите выход полученного вещества, температуру плавления, растворимость и проведите ТСХ и сравните полученные результаты с теоретическими данными. Сделайте соответствующий вывод.
Бензойная кислота
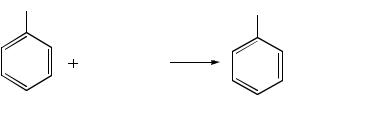
Реактивы: толуол, перманганат калия, соляная кислота.
Оборудование: круглодонная колба вместимостью 100 мл; обратный холодильник, стакан на 100 мл, песчаная баня, колба коническая на 100 мл.
В круглодонной колбе, снабженной обратным холодильником (рис. 3.29.), кипятят на песчаной бане в течение 3 ч 1,2 мл толуола с 40 мл воды и 3,4 г мелко растертого перманганата калия. Для равномерного кипения в колбу бросают несколько «кипелок». После завершения реакции раствор в колбе над осадком диоксида марганца должен быть бесцветным. Если реакционная смесь остается окрашенной, обесцвечивания достигают прибавлением 0,2 мл спирта или 0,1 г щавелевой кислоты при нагревании.
Горячий раствор фильтруют через складчатый фильтр, осадок диоксида марганца промывают небольшим количеством горячей воды. Фильтрат упаривают в стакане до объема 10-20 мл и отфильтровывают от вновь выпавшего оксида марганца (IV).
Рис.3.29. Установка для синтеза бензойной кислоты.
1 – реакционная колба;
2 - обратный холодильник.
3 – песчаная баня.
97
Промыв осадок 5 мл горячей воды, объединенный фильтрат подкисляют концентрированной соляной кислотой до кислой реакции по индикаторной бумаге. При этом осаждается бензойная кислота, которую отфильтровывают, промывают небольшим количеством холодной воды и сушат.
Бензойная кислота – белое кристаллическое вещество в виде пластинок, плохо растворяется в холодной воде, лучше – в горячей. Хорошо растворяется в хлороформе, ацетоне, бензоле. Т. пл. 1220С.
Хроматография: адсорбент: Sorbfil; элюент: петролейный эфир – этилацетат – ледяная уксусная кислота (17:2:1). Rf=0.2.
Определяют выход полученного вещества, температуру плавления, растворимость и проводят ТСХ и сравнивают полученные результаты с теоретическими данными. Сделайте соответствующий вывод.
Монокалиевая соль сахарной кислоты
Реактивы: глюкоза, 25%-ная азотная кислота, карбонат калия, уксусная кислота (ледяная); активированный уголь.
Оборудование: чашка фарфоровая, стакан на 50 мл – 2 шт., водяная баня.
В фарфоровой чашке смешивают 2 г глюкозы с 10 мл 25% раствора азотной кислоты и нагревают на слабо кипящей водяной бане, непрерывно помешивая жидкость стеклянной палочкой. Смесь выдерживают на водяной бане до прекращения выделения оксидов азота (признак завершения реакции окисления) и достижения содержимым консистенции сиропа желтовато-коричневого цвета. Затем к сиропообразной массе для растворения добавляют 1 мл воды. Нагревая на водяной бане, смесь нейтрализуют порошком карбоната калия до щелочной реакции по лакмусу. При этом получается хорошо растворимая средняя калиевая соль сахарной кислоты. Раствор охлаждают и при перемешивании стеклянной палочкой прибавляют по каплям ледяную уксусную кислоту до тех пор, пока раствор не станет пахнуть уксусной кислотой, это указывает на то, что вся средняя соль перешла в кислую. После чего раствор оставляют стоять на ночь. Выпавшие окрашенные кристаллы монокалиевой соли сахарной кислоты отфильтровывают, переносят в небольшой стакан, растворяют в возможно меньшем количестве воды, добавляют мелкий активированный уголь и кипятят 1- 3 минуты. Горячую смесь фильтруют через складчатый фильтр в маленькую колбу или стаканчик. При охлаждении образуются бесцветные кристаллы сахарнокислого калия. Их отделяют фильтрованием и сушат на воздухе.
Сахарная кислота растворима в воде, спирте, не растворима в эфире. Т.пл. 1250С (с разложением).
98
Определите выход полученного вещества, температуру плавления, растворимость и сравните полученные результаты с теоретическими данными. Сделайте соответствующий вывод.
Идентификацию полученного соединения проведите с помощью инфракрасной спектроскопии (см. пункт 3.5.).
Лабораторная работа №20 «Восстановление»
Реакции, состоящие в присоединении электронов атомами или ионами, т.е. сопровождающиеся понижением степени окисления, называют восстановлением.
Ворганической химии, однако, по традиции эти широко распространенные процессы связывают с присоединением водорода к молекуле органического соединения. Если присоединение водорода приводит к частичному или полному насыщению кратных связей, то такие реакции называют гидрированием, а удаление кислорода из органических молекул (элиминирование) – собственно
восстановлением.
Восстановление осуществляют различными по характеру веществами: водородом в присутствии катализаторов; действием металлов в присутствии соединений, содержащих подвижный атом водорода; электролитически; соединениями, способными изменять степень окисления одного из своих атомов.
Наиболее распространенным восстановителем является водород в момент выделения (атомарный водород), а также молекулярный водород в присутствии катализаторов (никель Ренея, платиновая чернь, палладий на угле и др.). Для восстановления карбонильных соединений используют гидриды металлов
(LiAlH4, NaBH4 и др.).
Группу восстановителей, содержащих серу в степени окисления -2 (H2S, Na2S, K2S, NaHS и др.) используют главным образом для восстановления в динитросоединениях одной из нитрогрупп.
Влабораторной практике чаще всего в качестве восстановителей применяют металлы (Zn, Sn, Fe) в кислой, щелочной и нейтральной средах.
Практическая часть
Фенилгидроксиламин
99
Реактивы: нитробензол, цинковая пыль, хлорид аммония, хлорид натрия. Оборудование: стакан фарфоровый вместимостью 500 мл, мешалка, баня водяная, термометр.
В фарфоровом стакане, снабженном мешалкой и термометром, помещают раствор 4,5 г хлорида аммония в 135 мл воды и 7,1 мл нитробензола. Смесь перемешивают и в течение 15 мин к ней добавляют 15,5 г цинковой пыли. Если цинковая пыль активная, температура самопроизвольно повышается до 60-650С. В противном случае реакционную массу нагревают до этой температуры на водяной бане. После добавления последней порции цинковой пыли содержимое стакана перемешивают еще 15 мин до окончания реакции, о чем судят по исчезновению запаха нитробензола и снижению температуры реакционной массы. Теплый раствор фильтруют, осадок промывают 20 мл горячей воды. Затем фильтрат насыщают 50 г хлорида натрия и охлаждают в смеси льда и соли. Фенилгидроксиламин выделяется в виде длинных светло-желтых игл, которые отфильтровывают и сушат на фильтровальной бумаге при температуре 40-500С.
Для очистки фенилгидроксиламина от содержащихся в нем примесей минеральных солей его перекристаллизовывают из бензола.
Фенилгидроксиламин – бесцветные иглы, т.пл. 820С (разл.), легко растворяется в эфире, спирте, хлороформе, горячем бензоле, умеренно растворяется в воде.
Хроматография: элюент: ацетон - петролейный эфир – бензол - метанол – водный раствор аммиака (концентрированный) (100:200:50:5:2). Проба в растворе ацетона. Rf=0.68.
Идентификации полученного соединения провести с помощью инфракрасной спектроскопии (см. раздел 3.5)
Список рекомендуемой литературы к разделу «Методы синтеза органических соединений»
1.Гиттис С.С., Глаз А.И., Иванов А.В. Практикум по органической химии. Органический синтез. – М.: Высшая школа, 1991.
2.Гинзбург О.Ф. Практикум по органической химии. Синтез и идентификация органических соединений. - М.: Высшая школа, 1989.
3.Травень В.Ф. Органическая химия. В 2 т. – М.: Изд. Академкнига, 2001.
4.Реутов О.А., Курц А.Л., Бутин К.П. Органическая химия. – М.: Изд. Московского университета, 1992.
5.Грандберг И.И. Органическая химия. –М.: Дрофа, 2002.
100
