
Volova_-_Biotekhnologia
.pdfны) подавляют процессы образования клеточных стенок; другие (стрептомицин, полимиксины) изменяют проницаемость мембран; третьи (грамицидины) подавляют окислительное фосфорилирование; хлорамфеникол подавляет отдельные этапы синтеза белка на рибосомах; азасерин и сарколизин – вызывают нарушения в процессах синтеза нуклеиновых кислот и т.д.
Существует несколько подходов в классификации антибиотиков: по типу продуцента, строению, характеру действия. По химическому строению различают антибиотики ациклического, алициклического строения, хиноны, полипептиды и др. По спектру биологического действия антибиотики можно подразделить на несколько групп:
–антибактериальные, обладающие сравнительно узким спектром действия (пенициллин, эритромицин, грамицидин, бацитрацин), подавляют развитие грамположительных микроорганизмов (стафилококки, стрептококки, пневмококки), и широкого спектра действия (стрептомицин, тетрациклины, неомицин, хлоромицетин), подавляющие как грамположительных, так и грамотрицительных микроорганизмов (кишечную палочку, дифтерии, брюшного тифа);
–противогрибковые, группа полиеновых антибиотиков (нистатин, гризеофульвин и др.), действующие на микроскопические грибы;
–противоопухолевые (актиномицины, митомицин и др.), действующие на опухолевые клетки человека и животных, а также на микроорганизмы.
В настоящее время описано свыше 6000 антибиотиков, но на практике применяется только около 150, так как многие обладают высокой токсичностью для человека, другие – инактивируются в организме и пр.
Антибиотики широко применяются в различных сферах человеческой деятельности: медицине, пищевой и консервной промышленности, сельском хозяйстве. Открытие антибиотиков вызвало переворот в медицине. Широко известно применение антибиотиков с бактерицидным и бактериостатическим действием; благодаря антибиотикам стали излечимыми многие инфекционные заболевания (чума, туберкулез, пневмония, брюшной тиф, холера и т.д.). В течение многих лет антибиотики применяют в сельском хозяйстве в качестве стимуляторов роста сельскохозяйственных животных, средств борьбы с болезнями животных и растений. Антибиотические вещества также широко применяют для борьбы с посторонней микрофлорой в ряде бродильных производств и в консервной промышленности. Однако нельзя не отметить, что длительное и неконтролируемое применение антибиотиков приводит к возникновению и широкому распространению в микробных популяциях R-фактора устойчивости к антибиотикам, передающегося от одной бактериальной клетки к другой при помощи плазмид в процессе коньюгации. Средствами борьбы с проявлением лекарственной устойчивости к антибиотикам является обоснованное
истрого контролируемое их применение и получение новых, модифици-
90
рованных антибиотических препаратов, обладающих биологической активностью к резистентным формам.
Способность синтезировать антибиотики широко распространена среди различных представителей микробного мира. Связи между таксономическим положением микроорганизмов и способностью синтезировать тот или иной антибиотик нет. Так, микроорганизмы, принадлежащие к одной группе, способны синтезировать самые разнообразные по химическому строению и действию антибиотики, и один и тот же антибиотик может продуцироваться различными микроорганизмами. Продуцентами антибиотиков являются бактерии, актиномицеты, мицелиальные грибы.
Описано около 600 антибиотиков, которые синтезируются бактериями. Эти антибиотики по химическому строению принадлежат к полипептидам
инизкомолекулярным белкам. Однако в промышленных масштабах выпускается незначительное число антибиотиков бактериального происхождения. Важнейшими их них являются: грамицидин (Bacillus brevis), поли-
миксины (Bac. polymyxa, Bac. circulans), бацитрацины (Bacillus licheniformis), низины (Streptococcus lactis).
Самое большое количество (свыше 70 %) антибиотиков, выпускаемых промышленностью и широко применяемых, синтезируется актиномицетами. Среди них – антибиотики различного химического строения, которые относят к нескольким группам: а) аминогликозиды – стрептомицин
(Streptomyces griseus), неомицины (Streptomyces fradiae, Str. albogriseolus), канамицины (Str. kanamyceticus), гентамицины (Micromonospora purpurea)
идр.; б) тетрациклины – хлортетрациклин (Str. aureofaciens), окситетрациклин (Str. rimosus); в) актиномицины – большая группа близких по строению препаратов, синтезируемых различными микроорганизмами, в
том числе (Streptomyces antibioticus, Str. chrysomallus, Str. flavus); г) мак-
ролиды – эритромицин (Streptomyces erythreus), олеандоимицин (Str. antibioticus), магнамицин (Str. halstedii), филипин (Str. filipensis); д) анза-
мицины – стрептоварицины (Str. spectabilis), рифамицины (Nocardia mediterranea), галамицины (Micromonospora halophytica), нафтамицин (Str. collinus) и др.
Мицелиальные грибы также синтезируют достаточно большое количество антибиотиков (около 1200). Наиболее известны среди них следую-
щие: пенициллины (Penicillium chrysogenum, P. brevicompactum, Aspergillus flavus, Asp. nidulans), цефалоспорины (Cephalosporium acremonium), фумалгин (Aspergillus fumigatus), гризеофульвин (Penicillium nigricans, P. griseofulvum), трихоцетин (Trichthecium roseum).
Синтез антибиотиков микробными клетками – это специфический процесс обмена веществ, возникший и закрепленный в процессе эволюции организма. Каждый микробный вид способен образовывать один или несколько вполне определенных антибиотических веществ. Выделенные из природных источников, так называемые «дикие» штаммы обладают низ-
91
кой антибиотической активностью. В промышленности применяют в качестве продуцентов штаммы, которые по сравнению с исходными штаммами обладают повышенной на 2–3 порядка антибиотической активностью. Это достигается, как и во многих других биотехнологических процессах, двумя способами: генетическими усовершенствованиями организмов и оптимизацией условий ферментации.
Антибиотики – это вторичные продукты обмена микроорганиз-
мов, (идиолиты). Характерной особенностью развития продуцентов антибиотических веществ является ярко выраженная двухфазность: в первой фазе развития микроорганизмов происходит накопление биомассы, во второй – синтез антибиотика. При этом очень важно создать условия ферментации, адекватные этой двухфазности с учетом ингибирующего действия антибиотика как продукта обмена на продуцент.
Нельзя не отметить, что создание промышленности антибиотиков является крупнейшим достижением биологии нашего столетия. Организация этого производства потребовала коренных преобразований существующей микробиологической промышленности: при этом были решены вопросы обеспечения строжайших условий стерильности в ходе всех стадий биотехнологического процесса, разработаны и созданы эффективная аппаратура с высокими газо-динамическими характеристиками, средства борьбы с сильным пенообразованием, методывполучения стерильных препаратов антибиотиков высокой степени чистоты. Распространение этих достижений и применение их в других, сложившихся биотехнологических процессах, основанных на жизнедеятельности микроорганизмов, сыграло решающую роль в становлении современной биотехнологии в целом.
В процессах производства антибиотиков очень большое значение имеет правильный выбор состава питательной среды. В зависимости от природы используемого микроорганизма в качестве источника углерода возможно применение различных субстратов. Например, для получения пенициллина лучшим источником углерода и энергии является глюкоза и лактоза; грамицидина – глицерин и соли янтарной кислоты; стрептомицина и неомицина – глюкоза. При разработке состава среды для каждого отдельного продуцента индивидуально подбирают не только тип углеродного субстрата, но и его концентрацию. В качестве источника азота многие продуценты антибиотиков используют восстановленные формы (аммоний и аминокислоты), однако некоторые предпочитают нитраты. Когда источник азота должен присутствовать в виде готовых аминокислот, полипептидов или белков, используют пшеничную и кукурузную муку, экстракты дрожжевой биомассы. Большое значение имеет также концентрация в среде фосфора, а также других минеральных элементов (серы, марганца, железа, кобальта и др.). В ряде случаев существенного увеличения выхода антибиотического вещества достигают в результате внесения в среду предшественников синтеза конкретного антибиотика. В связи c ин-
92
тенсивным пенообразованием, сопровождающим процесс синтеза антибиотиков, в состав среды вводят пеногасители (растительные и животные жиры, минеральные масла).
Помимо состава среды, большое влияние на выход антибиотиков оказывают другие физико-химические факторы среды: рН, температура, обеспечение кислородом, которые подбираются и задаются индивидуально для каждого продуцента.
На предферментационной стадии получают инокулят из музейной культуры и готовят питательную среду. После стерилизации технологического оборудования и среды в ферментер вносят требуемое количество инокулята и начинают процесс ферментации. В промышленности используют аппараты различной емкости, от 500 л до 100 м3 и более. В ходе ферментации культура непрерывно аэрируется стерильным подогретым воздухом. Температура среды, рН и ряд других параметров автоматически регулируются в соответствии с регламентом производства конкретного антибиотика.
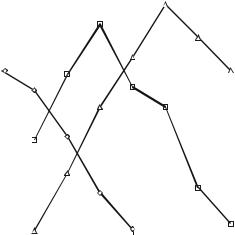
Процесс ферментации осуществляется в строго стерильной, глубинной, аэробной и периодической культуре и носит выраженный двухфазный характер (рис. 2.6). Первая фаза сбалансированного роста (тропофаза) характеризуется быстрым накоплением биомассы продуцента на фоне исчерпания углеродного субстрата, а также азота, фосфатов и др.
мг/100 мл
|
|
Фаза I |
|
Фаза II |
|
|
|
|
|
|
|
|
||||||||
600 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
500 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
400 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
300 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
200 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
100 |
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
2 |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
2 |
4 |
|
|
6 |
8 |
|
||||||||||||||
время, сут
Рис. 2.6. Процесс развития Streptomyces fradiae 3535 и образования неомицина (по Ваксману, 1953).
1 – глюкоза, 2 – мицелий, 3 – неомицин.
93
При этом может наблюдаться некоторое изменение величины рН; синтез антибиотиков не наблюдается или имеет место в незначительных количествах. На второй фазе (идио-фаза) прирост биомассы прекращается, и может иметь место некоторое падение концентрации клеток в культуре в результате гибели и лизиса некоторой части популяции. При этом среда обогащается продуктами обмена и продуктами автолиза погибших клеток,
иначинается активный процесс синтеза антибиотиков. Исключительно важным на этом этапе становится правильно организованный режим пеногашения. Наряду с пеногасителями химической природы, дополнительно применяют механическое пеногашение с использованием специальных устройств. В большинстве случаев антибиотики выделяются в культуральную среду, хотя возможно и сохранение их внутри клеток. Локализация антибиотика, а также сфера применения последнего определяют специфику приемов постферментационной стадии. Если антибиотик находится в клетках, на первом этапе обработки биомассу выделяют из культуральной жидкости (фильтрацией или центрифугированием); далее после разрушения клеток антибиотик экстрагируют и переводят в растворимую фазу. Затем данный раствор, а также культуральные среды, (если антибиотик в процессе идио-фазы выделяется из клеток в среду) подвергают различным методам экстракции, разделения, очистки и концентрирования для получения готового продукта. Особенность процедуры выделения и очистки антибиотиков – разбавленные исходные растворы (около 1 %) и возможность инактивации антибиотика в ходе постферментационной стадии. Цель всех процедур постферментационной стадии – получение стерильных препаратов высокой степени чистоты. Особенно высокие требования предъявляют к антибиотикам медицинского назначения. Поэтому выделение, очистка, концентрирование, высушивание, а также расфасовка
иупаковка медицинских антибиотиков осуществляются в асептических условиях. Готовый продукт подвергается тщательному биологическому и фармакологическому контролю. Биологический контроль определяет степень стерильности препарата. В ходе фармакологического контроля проводят всесторонние испытания препарата на токсичность, пирогенность, токсикогенность и пр., устанавливают максимально переносимую дозу антибиотика, дозы, вызывающие полную и 50 % гибель экспериментальных животных. Готовая форма лекарственного препарата антибиотического вещества поступает к потребителю с указанием биологической активности и даты выпуска.
Антибиотики немедицинского назначения, применяемые в сельском хозяйстве, получают также в условиях строго стерильной регламентированной культуры, однако готовый продукт представляет собой высушенную биомассу продуцента или культуральную среду. В таком препарате, помимо антибиотика, содержатся также другие биологически активные вещества (витамины группы В, ферменты, витамины, аминокислоты).
94
Наиболее известны среди применяемых в качестве кормовых антибиотических препаратов – биовит и биомицин, являющиеся препаратами хлортетрациклина, а также гризин, бацитрацин, гигромицин и др. Подавляя развитие болезнетворных микроорганизмов, тем самым снижая заболеваемость и смертность, антибиотики ускоряют рост и развитие животных и птицы. Так, применение антибиотиков в свиноводстве обеспечивает дополнительный привес от каждой тысячи животных до 120 ц при сокращении расхода кормов на 5–10 %. При добавлении антибиотиков в корм курнесушек можно дополнительно получить до 15 тыс. яиц в год от 1000 кур. В течение последних 25 лет антибиотики применяют также для борьбы с фитопатогенами, возбудителями которых являются микроорганизмы. Антибиотические вещества наносят на вегетативные части растения, а также на семена или вносят в почву. В результате селективного действия на фитопатогенные микроорганизмы антибиотики задерживают рост или убивают микроорганизмы-возбудители, не нанося вреда растению. Наиболее эффективными фитопатогенными препаратами являются трихотецин, полимицин, фитобактериомицин, гризеофульвин.
Поиск продуцентов новых антибиотиков непрерывно продолжается. Огромные перспективы для получения высокопродуктивных штаммов открываются в связи с развитием новейших методов клеточной и генетической инженерии. Помимо усовершенствования природы микроорганиз- мов-продуцентов антибиотических веществ, оптимизации аппаратуры и технологий, большое значения для получения нового спектра препаратов, обладающих более ценными свойствами по сравнению с исходными, имеет так называемая модификация антибиотиков и получение полусинтетических препаратов. Полученные микробиологическим путем антибиотики подвергают химической модификации, в результате которой возможно получение препаратов с более выраженным физиологическим действием.
95

Глава 3. ИНЖЕНЕРНАЯ ЭНЗИМОЛОГИЯ
В конце 60-х – начале 70-х гг. на базе технической биохимии, химической технологии, химической энзимологии и ряда инженерных дисциплин возникло новое научно-техническое направление биотехнологии – инженерная энзимология, к которой относят систему методов получения, очистки, стабилизации и применения ферментов. Основной задачей инженерной энзимологии является конструирование биоорганических катализаторов с заданными свойствами на основе ферментов или ферментных комплексов и разработка на их базе различных эффективных и экологически чистых биотехнологических процессов. Высокая субстратная специфичность ферментативного катализа и уникальная способность ускорять реакции в десятки и сотни раз в условиях нормального давления и физиологических температур позволяют получать высокие выходы продуктов и создавать практически безотходные биотехнологические процессы, не загрязняющие окружающую среду.
Эффективные биотехнологические процессы на основе ферментативного катализа используются все шире в различных сферах человеческой деятельности: пищевой промышленности, энергетике, медицине, биоэлектрокатализе и микроэлектронике.
3.1. ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ ФЕРМЕНТОВ
Ферменты – это специфические катализаторы белковой природы, вырабатываемые клетками и тканями организмов. Они способны во много раз ускорять течение химических и биохимических реакций, не входя в состав конечных продуктов. Практические применения ферментов основаны на их высокой каталитической активности и более высокой по сравнению с небиологическими каталитическими системами субстратной специфичностью. Источником ферментов служат растительные и животные ткани, микроорганизмы. Химический синтез ферментов в промышленных масштабах очень сложен, дорог и экономически не целесообразен. Микробиологический метод получения ферментов – наиболее перспективен. Его преимущества заключаются в следующем: 1) богатство ассортимента ферментов, синтезируемых микроорганизмами, 2) возможность управления ферментативными системами и составом производимых препаратов, 3) высокие скорости размножения микроорганизмов и возможность использования различных, в том числе доступных и недорогих субстратов. Ферменты в микробных клетках могут иметь как внутриклеточную локализацию, так и выделяться в окружающую среду. Последние более доступны для препаративного получения, поэтому в промышленных масштабах получают главным образом внеклеточные ферменты. Из описанных к настоящему времени более 2000 ферментов практическое значение имеют около 50.
96
Согласно современной классификации, все ферменты подразделяются на 6 классов: оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы и линазы (синтетазы).
Негидролитические ферменты – оксидоредуктазы, лиазы, изомеразы и лигазы применяются сравнительно редко. Наиболее широкое применение получили микробные гидролазы, взаимодействующие с пептидами, гликозидами и другими соединениями с участием воды. Среди гидролаз – гликозидазы, протеиназы, липазы.
Гликозидазы катализируют гидролиз гликозидных соединений. Так, крахмал гидролизуют амилазы, продуцентами которых являются различные микроорганизмы (Bacillus, Aspergillus); декстраназа, взаимодействующая с гликозидными связями декстрана, синтезируется Penicillium purpurogenium; пуллоназа, гидролизующая пуллан, гликоген, декстрины, продуцируется бактериями Klebsiella; инвертаза синтезируется многими представителями рода Aspergillus; целлюлолитические ферменты, являющиеся сложным комплексом активных белков, воздействуют на различные участки молекулы целлюлозы. Фитопатогенные грибы Fusarium oxysporum, Erwinia образуют пектинолитические ферменты; анаэробные бактерии Clostridium felsineum продуцируют полигалактуроназу, пектинэстеразу. Очень разнообразны протеиназы, катализирующие разрыв пептидных связей белков с образованием пептидов и свободных аминокислот. Протеиназы различных микроорганизмов существенно различаются своими свойствами; среди продуцентов протеиназ – Aspergillus, Actinomyces, Clostridium, E.coli. Продуцентами липаз, осуществляющих гидролиз триацилглицеролов с образованием жирных кислот и глицерина, являются различные микроорганизмы (Aspergillus, Mucor, Rhizopus, Geotrichum, Candida). Фосфокиназы, синтезируемые бактериями Clostridium, Bacillus, расщепляют сложные связи между жирными кислотами, глицерином и фосфатидной кислотой.
История применения ферментов уходит корнями в далекое прошлое. Некоторые ферменты, содержащиеся в природных растительных материалах, издавна использовались человеком для получения пива, спиртных напитков, производства хлеба и кисломолочных продуктов. Практика, основанная на коллективном опыте людей, намного опередила получение знаний и разработку научных основ для создания данных технологических процессов. Промышленная отрасль получения ферментных препаратов из природного растительного сырья стала зарождаться только в конце XIX столетия, а эра современной инженерной энзимологии насчитывает около 30 лет. Тем не менее, ферменты настолько широко вошли в нашу жизнь и настолько широко применяются в различных промышленных отраслях, что представить без них наше существование сегодня не представляется возможным. Промышленное получение и применение фермен-
97
тов в различных технологических процессах составляет в настоящее время один из важнейших разделов новейшей биотехнологии.
Огромное значение ферменты имеют в различных отраслях пищевой промышленности. В хлебопечении амилазы ускоряют процесс созревания и улучшают качество теста; их используют также для получения растворимого крахмала, патоки, декстрина. Грибные амилазы заменяют солод, лактазу используют для удаления молочного сахара из молока; инвертазы сахаров, предупреждающие кристаллизацию сахарозы, применяют в кондитерской промышленности. Комплекс ферментов – цитаз, используют для более полной экстракции соков из плодов и овощей, а также получения эфирных масел. Грибные глюкозидазы, освобождая продукты от остаточных сахаров, удлиняют сроки их хранения. С помощью каталазы из продуктов удаляют перекиси водорода, целлюлазы применяют для осахаривания крахмала из картофеля и зерна, а также увеличения выхода агарагара из водорослей. Протеолитические ферменты микробного происхождения заменяют реннин в сыроделии. Липазы находят применение в производстве сухого молока и для ускорения созревания сыров.
Пектинолитические ферменты издавна применяются для обработки льносоломы и получения из нее волокна. Амилолитические ферменты используют для удаления клея из тканей (расшлифовка); некоторые протеиназы применяют для удаления серицина и высвобождения шелковых волокон из шелка-сырца; для обезжиривания волокон используют липазы. В кожевенной промышленности при помощи протеолитических ферментов производят обезволашивание шкур и мягчение голья, ускоряют также процессы получения высококачественной шерсти. Ферментные препараты применяют в сельском хозяйстве при производстве кормов. Пектиназы и гемицеллюлазы повышают доступность и усвояемость кормов, ускоряют процессы силосования трудно- и несилосующихся зеленых кормов.
Все большее применение ферменты находят в тонком органическом синтезе в процессах получения различных сложных соединений (аминокислот, пептидов, нуклеотидов, полусинтетических антибиотиков), а также в медицине. Ряд ферментов применяют в так называемой «заместительной терапии» для восполнения имеющегося ферментативного дефицита. Так, препараты протеиназ используют для удаления некротических тканей в ходе лечения гнойных ран и ожогов. Бактериальную аспарагиназу, расщепляющую аспарагин, необходимый лейкозным клеткам, применяют при ряде злокачественных заболеваний. Препараты протеиназ (террилин и стрептокиназа) обладают тромболитическим действием и применяются для борьбы с тромбозами. Холестеринэстераза гидролизует холестерин, локализованный на внутренних стенках кровеносных сосудов. Особое место занимают высокоочищенные ферменты, используемые в аналитике, микроанализе, биоэлектрокатализе.
98
Таким образом, объемы и спектр выпускаемых ферментов, а также области их применения расширяются с каждым годом.
Микроорганизмы, являющиеся источником для получения разнообразных ферментов, существенно различаются между собой по способности синтезировать данные биологически активные соединения. Эти различия проявляются как в ассортименте синтезируемых ферментов тем или иным микробным видом, так и в их активности и исходных свойствах. Ферменты – вещества белковой природы, поэтому в смеси с другими белками определить их не представляется возможным. Наличие фермента устанавливают по протеканию той реакции, которую катализирует фермент; количественное определение фермента проводят по величине образовавшегося продукта реакции либо по расходу исходного субстрата. Принята так называемая стандартная единица активности (E или U) – это количество фермента, которое катализирует превращение 1 микромоля субстрата в минуту при заданных стандартных условиях.
Выбор продуцента необходимого фермента сопряжен с проверкой активности огромного количества культур, приводящей к отбору наиболее активного продуцента. Природные штаммы обычно не синтезируют ферменты в избыточных количествах, так как процесс их синтеза находится под строгим генетическим контролем. Исключение составляют конститутивные ферменты, например ферменты гексозомонофосфатного пути, которые синтезируются в больших количествах в любых условиях роста. Наряду с отбором наиболее активных штаммов-продуцентов ферментов из микробных коллекций или выделенных из природных источников, продуцирующих конститутивные ферменты, широко используют индуцибельные и репрессибельные ферменты, которые синтезируются клетками в результате изменения условий ферментации или генетического аппарата клетки. К индуцибельным относятся многие ферменты, имеющие коммерческую ценность.
Индукция – это универсальный контроль для катаболических путей. Процесс ферментации с целью получения индуцибельных ферментов ведут в присутствии субстрата-индуктора. Так, для получения амилаз в среду вносят крахмал, рибонуклеазы – РНК, липаз – жиры, инвертазы – сахарозу и т.д. В результате способности синтезироваться индуцированно в ответ на заданный субстрат, возможно использование одной культуры для получения различных ферментов (табл. 3.1). Это свойство широко используется в промышленности для получения различных ферментов.
Репрессии синтеза фермента конечным продуктом можно избежать, не допуская накопления последнего. При выращивании ауксотрофных штаммов на средах с дефицитом факторов роста накопления конечного продукта не происходит, и фермент дерепрессируется. В результате этого активность целевого фермента удается повысить многократно (табл. 3.2). Дерепрессии синтеза ферментов можно добиться, выращивая частичный аук-
99
