
- •Тема 1. Второй закон термодинамики.
- •94. Определите изменение энтропии для реакции
- •Решение.
- •Решение.
- •121. Рассчитайте давления, при которых графит и алмаз находятся в равновесии для интервала температур 298—4000 к. При расчете используйте следующие данные для равновесия с (графит) с (алмаз):
- •Решение.
- •Решение.
- •Многовариантные задачи
- •Решение.
- •Тема 2. Характеристические функции
- •Решение:
- •Решение.
- •Решение.
- •Решение.
Решение:
10.
Mr(CCl4)=154 г/моль
m(CCl4)=1∙154=154 г
V= =
=
ΔG=V(P2-P1)=94,305(10,13∙105-1,013∙105)∙10-6=85,98 Дж
Ответ: 85,98 Дж
11.
Mr(C6H5NH2)=93 г/моль
m(C6H5NH2)=1∙93=93 г
V= =
=
ΔG=V(P2-P1)=89,509(4,05∙105-0,506∙105)∙10-6=31,72 Дж
Ответ:31,72 Дж
12.
Mr(C6H5NH2)=123 г/моль
m(C6H5NO2)=1∙123=123 г
V= =
=
ΔG=V(P2-P1)=100,57(6,078∙105-1,013∙105)∙10-6=50,94 Дж
Ответ: 50,94 Дж
13.
Mr(C6H5Cl)=112,5 г/моль
m(C6H5NH2)=1∙112,5=112,5 г
V= =
=
ΔG=V(P2-P1)=99,7340 (9,72∙105-1,216∙105)∙10-6=84,81 Дж
Ответ: 84,81 Дж
14.
Mr(CHCl3)=119,38 г/моль
m(CHCl3)=1∙119,38=119,38 г
V= =
=
ΔG=V(P2-P1)=78,23 (8,10∙105-1,013∙105)∙10-6=7,087 Дж
Ответ: 7,087 Дж
15.
Mr(C6H6)=78 г/моль
m(C6H6)=1∙78=78 г
V= =
=
ΔG=V(P2-P1)=88,74 (5,065∙105-1,013∙105)∙10-6=35,96 Дж
Ответ: 35,96 Дж
16. При 25°С энтропии ромбической и моноклинической серы соответственно равны 31,88 и 32,55 дж/г∙атом∙град, а теплоты образования равны 0,00 и 0,30 кдж/г∙атом. Рассчитать ΔG и ΔF для процесса при 25°С. Пренебречь приближенно различием плотностей обеих модификаций серы. Какая из двух модификаций серы является более устойчивой при 25°С? Дайте приближенную оценку температуры перехода, при которой обе модификации серы находятся в равновесии, принимая для ΔS и ΔH значения при 25°С.
Решение.

ΔG=H-TΔS=0,30∙
ΔG= ΔF
Ответ:100,34 Дж/г∙атом
17-25. Найти ΔG и ΔF химических реакций из электрохимических данных. Изменением объемов твердых и жидких веществ при реакции пренебречь.
|
Номер задачи |
Реакции |
Температура
|
Э.Д.С.,в |
|
17 |
Ag + 1/2 Cl2 (г) = AgCl (т) |
17 |
1,132 |
|
18 |
2Hg + Cl2 (г) = Hg2Cl2 (т) |
25 |
1,085 |
|
19 |
AgCl + 1/2 H2 = Ag + HC1 aq |
25 |
0,224 |
|
20 |
Zn + Cl2(г) = ZnCl2 aq |
25 |
2,123 |
|
21 |
Cu + Cl2 (г) = CuCl2 aq |
25 |
1,023 |
|
22 |
Cd + Cl2 (г) = CdCl2 aq |
25 |
1,763 |
|
23 |
Cu + 1/2 Cl2 (г) = CuCl (т) |
25 |
0,839 |
|
24 |
Co (т) + Cl2 (г) =CoCl2 aq |
25 |
1,637 |
|
25 |
Sn + Cl2 (г) = SnCl2 aq |
25 |
2,496 |
Решение.
17.
ΔG=-zFE=-1∙96500∙1,132∙ =-109,24
кдж/моль
=-109,24
кдж/моль
ΔF=-zFE+RT=-109,24+8,314∙290∙ =-106,83
кдж/моль
=-106,83
кдж/моль
Ответ: -109,24 кдж/моль, -106,83 кдж/моль
18.
ΔG=-zFE=-2∙96500∙1,085∙ =-209,4
кдж/моль
=-209,4
кдж/моль
ΔF=-zFE+RT=-209,4+8,314∙298∙ =-209,4+2,48=-206,92
кдж/моль
=-209,4+2,48=-206,92
кдж/моль
Ответ: -209,4 кдж/моль, -206,92 кдж/моль
19.
ΔG=-zFE=-1∙96500∙0,224∙ =-21,62
кдж/моль
=-21,62
кдж/моль
ΔF=-zFE+RT=-21,62+8,314∙298∙ =-21,62+2,48=-19,136
кдж/моль
=-21,62+2,48=-19,136
кдж/моль
Ответ: -21,62 кдж/моль, -19,136 кдж/моль
20.
ΔG=-zFE=-2∙96500∙2,123∙ =-409,74
кдж/моль
=-409,74
кдж/моль
ΔF=-zFE+RT=-409,74+8,314∙298∙ =-409,74+2,48=-407,26
кдж/моль
=-409,74+2,48=-407,26
кдж/моль
Ответ: -409,74 кдж/моль, -407,26 кдж/моль
21.
ΔG=-zFE=-2∙96500∙1,023∙ =-197,44
кдж/моль
=-197,44
кдж/моль
ΔF=-zFE+RT=-197,44+8,314∙298∙ =-197,44+2,48=-194,96
кдж/моль
=-197,44+2,48=-194,96
кдж/моль
Ответ: -197,44 кдж/моль, -194,96 кдж/моль
22.
ΔG=-zFE=-2∙96500∙1,763∙ =-340,26
кдж/моль
=-340,26
кдж/моль
ΔF=-zFE+RT=-340,26+8,314∙298∙ =-340,26+2,48=-337,78
кдж/моль
=-340,26+2,48=-337,78
кдж/моль
Ответ: -340,26 кдж/моль, -337,78 кдж/моль
23.
ΔG=-zFE=-1∙96500∙0,839∙ =-80,96
кдж/моль
=-80,96
кдж/моль
ΔF=-zFE+RT=-80,96+8,314∙298∙ =-80,96+2,48=-78,48
кдж/моль
=-80,96+2,48=-78,48
кдж/моль
Ответ: -80,96 кдж/моль, -78,48 кдж/моль
24.
ΔG=-zFE=-2∙96500∙1,637∙ =-315,94
кдж/моль
=-315,94
кдж/моль
ΔF=-zFE+RT=-315,94+8,314∙298∙ =-315,94+2,48=-313,46
кдж/моль
=-315,94+2,48=-313,46
кдж/моль
Ответ: -315,94 кдж/моль, -313,46 кдж/моль
25.
ΔG=-zFE=-2∙96500∙2,496∙ =-481,73
кдж/моль
=-481,73
кдж/моль
ΔF=-zFE+RT=-481,73+8,314∙298∙ =-481,73+2,48=-479,25
кдж/моль
=-481,73+2,48=-479,25
кдж/моль
Ответ: -481,73 кдж/моль, -479,25 кдж/моль
26—33. Вычислить изменения изобарного потенциала при изотермном сжатии газа от Р1до Р2; газы считать идеальными.
|
Номер задачи |
Газ |
Количество газа |
Тем пе рату ра
|
Давление,
н/м2∙ |
|
|
|
|
||||
|
26 |
Кислород |
0,005 м3 |
0 |
0,1013 |
1,013 |
|
27 |
Азот |
7 г |
27 |
0,506 |
3,04 |
|
28 |
Хлор |
0,002 м3 |
25 |
1,013 |
10,13 |
|
29 |
Водород |
0,01 м3 |
100 |
0,506 |
5,065 |
|
30 |
Кислород |
20 г |
25 |
1,013 |
15,20 |
|
31 |
Фосген |
0,01 м3 |
20 |
1,013 |
10,13 |
|
32 |
Окись углерода |
0,003 м3 |
25 |
0,1013 |
2,026 |
|
33 |
Сероводород |
0,001 м3 |
25 |
1,013 |
2,026 |
Решение:
26.
ΔG=2,3∙nRT∙lg

n=
ΔG=2,3∙0,0223∙8,314∙273∙lg

Ответ:
27.
ΔG=2,3∙nRT∙lg
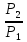
n=
ΔG=2,3∙0,25∙8,314∙273∙lg

Ответ: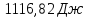
28.
ΔG=2,3∙nRT∙lg
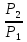
n=
ΔG=2,3∙0,0817∙8,314∙273∙lg

Ответ:
29.
ΔG=2,3∙nRT∙lg

n=
ΔG=2,3∙0,163∙8,314∙273∙lg

Ответ:
30.
ΔG=2,3∙nRT∙lg

n=
ΔG=2,3∙0,625∙8,314∙298∙lg
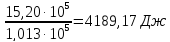
Ответ:
31.
ΔG=2,3∙nRT∙lg

n=
ΔG=2,3∙0,4158∙8,314∙293∙lg

Ответ:
32.
ΔG=2,3∙nRT∙lg

n=
ΔG=2,3∙0,01226∙8,314∙298∙lg

Ответ:
33.
ΔG=2,3∙nRT∙lg

n=
ΔG=2,3∙0,041∙8,314∙298∙lg

Ответ:
34. Определить изменение изохорного потенциала и внутренней энергии при обратимом испарении 1 моль брома при давлении 1,013∙105 н/м2 и температуре кипения —7,3° С. Теплота испарения брома равна 31,0 кдж/моль.
Решение.
Q=ΔU-nRT
31=ΔU-1∙8,314∙265,7∙
31=ΔU-2,21
ΔU=28,79 кдж/моль

Ответ: 28,79;-2,21 кдж/моль
35
Вычислить
 реакции
разложения С4Н104(г)
= С3Н6(г)
+ СН4(г)
при 25 °С, если теплоты образования
С4Н10,
C3H6,
CH4
равны соответственно: 125,1; 20,4; -74,83 кДж,
а энтропии их равны соответственно:
310,04; 266,87; 186,14 Дж/моль
реакции
разложения С4Н104(г)
= С3Н6(г)
+ СН4(г)
при 25 °С, если теплоты образования
С4Н10,
C3H6,
CH4
равны соответственно: 125,1; 20,4; -74,83 кДж,
а энтропии их равны соответственно:
310,04; 266,87; 186,14 Дж/моль К.
К.
Решение.
Вычисляем на основе следствия из закона Гесса тепловой эффект реакции:

Рассчитаем аналогично
изменение энтропии реакции:
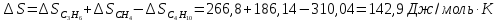
Определяем
 по уравнению (11.14)
по уравнению (11.14)

Ответ:
36.
В каком направлении
может протекать реакция крекинга
циклогексана при 727 °С С 6Н12
=
ЗС2Н4,
если при данной температуре
 G°(
(С6Н12)=402,2
кДж/моль, a
G°(
(С6Н12)=402,2
кДж/моль, a
 G°(C2H4)=
114,0 кДж/моль.
G°(C2H4)=
114,0 кДж/моль.
Решение.
Δ G°(C2H4)-
G°(C2H4)- G°(
(С6Н12)=342-402,2=-60,2
кДж/моль
G°(
(С6Н12)=342-402,2=-60,2
кДж/моль
Т.к. Δ
Ответ: -60,2 кДж/моль
37. Почему синтез аммиака по реакции N2 (г.)+3H2 (г.)=2NH3 (г.)
стремятся вести при более низкой температуре?
Решение.
 кДж/моль
кДж/моль
 кДж/моль
кДж/моль
 кДж/моль
кДж/моль
 Дж/моль∙град
Дж/моль∙град
 Дж/моль∙град
Дж/моль∙град
 Дж/моль∙град
Дж/моль∙град
 кДж/проб
кДж/проб
 Дж/K∙проб
Дж/K∙проб
Ответ:
так как
 кДж/проб
кДж/проб и
и
 Дж/K∙проб
Дж/K∙проб
38. Определить: ΔU,ΔH,ΔS процесса:
 1
моль H2O
(ж; 20
1
моль H2O
(ж; 20 ;
1 атм.) 1 моль H2O
(г; 250
;
1 атм.) 1 моль H2O
(г; 250 1
атм.)
1
атм.)
Энтальпия испарения
воды при 100 равна 40655 Дж/моль. Теплоёмкость жидкой
и парообразной воды равна:
равна 40655 Дж/моль. Теплоёмкость жидкой
и парообразной воды равна:
Ср(ж)=75,30 Дж/моль∙К
Ср(г)= 30,00+10,71∙10-3T-0,33∙105T-2 Дж/моль∙К
Решение.
20 250
250

 H2O(ж)
H2O(г)
H2O(ж)
H2O(г)
 H2O(п)
H2O(п)
H2O(п)
H2O(п)
100
ΔS1=75,30
ΔS2= Дж/моль∙К
Дж/моль∙К
ΔS3=30
ΔS=11,8+108,95+18,17=138,92 Дж/моль∙К
ΔH1=Cp∙(T1-T2)=75,30∙(100-20)=6024
ΔH2=40655 Дж/моль
ΔH3=30∙150+5,365∙
ΔH =5246,65+40655+6024=51925 Дж/моль
Ответ: 138,92 Дж/моль∙К; 51925 Дж/моль
39.
Один моль двухатомного идеального газа,
взятый при 25 и 1 атм., нагревается при постоянном
давлении, пока объём не возрастёт втрое.
Рассчитать Q,
A,
ΔH,
ΔU
и ΔS
процесса.
и 1 атм., нагревается при постоянном
давлении, пока объём не возрастёт втрое.
Рассчитать Q,
A,
ΔH,
ΔU
и ΔS
процесса.
Решение.
P=const,
pV=nRT,

T2=
ΔS=Cp
ln =
= Rln
Rln
dU=CVdT=1,5
Qp=ΔU=Cp(T2-T1)=2,5(894,45-298)∙8,314=12394,1
dU=δQ-A A=δQ-dU=12394,1-7436,46=4957,6
Ответ:
 4957,6
4957,6
40. В
одном сосуде находится кислород, а в
другом – азот. Эти сосуды соединены
трубкой с краном. При открывании крана
происходит изотермическое смешение
газов при 25 :
:
0,2 моль O2 (0,2 атм.) + 0,8 моль N2 (0,8 атм.)→смесь газов
а) Рассчитать общее
давление смеси газов; б) Чему равны Q,
A,
ΔU,
ΔS,
ΔH
и ΔG
для процесса смешения; в) Чему были бы
равны Q
и A,
если бы смешение газов протекало обратимо
и изотермически при 25
Решение.
V1(O2)= м3
м3
V2(N2)= м3
м3
а) робщ=
б) Q=A=ΔU=ΔH=0
ΔS=

ΔG= ΔH-TdS=-298,15∙5,76=-1717,344
Q=A= ΔS∙T=1717,344
Ответ:
 Q=A=ΔU=ΔH=0;
Q=A=ΔU=ΔH=0;
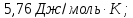 -1717,344; 1717,344
-1717,344; 1717,344
41. В основу современного производства азотной кислоты положена реакция: 4NH3 (г.)+5O2 (г.)=4NO (г.)+6H2O (г.) стремятся вести при более низкой температуре?
Выяснить влияние изменения температуры на протекание этого процесса.
Решение.
 кДж/моль
кДж/моль
 кДж/моль
кДж/моль
 кДж/моль
кДж/моль
 кДж/моль
кДж/моль
 Дж/моль∙град
Дж/моль∙град
 Дж/моль∙град
Дж/моль∙град
 Дж/моль∙град
Дж/моль∙град
 Дж/моль∙град
Дж/моль∙град
 кДж/проб
кДж/проб
 Дж/K∙проб
Дж/K∙проб
Ответ:
благоприятствует условие ΔT ,
так как
,
так как
 кДж/проб
кДж/проб и
и
 Дж/K∙проб
Дж/K∙проб
42. Почему повышение температуры препятствует протеканию реакции:
2NO (г.)+O2 (г.)=2NO2 (г.), а понижение- способствует?
Решение:
 кДж/моль
кДж/моль
 кДж/моль
кДж/моль
 кДж/моль
кДж/моль
 Дж/моль∙град
Дж/моль∙град
 Дж/моль∙град
Дж/моль∙град
 Дж/моль∙град
Дж/моль∙град
 кДж/проб
кДж/проб
 Дж/K∙проб
Дж/K∙проб
Ответ:
так как
 кДж/проб
кДж/проб и
и

Дж/K∙проб
43. Определите
 ,
,

 и
и
 при
298,2 К ДЛЯ реакции
при
298,2 К ДЛЯ реакции
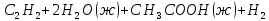
Необходимые данные возьмите из справочника.
Решение.
ΔН298 0=Σ(ΔНf298 )пр.р + Σ(ΔНf298)исх.р =-484,9- (2∙(-285,84)+226,75)∙103=140∙103 Дж/моль
ΔU0298= ΔН298 0- РΔV= ΔН298 0- Δn∙R∙T
Δn=1-1=0
ΔU0298= ΔН298 0
ΔG0298 = Σ(ΔG0f298 )пр.р + Σ(ΔG0f298)исх.р =(-576,64)-(-2∙334,46+209,25)∙ 103 =-116,97∙103 Дж/моль
ΔF0298 = ΔG0298- РΔV.
Для данной реакции РΔV=0. Следовательно: ΔF0298 = ΔG0298
ΔS0298= Σ(ΔS 0f298 )пр.р + Σ(ΔS 0f298)исх.р =(130,6+159,8)-(200,8+2∙69,96)∙ 103=-50,32 Дж/моль*К.
Ответ: 140∙103 ; -116,97∙103 Дж/моль; -50,32 Дж/моль∙К.
44. Определите
ΔS,
ΔH
и ΔUпроцесса
1 моль H2O
(ж,200С,
1 атм)→1моль Н2О(г,2500С,
1 атм), имея следующие данные: Ср(ж)
18 .
ΔН испарения воды при 1000С
и 1 атм составляет 9720
.
ΔН испарения воды при 1000С
и 1 атм составляет 9720
 .
.
Решение.
Разобьем процесс на следующие стадии:
-
Нагревание от 20 до 1000С:
ΔH=Ср(Т2-Т1)=18(80)=1440 ;
;
ΔS=Ср
In =18
In
=18
In
 =4,35
=4,35 .
.
-
Испарение при 1000С:
ΔH=9720 ;
;
ΔS= .
.
-
Нагревание от 100 до 2500С:
ΔH=Ср(Т2-Т1)=8,6(150)=1290 ;
;
ΔS=Ср
In =8,6
In
=8,6
In
 =2,19
=2,19
ΔS=4,35+26,02+2,91=33,28 .
.
ΔH=1440+9720+1290=12450
ΔU= ΔH- Δ(PV)= ΔH-P ΔV;
ΔV=V(г.523) – V(ж.293) ≈ V(г.523),
если принять, что объем жидкости незначителен по сравнению с объемом газа.
PΔV=
PV(г.523)
=RT=1,987 5236150С=1040
5236150С=1040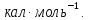
(при предположении,
что газ идеальный ΔU=12450-1040=11410

Ответ:
33,28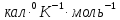 .;
11410
.;
11410
 ;
12450
;
12450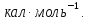
45. Найти изменение U,H,S,А и G при изотермическом расширении 5 молей кислорода, рассматриваемого как идеальный газ, от 100 до 1000 л при 25 °С, если Ср,298 = 29,38 Дж∙моль∙К-1.
Решение.
ΔU = ΔH = 0
ΔS=nRln Дж∙К-1
Дж∙К-1
ΔА =
ΔG
=nRTln - 28,55 кДж
- 28,55 кДж
Ответ: ΔU = ΔH = 0; ΔS = 95,74 Дж∙К-1; ΔА = ΔG = - 28,55 кДж.
46. Найти изменение U, H, S, А и G при переходе 1 моля воды в пар при 100°С и 1 атм. При этой температуре мольный объем воды равен 18 мл, а мольный объем пара равен 30,2 л. Теплота испарения воды при 100 °С равна 40,65 кДж∙моль-1.
Решение.
 Дж∙моль -1∙К-1
Дж∙моль -1∙К-1
Q=ΔU+ΔnRT
108,98=ΔU+1∙8,314∙343
ΔU=37,55 кДж∙моль-1
A=Q-U=3,1 кДж∙моль-1
Ответ: ΔG = 0; ΔН= 40,65 кДж∙моль-1; ΔU= 37,59 кДж∙моль-1; ΔS= 108,92 Дж∙моль -1∙К-1; ΔА = -3,06 кДж∙моль-1.
47. а)
Найти ΔН0
при 10000К
для реакции NaCl(тв)→Na(г)+ Сl2(г);
Сl2(г);
 =124,1
ккал и
=124,1
ккал и
 =−1,585
- 3,82·10-3 Т
– 0,34·105Т-2.
=−1,585
- 3,82·10-3 Т
– 0,34·105Т-2.
б)Выполняется ли соотношение ΔS0=ΔH0/T для (1) приведенной реакции при 250С; (2) реакции NaCl(тв)→NaСl(г) при 250С; (3) реакции NaCl(ж)→NaСl(г) при 14130С(температура кипения NaСl)? Объясните каждый случай, предполагая, что газы идеальные.
Решение.
а)
б) Для любого изотермического процесса

Только если
 =0.
=0.
-
Нет. Как видно из эксперимента, для этого необратимого процесса
 0.
0. -
Нет. Для этого процесса также
 0.
Индекс «0» показывает, что летучесть
NaCl(г)
равна 1 атм, а, как мы знаем, давление
насыщенных паров NaCl
значительно меньше 1 атм при 250С.
0.
Индекс «0» показывает, что летучесть
NaCl(г)
равна 1 атм, а, как мы знаем, давление
насыщенных паров NaCl
значительно меньше 1 атм при 250С. -
Да. Летучесть NaCl (и давления паров, поскольку газ считается идеальным) при температуре кипения равна 1 атм. Если процесс будет обратимым и изотермическим при этом постоянном давлении, то работа, исключая работу расширения, будет равна нулю. Следовательно,
 0.
0.
Ответ:
 ;
1) нет; 2) нет; 3) да.
;
1) нет; 2) нет; 3) да.
48. ΔН0
для процесса плавления воды при 00С
равна 1436
 .
Ср
для твердой и жидкой воды составляет
соответственно 8,9 и 18,0
.
Ср
для твердой и жидкой воды составляет
соответственно 8,9 и 18,0
 .
Определите а) ΔН, б) ΔS
и в) ΔС при постоянном давлении 1 атм для
следующего процесса:
.
Определите а) ΔН, б) ΔS
и в) ΔС при постоянном давлении 1 атм для
следующего процесса:
Н2О(тв,-100С)→ Н2О(ж,-100С).
 ;
;
Решение.
а)
б)

(Заметим, что
 =0,
поэтому
=0,
поэтому
 =
= .
Как будет показано в пункте (в), ΔS
и ΔН нельзя определить таким путем при
других температурах.)
.
Как будет показано в пункте (в), ΔS
и ΔН нельзя определить таким путем при
других температурах.)
в)Метод I.
 .
.
Метод II.

 ;
;
 .
.
Метод III.



Ответ:
 ;
;
 ;
;
 .
.
49. Вычислить ΔrG°473 реакции: 1/2N2 + 1/202 = NO, если
ΔrG0298
=
86,44 кДж∙моль-1
а стандартные энтропии ( Дж∙моль -1∙K-1
и средние теплоемкости веществ (Сp,298,
Дж∙моль -1∙К-1)
равны:
Дж∙моль -1∙K-1
и средние теплоемкости веществ (Сp,298,
Дж∙моль -1∙К-1)
равны:
|
Вещество |
|
|
|
|
N2(г) |
191,50 |
29,12 |
|
|
О2(г) |
205,04 |
29,38 |
|
|
NO(r) |
210,64
|
29,86 |
Решение.
 Дж∙моль -1∙K-1
Дж∙моль -1∙K-1
ΔrG0298=H-TS=H-298∙
ΔH=90,12
 G0473=H-TS=90,12-473∙
G0473=H-TS=90,12-473∙ кДж∙моль-1
кДж∙моль-1
Ответ:
 G0473=
84,25 кДж∙моль-1.
G0473=
84,25 кДж∙моль-1.
50. Вычислить реакции ΔrG0973 для: 2С02(Г) =2СО (г) + 02(г), если стандартные значения равны:
|
Ве- щест- во |
Δr |
|
|
|
|
|
|
co2(r) |
-393,52 |
213,67 |
37,14 |
|
||
|
co(r) |
-110,53 |
197,55 |
29,14 |
|||
|
02(r) |
— |
205,04 |
29,38 |
|||
Решение.
 кДж∙моль-1
кДж∙моль-1
 Дж∙моль-1∙К-1
Дж∙моль-1∙К-1
ΔrG0500=H-TS=565,98-973∙ кДж∙моль-1
кДж∙моль-1
Ответ: ΔrG0973 = 391,48 кДж∙моль -1.
51.
Вычислить реакции ΔrG0500
для: Fe2C03(т)
= FeO(т)
+ C02
(г), если значенияи Δr ,
стандартные энтропии и теплоемкости
веществ равны:
,
стандартные энтропии и теплоемкости
веществ равны:
|
Вещест- во |
Δr |
|
|
|
|
|
FеСО3(т) |
-738,15 |
95,40 |
83,26 |
||
|
FeO(т) |
-264,85 |
60,75 |
49,92 |
||
|
со2(г) |
-393,52 |
213,67 |
37,14 |
Решение.
 кДж∙моль-1
кДж∙моль-1
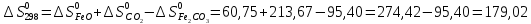
ΔrG0500=H-TS=79,78-500∙ кДж∙моль-1
кДж∙моль-1
Ответ: ΔrG0500 =- 9,95 кДж∙моль-1 .
МНОГОВАРИАНТНЫЕ ЗАДАЧИ
52. Вычислить стандартные изменения изобарного потенциала химической реакции при 25°С по стандартным значениям энтальпий образования и абсолютных энтропии, воспользовавшись таблицами стандартных величин. Все реакции проводятся между чистыми твердыми, жидкими и газообразными веществами (не в растворе).
|
Номер задачи |
Реакции |
|
1 |
ZnО (т) + СО (г) =Zn (т) + С02 (г)
|
|
2 |
ZnS (т) + Н2 (г) = Zn (т) + H2S (г)
|
|
3 |
2С02 (г) = 2СО (г) + 02 (г)
|
|
4 |
СО (г) + НгО (ж) = С02 (г) + Н2 (г)
|
|
5 |
2HI (г) = Н2 (г) + I2 (г)
|
|
6 |
СО (г) + 2Н2 (г) = СН3ОН (ж)
|
|
7 |
NH3 (г) + НСl (г) =NH,Cl (т)
|
|
8 |
Н2 (г) + С02 (г) =СО (г) + Н20 (ж)
|
|
9 |
С02 (г) + 4Н2 (г)=СН4 (г) + 2Н20 (ж)
|
|
10 |
2Н20 (ж) =2Н2 (г) + 02 (г)
|
|
11 |
SO2 (г) + С!2 (г) =S02CI2 (г)
|
|
12 |
СО (г) + С12 (г) =СОС12 (г)
|
|
13 |
4HCI (г) + 02 (г) =2Н20 (ж) + 2С12 (г)
|
|
14 |
СНзСООН (г) + 2Н2 (г) = 2СН3ОН (г)
|
|
15 |
СО (г) + ЗН2 (г) = СH4 (г) + Н20 (г)
|
|
16 |
Н2 (г) + НСОН (г) = СНзОН (г)
|
|
17 |
4NH3 (г) + 502 (г) = 6Н20 (г) + 4NO (г)
|
|
18 |
Са(ОН)2 (т) =СаО (т) + Н20 (ж)
|
|
19 |
РСl5 (г) = PCl3 (г) + Сl2(г)
|
|
20 |
С2Н4 (г) + 302 (г) =2С03 (г) + 2Н20 (ж)
|
|
21 |
СаСОз (т) =СаО (т) + С02 (г)
|
|
22 |
H2S (г) + COS (г) =Н20 (г) + CS2 (г)
|
|
23 |
H2S (г) + С02 (г) =Н20 (г) + COS (г)
|
|
24 |
СбН6 (г) + ЗН2 (г) =С6Н12 (ж) |
|
25 |
С2Н5ОН (ж) = С2НЧ (г) + Н20 (ж)
|
|
26 |
СН4 (г) + 2H2S (г) = CS2 (ж) + 4Н2 (г)
|
|
27 |
2AgN03 (т) = 2Ag (т) + 2N02 (г) + 02 (г)
|
|
28 |
4С0 (г) + 2S02 (г) =S2 (г) + 4С02 (г)
|
|
29 |
2NaHC03 (т) = Na2C03 (т) + Н20 (г) + С02 (г)
|
|
30 |
MgC03 (т) = MgO (т) + С02 (г)
|








 кДж∙моль-1
кДж∙моль-1 ,
Дж∙моль-1∙К-1
,
Дж∙моль-1∙К-1 ,
Дж∙моль-1∙К-1
,
Дж∙моль-1∙К-1 кДж∙моль-1
кДж∙моль-1 ,
Дж∙моль-1∙К-1
,
Дж∙моль-1∙К-1 ,
Дж∙моль-1∙К-1
,
Дж∙моль-1∙К-1