
- •Общие схемы реакций присоединения
- •Электрофильное присоединение Теоретическое обоснование
- •Общая схема присоединенияе к двойной связи
- •Стереохимия присоединенияе к кратным связям
- •Стереохимическое доказательство образования иона бромония
- •Стереохимия присоединения к тройной связи
- •Стереохимия реакций, протекающих через открытый интермедиат типа 1
- •Синхронное тримолекулярное присоединение AdE3
- •Образование -комплекса и атака второй молекулой реагента с тыла (AdE3)
- •Гамма (спектр) механизмов электрофильного бромирования (йодирования)
Лекция 8
Общие схемы реакций присоединения
Электрофильное присоединение Теоретическое обоснование
Граничными орбиталями алкенов, высшей занятой молекулярной орбиталью (ВЗМО) и низшей свободной (вакантной) молекулярной орбиталью (НСМО), являются занятая (связывающая) -орбиталь и пустая (разрыхляющая)-орбиталь. Следовательно, в реакциях с электрофилами (Е+) будет участвовать-орбиталь, а в реакциях с нуклеофилами (Nu-) –-орбиталь связи С=С.
В большинстве случаев простые алкены
легко вступают в реакции с электрофилами,
а с нуклеофилами реагируют с большим
трудом. Это объясняется тем, что обычно
НСМО большинства электрофилов по энергии
близки к энергии-ВЗМО
алкенов, тогда как ВЗМО
большинства нуклеофилов лежат значительно
ниже-НСМО
алкенов.
большинстве случаев простые алкены
легко вступают в реакции с электрофилами,
а с нуклеофилами реагируют с большим
трудом. Это объясняется тем, что обычно
НСМО большинства электрофилов по энергии
близки к энергии-ВЗМО
алкенов, тогда как ВЗМО
большинства нуклеофилов лежат значительно
ниже-НСМО
алкенов.
Простые алкены реагируют лишь с очень сильными нуклеофилами в жестких условиях, однако введение электроноакцепторных групп (NO2,C(O)R,CN,Hal) приводит к понижению-уровня, и алкен приобретает способность реагировать с нуклеофилами средней силы.
Общая схема присоединенияе к двойной связи
Многочисленные экспериментальные данные свидетельствуют о том, что реакция электрофильного присоединения состоит по крайней мере из двух стадий. Рассмотрим возможные механизмы присоединения.
Стадия 1 – элементарная стадия электрофильного присоединения. Представляет собой гетеролитический разрыв -связи с одновременным присоединением электрофильного реагента, приводящий к образованию карбокатиона. Относительно медленная стадия.
Стадия 2 – гетеролитическая ассоциация, идентична 2-й стадии механизма SN1; относительно быстрая стадия (реакция аниона с катионом).

Стадия 1 – скорость определяющая стадия.
Электрофилом может быть как положительно заряженная частица (E = E) – если анионRочень стабилен, так и положительная часть диполя или индуцированного диполя(E+E), причем отрицательная часть отщепляется либо на первой стадии, либо сразу после нее.
Для многих реакций бромирования ион 1(-комплекс), если вообще образуется, то быстро циклизуется в более стабильный мостиковый ион – ион бромония2(циклический-комплекс):
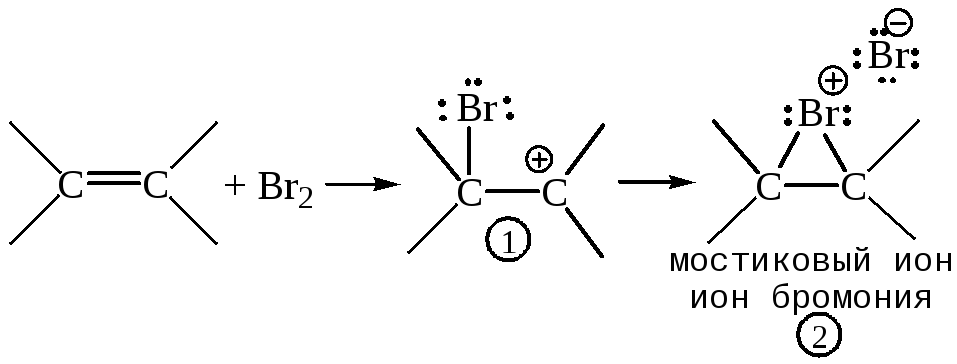
Возможно, что сначала образуется -комплекс (донорно-акцепторный комплекс, комплекс с переносом заряда), в нем имеет место частичный перенос электронов со связывающей-орбитали двойной связи на низко расположенную вакантнуюd-орбиталь галогена и связанный с ним обратный перенос электронов на возбужденную (антисвязывающую)-орбиталь олефина, молекула галогена при этом поляризуется, и образуется так называемая «ретродативная-связь», налагающаяся на-связь. Образование-комплекса формально является элементарной реакцией присоединения:

Далее -комплекс превращается в циклический бромониевый ион. При этом происходит окончательный гетеролитический разрыв-связи с переносом электронной пары на атом галогена, гетеролитический разрыв связиBr–Brи перекрывание пустой орбиталиsp2-гибридизованного углерода с орбиталью неподеленной пары галогена.
Смещение трех электронных пар при образовании симметричногобромониевого иона происходит скорее всего синхронно (причем часто отщеплению бромид-иона способствует вторая молекула галогена), и с этой точки зрения эта стадия напоминает перициклическую реакцию:

Атака частицы Rна интермедиат2представляет собой элементарную реакцию нуклеофильного замещения с уходящей группой –Br–. Эту же стадию реакции можно рассматривать как элементарную реакцию присоединения.

Следует особо остановиться на различных изображениях иона бромония. Он может быть представлен в виде гибрида трех структур, наподобие канонических, из которых симметричная структура имеет наибольший вклад. С этой точки зрения его изображение в виде положительно заряженной структуры с нецелочисленными связями 2aи делокализованным положительным зарядом имеет определенный физический смысл и право на использование:

Действительно, связи C–Brсильно поляризованы, что в пределе дает нулевой порядок-связи, т. е. порядки этих связей должны быть несколько меньше единицы, а углероды должны нести частичные положительные заряды. Отсюда вытекает представление о несимметричном мостиковом ионе3, который образуется, если заместители при- и-углеродах различаются по способности делокализовать положительный заряд:

Концепция несимметричного мостикового катиона 3позволяет объяснить многие экспериментальные данные, необъяснимые с точки зрения образования симметричного мостикового иона. В пределе, если заместители при углеродах сильно различаются по электронодонорной способности, открытый катион1может оказаться более стабильным, чем мостиковый3, что, однако, не исключает возможности стабилизации положительно заряженного углеродного атома интермедиата1путем притяжения (координации) к атому галогена (см. ниже).
Независимо от интермедиата, 1,2или3, такой механизм носит название электрофильного бимолекулярного присоединения (AdE2 –Additionelectrophilicbimolecular).
Изучение кинетики процессов бромирования показало, что в общем случае скорость реакции описывается следующим кинетическим уравнением:
v = k1 [alkene][Br2] + k2 [alkene][Br2]2 + k3 [alkene][Br2][Br],
которое иногда упрощается до первых двух членов и редко – до первого члена, т. е. ожидаемого для приведенного механизма AdE2 простого выражения
v=k1[alkene][Br2].
Такой вид кинетического уравнения свидетельствует, что продукт присоединения может образовываться и по тримолекулярным механизмам, основные из которых могут быть представлены следующим образом:
1) Классическая схема с образованием - и-комплексов, но с бромониевым ионом реагирует не бромид-ион, а трибромид-ион, образующийся по реакции
Br+Br2⇄Br3
Равновесие этой реакции сдвинуто вправо.
2) Электрофильное содействие со стороны 2-й молекулы брома при образовании -комплекса из-комплекса:

3) Процесс AdE3 с синхронной атакой двумя молекулами брома, одна из которых выполняет функцию электрофила, а вторая – нуклеофила:

Такой тримолекулярный механизм маловероятен, так как тримолекулярные элементарные реакции (одновременное столкновение трех молекул, три молекулы в переходном состоянии) крайне маловероятны. Однако он обратен механизму Е2 реакции элиминирования, для которого показана подобная геометрия переходного состояния. Обычно тримолекулярный механизм состоит из последовательности двух бимолекулярных стадий.
4) Образование -комплекса с его последующей атакой бромид-анионом (или трибромид-анионом), без образования-комплекса (бромониевого иона); также обозначается как механизмAdE3:

