- •Аналитическая химия
- •Часть 1
- •Isbn 985-466-015-х
- •Раздел 1
- •Глава 1
- •Разложение пробы
- •1.3. Виды анализа
- •Экстракционная фотометрия
- •Глава 2
- •2.1. Аналитические реакции
- •2.2. Систематический и дробный анализ
- •Комплексообразование
- •2.3. Общая характеристика, классификация и способы обнаружения катионов
- •2.4. Общая характеристика, классификация и способы обнаружения анионов
- •Глава 3
- •3.1. Общая характеристика химического равновесия. Константа химического равновесия
- •3.2. Активность и коэффициент активности
- •3.3. Отклонения от идеальности в растворах сильных электролитов
- •3.4. Виды констант химического равновесия, используемые в аналитической химии
- •3.5. Общие принципы расчёта состава равновесных систем
- •Глава 4
- •4.1. Важнейшие теории кислот и оснований
- •4.2. Количественное описание силы кислот и оснований
- •4.3. Влияние растворителя на кислотно-основные свойства растворённого вещества
- •4.4. Нивелирующее и дифференцирующее действие растворителя. Сильные и слабые кислоты и основания
- •4.5. Расчёт рН водных растворов различных прото- литов
- •4.6. Расчёт состава равновесных смесей протолитов при заданном значении рН
- •4.7. Кислотно-основные буферные растворы
- •Глава 5
- •5.1. Понятие о комплексном соединении
- •5.2. Классификация комплексных соединений
- •5.3. Равновесия в растворах комплексных соединений
- •Общая константа образования
- •5.4. Влияние различных факторов на комплексообразование в растворах
- •5.5. Применение органических реагентов в аналитической химии
- •Лиганды с одним типом донорных атомов о,о-лиганды
- •Шестичленные циклы
- •Органические реагенты
- •6.1. Произведение растворимости малорастворимого электролита
- •Глава 6
- •6.2. Растворимость
- •6.3. Влияние различных факторов на растворимость
- •6.4. Общие принципы растворения осадков малорастворимых электролитов
- •Глава 7
- •7.1. Общая характеристика окислительно-восстановительных реакций
- •7.2. Количественная оценка окислительно-восстановительной способности веществ
- •7.3. Влияние различных факторов на протекание окислительно-восстановительных реакций
- •Глава 8
- •8.1. Отбор пробы
- •Анализируемым образец
- •I эмпирический
- •Генеральная проба
- •Лабораторная проба
- •8.2. Разложение пробы
- •9.1. Общая характеристика и классификация
- •Глава 9
- •9.2. Жидкость - жидкостная экстракция
- •Реэкстракт
- •Реэкстракция
- •Сложные эфиры фосфорной кислоты, фосфоновых, фосфиновых кислот, фосфиноксиды, сульфоксиды, диантипирилметан
- •Третичные амины, четвертичные аммониевые соли, соли тетрафениларсония и тетрафенилфосфония.
- •Глава 10
- •10.1. Приближённые вычисления и значащие цифры
- •3 Значащие цифры
- •1 Значащая цифра
- •10.2. Понятие об аналитическом сигнале
- •10.3. Методы расчёта концентрации вещества по величине аналитического сигнала
- •10.4. Неопределённость и погрешности измерений
- •10.5. Некоторые основные положения математической статистики, используемые в аналитической химии
- •10.6. Пример статистической обработки результатов измерений. Исключение промахов
- •10.7. Основные характеристики методики анализа
- •Раздел 2
- •Глава 11
- •11.3. Понятие о механизме образования осадка
- •11.4. Коллоидная стадия образования осадка
- •11.5. Причины загрязнения осадка и способы их устранения
- •11.6. Основные этапы методики гравиметрического определения методом осаждения
- •11.7. Гравиметрия в фармацевтическом анализе
- •Глава 12 общая характеристика титриметрических методов анализа
- •12.1. Основные понятия титриметрии
- •Исчезновение окраски фенолфталеина
- •Появление розовой окраски раствора
- •12.2. Классификация титриметрических методов анализа и способов титрования
- •12.3. Стандартные растворы и стандартные вещества
- •12.4. Расчёты, связанные с приготовлением растворов титрантов и титрованием
- •Vисх_mрисх_m(hCl) _n(hCl) - m(hCl) _c(hCl) - V - m(hCl) _p _ra(hCl) -p_ ra(hCl) -p _p-ra(hCl)
- •Глава 13 кислотно-основное титрование
- •13.1. Титранты и стандартные вещества
- •13.2. Обнаружение конечной точки титрования. Кислотно-основные индикаторы
- •13.3. Кривые титрования
- •13.4. Факторы, влияющие на величину скачка титрования
- •0,1МNaOh (1), 0,001мhCl 0,001мNaOh (2) и или основания (рис. 13.4).
- •0,1МhCl 0,1мNaOh (3)Прямое титрование таких
- •13.5. Погрешности титрования
- •13.6. Некоторые случаи практического применения кислотно-основного титрования в водных растворах
- •Глава 14 кислотно-основное титрование в неводных средах
- •14.3. Применение в фармацевтическом анализе
- •Глава 15 комплексометрическое титрование
- •15.1. Общая характеристика
- •15.2. Меркуриметрическое титрование
- •Ind HgInd фиолетовый Ind жёлтыйHg[Fe(cn)sNo]
- •15.3. Комплексонометрическое титрование
- •Глава 16
- •16.3. Меркурометрическое титрование
- •Глава 17
- •17.1. Общая характеристика и классификация
- •17.2. Кривые титрования
- •17.3. Способы обнаружения конечной точки титрования. Окислительно-восстановительные индикаторы
- •Глава 18
- •18.1. Иодометрическое титрование
- •18.2. Хлориодометрическое титрование
- •18.3. Иодатометрическое титрование
- •18.4. Броматометрическое титрование
- •18.5. Нитритометрическое титрование
- •I" крахмал избыток NaNo2 i4
- •18.6. Перманганатометрическое титрование
- •18.8. Дихроматометрическое титрование
- •18.8. Цериметрическое титрование
- •Раздел 3
- •Глава 19
- •19.1. Природа и свойства электромагнитного излучения
- •19.2. Классификация спектроскопических методов анализа
- •Глава 20
- •20.2. Отклонения от основного закона светопоглощения
- •20.3. Атомно-абсорбционная спектроскопия
- •20.4. Молекулярная абсорбционная спектроскопия в уф- и видимой области
- •Сурьмяно-цезиевый фотоэлемент кислородно-цезиевый фотоэлемент
- •20.4.3. Практическое применение и основные приёмы фотометрического анализа
- •Измерение светопоглощения хлороформного экстракта
- •Метод отношения пропусканий
- •Метод предельной точности
- •20.5.1. Процессы, приводящие к появлению аналитического сигнала
- •20.5.2. Общая характеристика ик-спектров
- •20.5.3. Измерение аналитического сигнала
- •20.5.4. Практическое применение
- •Глава 21 эмиссионные спектроскопические методы анализа
- •21.1. Атомно-эмиссионная спектроскопия
- •21.1.1. Процессы, приводящие к появлению аналитического сигнала
- •21.1.2. Измерение аналитического сигнала
- •Пламенная фотометрия
- •3000-7000 °C невысокая воспроизводимостьтолько щелочные, щелочноземельные металлы и т.П.
- •Фотоэлементы, фотоумножители, фотодиоды
- •21.1.3. Практическое применение
- •20.2. Люминесцентная спектроскопия
- •20.2.1 Классификация видов люминесценции
- •21.2.2 Механизм молекулярной фотолюминесценции. Флуоресценция и фосфоресценция
- •21.2.3 Основные характеристики и закономерности люминесценции
- •21.2.4. Влияние различных факторов на интенсивность флуоресценции растворов
- •21.2.5. Измерение аналитического сигнала
- •21.2.6. Практическое применение и основные приёмы люминесцентного анализа
- •Рибофлавин офлоксацин
- •Глава 22 общая характеристика и теоретические основы хроматографических методов анализа
- •22.1. Общая характеристика
- •22.2. Классификация хроматографических методов
- •Агрегатное состояние подвижной фазы
- •22.3. Хроматографические параметры
- •22.4. Теории хроматографического разделения
- •Глава 23
- •Сорбент помещают внутрь колонки
- •23.3. Особенности газотвёрдофазной хроматографии
- •23.4. Особенности газожидкостной хроматографии
- •23.5. Индексы удерживания Ковача
- •23.6. Практическое применение
- •Глава 24
- •Жидкостная хроматография
- •24.1. Общая характеристика
- •24.2. Плоскостная хроматография
- •Плоскостная хроматография
- •24.2.1. Методика получения плоскостной хроматограммы
- •24.2.2. Анализ плоскостной хроматограммы
- •24.2.3. Практическое применение
- •24.3. Колоночная жидкостная хроматография
- •24.3.1. Устройство жидкостного хроматографа
- •Ввод пробы
- •24.3.2. Практическое применение
- •24.4. Характеристика отдельных видов жидкостной хроматографии
- •24.4.1. Ионообменная хроматография
- •Сильнокислотные
- •24.4.2. Эксклюзионная хроматография
- •Глава 25 общая характеристика электрохимических методов анализа. Кондукгометрия
- •25.1. Основные понятия, связанные с электрохимическими методами анализа
- •25.2. Классификация электрохимических методов анализа
- •25.3. Кондуктометрия
- •25.3.1. Теоретические основы и классификация
- •25.3.2. Измерение аналитического сигнала
- •25.3.4. Практическое применение
- •25.3.5. Понятие о высокочастотной кондуктометрии
- •Глава 26 потенциометрический и кулонометрический методы анализа
- •26.1. Потенциометрический метод анализа
- •26.1.1. Общая характеристика и классификация
- •26.1.3. Индикаторные электроды
- •Первичные ионоселективные электроды
- •Электроды с подвижными носителями
- •Имеют жидкую мембрану -
- •26.1.4. Прямая потенциометрия
- •26.1.5. Потенциометрическое титрование
- •26.2. Кулонометрический метод анализа
- •26.2.1. Общая характеристика и классификация
- •26.2.2. Прямая кулонометрия
- •26.2.3. Кулонометрическое титрование
- •Глава 27 вольтамперометрический метод анализа
- •27.1. Принцип измерения аналитического сигнала.
- •27.2. Вольтамперограмма
- •Максимум второго рода
- •Максимум первого рода
- •27.3. Некоторые современные разновидности вольт- амперометрии
- •27.4. Практическое применение вольтамперометрии. Амперометрическое титрование
15.3. Комплексонометрическое титрование
15.3.1. Понятие о комплексонах
Комплексонометрическим титрованиемназывается титри- метрический метод анализа, основанный на образовании хелатов при взаимодействии катионов металлов с комплексонами.
Комплексоны -органические соединения, в молекулах которых содержится большое число основных донорных центров и кислотных функциональных групп, расположенных так, что при их взаимодействии с катионами металлов образуются высокоустойчивые внут- рикомплексные соединения, содержащие не менее двух циклов.
В качестве основных донорных центров в молекулах комплек- сонов выступают атомы азота, фосфора или серы; кислотные центры обычно представлены карбоксильными или фосфоновыми группами. Например:
CHoCOOH CH9PO3H9
/CH2PO3H2
HOOCH2C-N H2O3PH2C—N
CH2COOH CH2PO3H2
CH2CH2COOH CH2COOH
HOOCH2CH2C—P S/
CH2CH2COOH CH2COOH
Максимально возможная дентатность у различных комплексо- нов может изменяться от 3 до 8:
COOH
I
CH2COOH HOOCH2C CH2 CH2COOH
H—NNCH2CH^NCH2CH2N
CH2COOH HOOCH2C CH2COOH
иминодиуксусная кислота диэтилентриаминпентауксусная кислота
(тридентатный лиганд) (октадентатный лиганд)
В титриметрии наибольшее значение имеют комплексоны, относящиеся к аминополикарбоновым кислотам: этилендиаминтетраук- сусная кислота и её динатриевая соль.
15.3.2. Свойства этилендиаминтетрауксусной кислоты и её взаимодействие с катионами металлов
Этилендиаминтетрауксусная кислота (ЭДТА)представляет собой белое кристаллическое негигроскопичное вещество. Мало растворима в воде и этаноле. Растворимость ЭДТА в воде минимальна при рН 1,6 - 1,8 и увеличивается при уменьшении или увеличении рН.
2+
ЭДТА (H6Y ) является шестиосновной кислотой:pKa1 - 0,8;pKa2 - 1,6;pKa3 = 2,0;pKa4 = 2,67;pKa5 = 6,16;pKa6 = 10,26. Её нейтральная форма(H4Y) имеет цвиттер-ионную структуру.
HOOC- CH2x+ +,CH2- COO
_ N-CH2"CH2-N
ooc-ch/H Hch2-cooh
Отщепление первого и второго протонов у H4Y происходит от карбоксильных групп. У дианиона ЭДТА карбоксильные группы де- протонированы, а атомы азота, наоборот, остаются протонированны- ми. Третий и четвёртый протоны отщепляются отN-H кислотных центров. Анионы ЭДТА имеют сложное строение, так как протонизи- рованные атомы водорода могут образовывать внутримолекулярные водородные связи-N-H...O, что приводит к формированию циклов.
На рис. 15.1 приведена зависимость состава водных растворов
Рис.
15.1.Распределительная
диаграмма для ЭДТА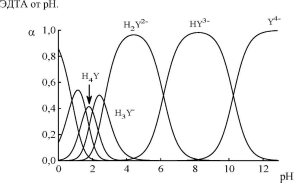
При рН 3-6 в растворе доминирует анион H2Y ", при рН 6-10 -HY3- а при рН > 10,5 -Y4-. В общем случае значениеa(Y4-) можно рассчитать:
a(Y4- ) =Ka1Ka2--Ka6
[H3O+ ]6 + Ka1[H3O+ ]5 + Ka1Ka2[H3O+ ]4 +...+Ka1Ka2..Ka6
По мере увеличения рН формула для расчёта a(Y4-) будет упрощаться. Например, при рН> 8 можно принять, что

ЭДТА образует комплексы с катионами большинства металлов
(m-4)-
(n-4)+
+
mH+
[MY]
При рН 9 это уравнение будет выглядеть как
+ H+
^ [MY]1
ЭДТА является гексадентат- ным лигандоми в подавляющем большинстве случаев взаимодействует с катионами металлов в молярном соотношении 1:1.В структуре образующегося внутриком- плексного соединения имеется 5 пя- тичленных циклов (рис. 15.2.), что делает его очень устойчивым. Устойте. 15.2. Структура т^жкшчивость комплексов металлов сметалла с ЭДТА
Mn+
+ HY3-
(n-4)+
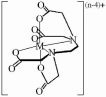
На устойчивость комплексов катионов металлов с ЭДТА влияют вещества, взаимодействующие с катионами металла либо с анионом Y4-.
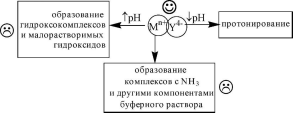
Практически устойчивость комплексов катионов металлов с ЭДТА удобно описывать с помощью условных констант образования, которые могут быть использованы лишь при тех условиях (рН, концентрация постороннего лиганда), для которых они рассчитаны.
PMY - РMYaMa
15.3.3. Кривые титрования
Кривая комплексонометрического титрования обычно представляют собой зависимость рM = -lg[M] от степени оттитрованности. В
-3 2+
качестве примера рассмотрим кривую титрования 1,0-10" М Zn
-3
1,0-10" М раствором ЭДТА. Титрование проводится в аммиачном бу-
-2
ферном растворе, рН которого равен 9,50, а концентрация NH3 - 5-10"
2+
моль/л. Поскольку C(NH3) значительно большеC(Zn ), будем счи-
2-
тать, [NH3] «C(NH3). Константа образования комплексаZnY -равна 3,2-1016, а её десятичный логарифм - 16,50.
Катион цинка образует аммиачные комплексы, содержащие от 1 до 6 молекул лиганда. Общие константы образования этих комплексов: Р1= 1,5-102; Р2= 2,7-104; Р3= 8,5-106; Р4= 1,2-109; Р5= 2,9-109; Р5= 5,6-1012.
1
a^ 2+
Zn 1+ P1[NH3] + р2[NH3]2 + ... + р6[NH3]6
1,0
-10 -5
1 + 7,5 + 6,8 -101+ 1,1 -103+ 7,5 -103+ 9,1 -102+ 8,8 -104
lg
a
Zn2+
--5,00a(Y4-)- 1
+
101^,26-9,50
=1,5-10-1,
lg a
y4-
--0,83.
lg e'ZnY2- -lg вZnY2- +lg aZn2+ +lg a Y4- = 16,50 - 5,00 - 0,83 -10,67До начала титрования
pZn - - lg(C 0,Zn - a Zn2+ ) - - lgC 0,Zn - lg a Zn2+ До точки эквивалентности
1 - f
pZn
-- lg
C0,Zn
- lg a
Zn2+
-
igj+f
Чтобы получить формулу для расчёта величины pZn в точке эквивалентности,воспользуемся выражениемPZnY^ .
в -[ZnY2- ]
ZnY C7n -C
Zn ■^Y
2+
где CZn иCY - общие концентрации, соответственно ионовZn и ЭДТА, образовавшихся при диссоциации комплексаZnY2-.
С учётом того, что в точке эквивалентности CZn = СЭдтА
179
eZnY2-
c2 C Zn
Если принять, что степень диссоциации комплекса ZnY -пренебрежимо мала, то
[ZnY2- ]C°,Zn
1 + f
С учётом того, что [Zn2+ ] -CZna Zn2+:
C
pZn
- -lg
aZn2+
-
P'ZnY2-'(1 + f)
= 2lgP'ZnY2--^«C0,Zn- lgaz„2++ 2lg(l+ f)
Для того чтобы получить формулу для расчёта pZn после точки эквивалентности,также воспользуемся формулой, описывающей условную константу образования комплекса.
f
- 11 + f
0,Y
-
Так как С 0 Zn - С 0 y , то
pZn
- -lg
a
Zn2+
вZnY2- - (1 +f) -C0(f - 1)
= lg e'ZnY2- -lg aZn2+ +lg(f -1) -lg вZnY2- +lg a y4- +lg(f -1)
Формулы для расчёта рZn в различных точках кривой титрования и рассчитанные по ним значения рZn приведены в табл. 15.1. Кривая титрования показана на рис. 15.3.
На величину скачка титрования в комплексонометрии влияют (рис. 15.4):
исходные концентрации титруемого иона и титранта,
устойчивость комплекса катиона металла с ЭДТА,
величины a(Y4-) и a m в условиях титрования.
Молярная доля Y4- зависит от рН, а величинаa м- от концентрации комплексообразующего реагента и устойчивости образующихся комплексов
Табл. 15.1
3 2+
Расчёты для построения кривой титрования 1,0 -wj Мzn^
3 2
1,0-10' М раствором ЭДТА при рН 9,50 в присутствии 5-10' М NH3
|
f |
Расчётная формула |
pZn |
|
0 |
pZn --lgC0,Zn - lgaZn2+ |
8,00 |
|
0,10 |
1-f pZn - lgC0,Zn lgaZn2 +!g_ . Zn 1 + f |
8,09 |
|
0,50 |
аналогично |
8,48 |
|
0,90 |
аналогично |
9,28 |
|
0,99 |
аналогично |
10,3 |
|
0,999 |
аналогично |
11,3 |
|
1,00 |
pZn -hg P'ZnY2-- "~lgC0JZn - lg aZn2 + + ^ + f) |
12,0 |
|
1,001 |
pZn - lg PZnY2- +lg ay4- +lg(f - 1) |
12,7 |
|
1,01 |
аналогично |
13,7 |
|
1,10 |
аналогично |
14,7 |
|
1,50 |
аналогично |
15,4 |
Рис.
15.3.Кривая титрования
1,0 -10
3МZn2+
1,0-10-3М раствором ЭДТА при рН
9,50 в присутствии 5-101МNH3
pM
pM
A
Б
10
8 6 4 2 0
10
8 6 4 2
2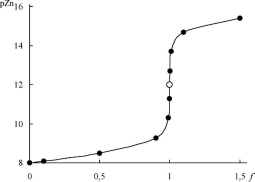
0,0 0,5 1,0 1,5
0,0
0,5 1,0 1,5
f
pM
B
Г
1
10
16
14
12
10
8
6
4
2
8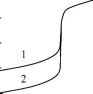
0,5
1,0
1,5
0,0
0,5
1,0
1,5
f
Рис. 15.4.Влияние различных факторов на величину скачка комплексоно- метрического титрования
А- концентрация титруемого иона(pH 10,Ca2) - 1) 1,0 -10-4М; 2) 1,0 -10-2М;
Б -устойчивость комплекса(рН 10, 1,0 -10-2М) - 1)Ca2+, 2)Ba2+;
B - pH (Ca2+, 1,0-10-2 М) - 1)pH 10; 2)pH 7;
Г - концентрация NH3 (рН 9,5, 1,0-10-3 МZn2+) - 1)[NH3] = 1-10-1М; 2)[NH3] = 5-10-2М
Изменение исходной концентрации титруемого вещества и концентрации вспомогательного реагента (а также и рН, если происходит образование гидроксокомплексов металла) влияют на ход кривых титрования до точки эквивалентности, в то время как pH и устойчивость комплекса - после точки эквивалентности.
f
2
При начальной концентрации титруемого катиона 1-10 моль/л и допустимой погрешности < 0,1% минимальная величина условной константы образования комплекса металла с ЭДТА составит
-[MY]
-110
-2-1
108
PMY ТТ- 1-10
CM
-
CY
(1 -10-5)2
Таким образом, комплексонометрическое титрование
110" М
раствора катиона металла с погрешностью □ 0,1% можно провести при таких значениях рН, чтобы величинаlg PMy оставалась большей 8.Например, минимальное значение рН для титрования 1-10-2МCa2+ составляет ~ 7,5, 1-10-2МMg2+ ~ 9,8. Комплексономет- рическое определение таких катионов проводят в щелочной среде. Ионы, образующие очень прочные комплексы с ЭДТА, можно титровать с допустимой погрешностью даже в сильнокислой среде. Например, даже при рН 1,0 величинаlg остаётся равной 9,4. Поскольку уже в слабокислой среде ионы типаBi3+ илиFe3+ образуют гидро- ксокомплексы и малорастворимые гидроксиды, их комплексономет- рическое определение проводится в сильнокислой среде.
Ионы типа Zn2+ илиNi2+ определяют в слабощелочной среде. Для поддерживания определённого значения рН используют аммиачный буферный раствор. Роль буферного раствора заключается не только в создании определённого значения рН, но и в предотвращении выпадения осадков гидроксидов металлов. КонцентрацияNH3 в буферном растворе должна быть такой, чтобы не происходило образование осадка гидроксида металла, но при этом устойчивость комплекса металла с ЭДТА оставалась бы приемлемой для проведения титрования. Например, в присутствии 1,0 МNH3 при рН 10,0lg PZnY2- = 3,30. Комплексонометрическое определениеZn2+ с удовлетворительной погрешностью оказывается невозможным.
15.3.4. Способы обнаружения конечной точки титрования. Металлоиндикаторы
Для обнаружения конечной точки комплексонометрического титрования могут быть использованы визуальные или инструментальные (фотометрия, ионоселективные электроды и др.) методы.
Визуальное обнаружение конечной точки титрования чаще всего проводят с помощью металлоиндикаторов -веществ, изменяющих окраску (или флуоресценцию) в зависимости от концентрации катионов металла в растворе.
эриохром
чёрный Т
мурексид
пирокатехиновый
фиолетовый
ксиленоловый
оранжевый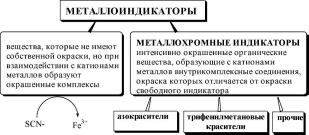
Некоторые металлоиндикаторы, относящиеся ко второй группе, образуют с катионами металлов флуоресцирующие внутрикомплекс- ные соединения. Такие индикаторы называются металлофлуорес- центными.
Эриохром чёрный Т (хромоген чёрный ЕТ 00)- металлохром- ный индикатор из группы азокрасителей. Представляет собой трёхосновную кислоту, однако, на окраску влияет ионизация толькоOH- групп, но не БОзН-группы. Образует окрашенные внутрикомплексные соединения с катионами более 20 металлов.
O2N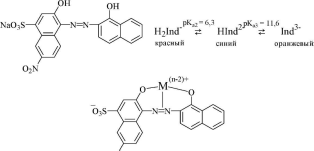
винно-красный или фиолетовый
Эриохром чёрный Т используют для обнаружения конечной точки комплексонометрического титрования катионов различных металлов в щелочных растворах (как правило, при рН 8-10).
В растворах (особенно щелочных) эриохром чёрный Т быстро окисляется кислородом воздуха, поэтому его применяют в виде твёрдого вещества. Поскольку индикатор интенсивно окрашен, его разбавляют NaCl (1:200) и затем приготовленную смесь вносят в титруемый раствор.
Пирокатехиновый фиолетовый- металлоиндикатор из группы сульфофталеиновых красителей. Представляет собой четырёхосновную кислоту. Комплексы с металлами обычно окрашены в синий цвет.
OH OH
3PKa4= 11,7
4
HInd3-
^ Ind4-
SO3H
pKa3
= 9,8
pKal= 0,2 pKa2=7,8 2
H4Ind ^ H3Ind- ^ H2Ind
красно-
пурпурный
синий
Может быть использован для обнаружения конечной точки ком- плексонометрического титрования при различном значении рН, на-
3+ 2+
пример, Bi при рН 2-3,Cu - рН 5-6 (ацетатный буферный раствор),Mg2+, Ni2+, Zn2+ - рН 9-10 (аммиачный буферный раствор).
Ксиленоловый оранжевый- индикатор из группы сульфофталеиновых красителей. Представляет собой шестиосновную кислоту.
Формы H6Ind -H3Ind " окрашены в жёлтый цвет, остальные - в красный. Комплексы с катионами металлов имеют красную или пурпурную окраску. Так же как и пирокатехиновый фиолетовый, ксиленоловый оранжевый может быть использован для обнаружения конечной точки комплексонометрического титрования при различных
3+ 2+
CH2COOH
HOOCH2C
2
N
N
CH2
H2C
CH2COOH
O
"CH3
HOOCH2C
HO
H3C
SO3H
pKal= - 0,2pKa2= 2,62PKa3 = 3,2
H6Ind гH5Ind- гH4Ind2- г
H3Ind
H I d4- PKa5=1 0 ,4 HI d5-PKa6=1 2,4 I d6-
pKa4
= 6,4
3-
O
O
N- >VH
Ж
O NO O NO
I I
HH
PKal
~ 0
pKa2
~ 9
2-
H5Ind
H4Ind-
H3Ind
3pKa4 = 13,54pKa5= 14-14,55
£ H2Ind3- гHInd4- гInd5-
Неионизированная кислота окрашена в жёлтый цвет, моноанион - фиолетовый, дианион - голубой.
Мурексид может образовывать протонированные комплексы разного состава, имеющие различную окраску. Например, комплекс CaH4Ind+ (lgP = 2,6) окрашен в жёлто-оранжевый цвет,CaH3Ind -(lgP = 3,6) - в красно-оранжевый,CaH2Ind- +(lgP = 5,0) - в красный.
Мурексид может играть роль металлохромного индикатора при различных значениях рН. Например, комплексонометрическое определение ионов Cu2+ с данным индикатором проводят при рН 4 (аце-
•2+
татный буферный раствор), Ni - при рН 9-11 (аммиачный буферный раствор),Ca2+ - при рН > 12. В водных растворах мурексид быстро разрушается, поэтому его применяют в виде смеси сNaCl (1:100).
Сущность обнаружения конечной точки комплексонометриче- ского титрования с помощью металлохромного индикатора заключается в следующем. При добавлении индикатора к исходному раствору титруемого катиона металла образуется окрашенный растворимый комплекс. В процессе титрования данного раствора ЭДТА в точке эквивалентности или вблизи неё комплекс катиона металла с индикатором разрушается, и окраска раствора становится такой же, как и у раствора индикатора при данном значении рН.
Для успешного обнаружения конечной точки титрования с помощью металлохромного индикатора необходимо, чтобы:
• комплекс MInd был достаточно устойчив,и его образование происходило бы уже при малых концентрациях индикатора;
устойчивость комплекса MInd была бы меньше устойчивости комплекса данного катиона металла с ЭДТА и такой, чтобы разрушение комплекса MInd происходило в пределах скачка титрования;
комплекс MInd был кинетически лабильным,и его разрушение при взаимодействии с ЭДТА происходило быстро;
окраска комплекса MInd отличалась от окраски свободного индикатора при данном значении рН.
Устойчивость комплексов катионов металлов с индикаторами, так же как и устойчивость комплексов с ЭДТА, удобно описывать с помощью условных констант образования:
_
[MInd]
PMInd
—-—С
M
'
CInd
PMInd _ РMInd 'аInd 'аM
CInd
pC M _lg P MInd +lg
[MInd]
Если принять, что изменение окраски будет заметно, когда концентрация одной из окрашенных форм станет в 10 раз больше, чем другой, то интервал перехода окраски металлохромного индикатора должен находиться в следующем диапазоне величин pC 'м:
pC'm _lg РMInd ± 1
При титровании катионов Ca2+ илиMg2+, не образующих устойчивых аммиачных или гидроксокомплексов, можно считать, что
pM _lg PMInd ± 1
Пример 15.1.Определить возможность использования индикатора эриохрома чёрного Т для обнаружения конечной точки титрования 5,010-2МCa2+ иMg2+ 5,010-2Мраствором ЭДТА при рН 9,50.
При рН 9,50 lg р' о - _ 10,70 - 0,83 _ 9,87. В точке эквивалент-
CaY
ности -
1
? pCa
_ - (9,87 -lg 2,5 • 10-2)
_ 5,74
В нижней и верхней границах скачка титрования:
-21 - 0,999
pCa
_-lg 5,0 • 10-2-lg- _ 4,60
1 + 0,999
pCa _ 9,87 +lg(1,001 -1) _ 6,87 187
7
Величины Ka2 иKa3 индикатора равны, соответственно, 5,0-10" и
ПРЕДМЕТ, ЗАДАЧИ И ОСНОВНЫЕ ПОНЯТИЯ АНАЛИТИЧЕСКОЙ ХИМИИ 3
ХИМИЧЕСКИЕ МЕТОДЫ ОБНАРУЖЕНИЯ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ 9
ХИМИЧЕСКОЕ РАВНОВЕСИЕ В АНАЛИТИЧЕСКОЙ ХИМИИ 25
РАВНОВЕСИЯ К0МПЛЕКС00БРА30ВАНИЯ 76
о 84
РАВНОВЕСИЯ «ОСАДОК-РАСТВОР» 132
p = go = [AB] = P[A][B] = pKg [A][B] L0 S 137
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ 147
РАВНОВЕСИЯ 147
n y n a C 166
В состоянии равновесия AG = 0, AE = 0 и E Ox1 / Red1 = EOx2 / Re d2 168
ПРОБООТБОР И ПР0Б0П0ДГ0Т0ВКА 86
МЕТОДЫ РАЗДЕЛЕНИЯ И КОНЦЕНТРИРОВАНИЯ 98
АНАЛИТИЧЕСКАЯ ХИМИЯ И ХЕМОМЕТРИКА 127
ОБЩАЯ ХАРАКТЕРИСТИКА ТИТРИМЕТРИЧЕСКИХ МЕТОДОВ 187
АНАЛИЗА 187
КИСЛОТНО-ОСНОВНОЕ ТИТРОВАНИЕ 206
КИСЛОТНО-ОСНОВНОЕ ТИТРОВАНИЕ В НЕВОДНЫХ СРЕДАХ 166
КОМПЛЕКСОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ 180
P'ZnY2-' (1 + f) 180
ОСАДИТЕЛЬНОЕ ТИТРОВАНИЕ 202
МЕТОДЫ 212
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОГО 212
ТИТРОВАНИЯ 212
ОБЩАЯ ХАРАКТЕРИСТИКА СПЕКТРОСКОПИЧЕСКИХ МЕТОДОВ АНАЛИЗА 242
АБСОРБЦИОННЫЕ СПЕКТРОСКОПИЧЕСКИЕ МЕТОДЫ АНАЛИЗА 237
ЭМИССИОННЫЕ СПЕКТРОСКОПИЧЕСКИЕ МЕТОДЫ АНАЛИЗА 277
ГАЗОВАЯ ХРОМАТОГРАФИЯ 292
ЖИДКОСТНАЯ ХРОМАТОГРАФИЯ 302
ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕКТРОХИМИЧЕСКИХ МЕТОДОВ АНАЛИЗА. КОНДУКГОМЕТРИЯ 331
ВОЛЬТАМПЕРОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА 346
ОГЛАВЛЕНИЕ 368
[H3O+]2+ Ка2[H3O+]
+ К
a2Ka3
12•10-18_
7,5 • 10
-3
1,0 • 10 -19+1,6 • 10-16+1,2 • 10-18
lg a(Ind3-) _ 2,1lg p'CaInd- _ 5,4 - 2,1 _ 3,3
Переход окраски будет происходить в диапазоне pCa 2,3 - 4,3. Таким образом, при попытке обнаружить конечную точку титрования с помощью эриохрома чёрного Т раствор окажется недотитрованным. При рН 9,50lgPMgY2- _ 8,7 - 0,83 _ 7,9. В точке эквивалентно-
2+
сти величина pMg будет равна 4,75. Для комплекса ионаMg lg Р' _ 7,0 - 2,1 _ 4,9. Точка эквивалентности будет находиться почти в
середине интервала перехода индикатора (3,9 - 5,9). Следовательно,
эриохром чёрный может быть использован для обнаружения конечной
2 2+
точки комплексонометрического титрования 540" М Mg .15.3.5. Индикаторные погрешности
Переход окраски металлохромного индикатора может происходить раньше наступления эквивалентности либо позже его. Первое приведёт к возникновению отрицательной систематической индикаторной погрешности, а второе - положительной. Величина индикаторной погрешности равна разности между величиной степени оттит- рованности, при которой заканчивается титрование, и величиной степени оттитрованности, соответствующей достижению эквивалентности (т.е. f = 1).
Представим себе, что конечная точка титрования наступила раньше точки эквивалентности. В растворе остались неоттитрованные катионы металла. Концентрация этих ионов будет равна сумме концентраций катионов металла, которым «не хватило» титранта, и катионов металла, образовавшихся при диссоциации комплекса. Концентрация последних будет равна общей концентрации аниона ЭДТА, образовавшегося при диссоциации комплекса.
CM _ C0,M(1 - f)+ CY
0,М
С'
YC[MY]
c'm• P'mycМ • P'mmy
0,M
С'м - c0,m(1- f) + с—в—
C
M
C1•100%
c'm pi
MY
C
0,M
При
выводе формулы для расчёта положительной
индикаторной погрешности предполагается,
что
0,M
M
M
с'м
•
P'myC=
C0,'(f
-1)
+
C
M
C1•100%
с'м Pi
MY
0,M
C
Пример 15.2.Рассчитать систематическую индикаторную по-
3 2+ 2
грешность титрования 1,010' М Zn 510' Мраствором ЭДТА при рН 9,50 и в присутствии аммиачного буферного раствора, в котором[NH3] = 510 М,
если для обнаружения конечной точки титрования используется эриохром чёрный Т.
При
построении кривой титрования мы
рассчитали, что величина lg
вznY2"
=
10,67. В точке эквивалентности величина
pCZn
будет
равна
2-
ZnY1pCZn
-
^(lgв'-
lgC0,Zn)
-
2 (10,67 - lg
1,0
• 10-3
)= 6,84;
C'Zn
-1,4
• 10-7
моль/л
lg
в;
т
,- - lg
в^
т
Л- + lg
а
л3-
+ lg
2+
-12,9 - 2,1 - 5,0 - 5,8
ZnInd ZnInd Ind3Zn2
Переход
окраски индикатора будет происходить
в интервале значений pCZn
равном
5,8±1. При pCZn
=
6,8 CZn=
1,6-10-7
моль/л.
Верхняя
граница интервала перехода окраски
почти совпадает с точкой эквивалентности,
поэтому в данном случае титрование
следует заканчивать не при первых
признаках изменения окраски индикатора,
а, наоборот, тогда, когда окраска его
перестанет изменяться. Для того чтобы
это было проще определить, рекомендуется
провести кон
трольный
опыт и затем титровать до того момента,
пока окраска титруемого
раствора и окраска контрольного раствора
не станут одинаковыми. Величина
индикаторной погрешности будет равна
' 1,6 • 10 -7
3
л1100%
- 3 • 10-3%4,7
• 1010
Титранты и стандартные вещества
Этилендиаминтетрауксусная
кислота малорастворима в воде, поэтому
в качестве титранта используют её
динатриевую соль - Na2H2Y-2H2O,
называемую
трилоном Б, динатрия эдетатом и т.д. Для
динатриевой соли соли этилендиаминтетрауксусной
кислоты допускается такая же
аббревиатура, как и для самой кислоты
- ЭДТА. Растворимость Na2H2Y-2H2O
в
воде при 20 °С составляет примерно 0,3
моль/л. В титриметрии чаще всего
используют 0,05 М растворы этого вещества.
Поскольку любые определяемые катионы металла и ЭДТА всегда взаимодействуют друг с другом в молярном соотношении 1:1 использование понятия «эквивалент» в комплексонометрии не имеет смысла.
Стандартные
растворы ЭДТА могут быть как первичными,
так и вторичными. Для получения первичного
стандартного вещества очищенный
образец Na2H2Y-2H2O
высушивают
в течение нескольких дней при температуре
80 °С и относительной влажности 50%. Чаще
стандартные растворы ЭДТА готовят
вначале с приблизительной концентрацией,
а затем проводят стандартизацию с
помощью различных металлов (Zn,
Bi, Fe и
др.), которые растворяют в кислоте, а
также CaCO3,
железоаммонийных
квасцов и т.д.
Способы комплексонометрического титрования и его применение
При
прямом титровании
определяемое вещество титруют стандартным
раствором ЭДТА в присутствии
соответствующего индикатора. Таким
способом определяют катионы более 30
металлов, образующие достаточной
устойчивые и кинетически лабильные
комплексы с ЭДТА, для обнаружения
конечной точки титрования которых
имеется подходящий индикатор. В
фармацевтическом анализе прямое
комплексонометрическое титрование
используется для определения ZnO,
ZnSO4,
CaCl2,
CaCO3,
соединений
висмута и др.
Обратное
комплексонометрическое титрование
проводят в тех случаях, когда реакция
определяемого катиона с ЭДТА протекает
медленно (это характерно, например, для
Cr3+,
Со3+,
Al3+),
либо
в растворе присутствуют анионы,
взаимодействующие с определяемым ка-
2+
2 тионом
(например, определение Pb
в
присутствие SO42-),
либо
если
прямое
титрование невозможно из-за отсутствия
подходящего индикатора (например,
для Sb(V)).
К
раствору определяемого вещества
добавляют точное количество взятого
в избытке стандартного раствора ЭДТА.
Если реакция между определяемым ионом
и титрантом протекает медленно, смесь
нагревают. Затем добавляют необходимые
вспомогательные реагенты для создания
определённого значения рН и титруют
непрореагиро- вавший ЭДТА стандартным
раствором соли металла, устойчивость
комплекса которого с ЭДТА меньше (по
крайне мере, на 8 порядков), чем у
комплекса, образуемого определяемым
катионом. В качестве
такого
титранта часто используют MgSO4,
поскольку
устойчивость
2-
комплекса
MgY
"
достаточно невелика. Если определяемый
катион образует с ЭДТА инертный комплекс,
то избыток ЭДТА можно титровать
стандартным раствором соли металла,
образующим хотя и более устойчивый,
но более лабильный комплекс. Например,
при опре-
3+
делении
Al
избыток
ЭДТА можно титровать стандартным
раствором
2+
2+ - 2- Zn
или
Pb
,
несмотря на то что lgP(AlY)
=
16,13, а lgP
ZnY "
и
2-
PbY
"
равны, соответственно, 16,50 и 18,0.
Титрование
заместителя,
более редкий вариант комплексоно-
метрического титрования, может быть
использовано в случае отсутствия
индикатора, подходящего для прямого
титрования. К раствору, содержащему
определяемый ион, прибавляют избыток
комплексоната другого металла (чаще
всего Mg2+
или
Zn2+),
образующего
при условиях, в которых проводится
титрование, менее прочный комплекс с
ЭДТА, чем определяемый катион. Комплексонат
металла (в данном случае магния) реагирует
с определяемым катионом:
Mn+
+
MgY2-
^
MY(n-4)+
+
Mg2+
Выделившиеся
катионы металла титруют стандартным
раствором ЭДТА с соответствующим
индикатором.
Титрование
заместителя используют, например, при
комплексо- нометрическом определении
катионов Ba2+,
прямое
титрование которых провести сложно
из-за отсутствия подходящего индикатора.
Определение проводится в присутствии
аммиачного буферного раствора. К
раствору, содержащему Ba2+,
добавляют
комплексонат цинка, и выделившиеся
катионы Zn2+
титруют
стандартным раствором ЭДТА. Реальная
константа образования комплекса ZnY2-
больше,
чем у BaY2-,
но
из-за того, что ионы Zn2+
образуют
аммиачные комплексы, а ионы Ba2+
нет,
в присутствии NH3
устойчивость
комплекса ZnY2-
может
понизиться настолько, что
В
' w2-
станет
меньше, чем
В
' w2_
.
' ZnY2' "BaY2
Косвенное
комплексонометрическое титрование
используется для определения
катионов, образующих очень непрочные
комплексы с ЭДТА (катионы щелочных
металлов), либо анионов. Кроме того,
такой способ титрования может быть
применён для определения органических
веществ, образующих соединения (как
правило, малорастворимые в воде) с
катионами металлов либо с комплексными
анионами: [Cdl4]2-,
[Zn(SCN)4]2-
и
др.
Известно
два варианта косвенного комплексонометрического
титрования. В первом варианте к раствору
определяемого вещества добавляют
точное количество взятого в избытке
стандартного раствора реагирующего
с ним соединения металла, который можно
определить с помощью ЭДТА. Образующийся
осадок удаляют и определяют избыток
металла, не вступившего в реакцию, путём
титрования его стандартным раствором
ЭДТА.
титруют
ЭДТА
отфильтровывают
I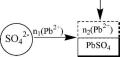
n(SO42-)
=
n1
-
n2
Второй
вариант косвенного комплексонометрического
определения отличается от первого
тем, что образовавшийся осадок
количественно отделяют от раствора,
растворяют в соответствующих условиях
и определяют комплексонометрически
количество ионов металла, содержавшееся
в данном осадке.
H
+