
- •Аналитическая химия
- •Часть 1
- •Isbn 985-466-015-х
- •Раздел 1
- •Глава 1
- •Разложение пробы
- •1.3. Виды анализа
- •Экстракционная фотометрия
- •Глава 2
- •2.1. Аналитические реакции
- •2.2. Систематический и дробный анализ
- •Комплексообразование
- •2.3. Общая характеристика, классификация и способы обнаружения катионов
- •2.4. Общая характеристика, классификация и способы обнаружения анионов
- •Глава 3
- •3.1. Общая характеристика химического равновесия. Константа химического равновесия
- •3.2. Активность и коэффициент активности
- •3.3. Отклонения от идеальности в растворах сильных электролитов
- •3.4. Виды констант химического равновесия, используемые в аналитической химии
- •3.5. Общие принципы расчёта состава равновесных систем
- •Глава 4
- •4.1. Важнейшие теории кислот и оснований
- •4.2. Количественное описание силы кислот и оснований
- •4.3. Влияние растворителя на кислотно-основные свойства растворённого вещества
- •4.4. Нивелирующее и дифференцирующее действие растворителя. Сильные и слабые кислоты и основания
- •4.5. Расчёт рН водных растворов различных прото- литов
- •4.6. Расчёт состава равновесных смесей протолитов при заданном значении рН
- •4.7. Кислотно-основные буферные растворы
- •Глава 5
- •5.1. Понятие о комплексном соединении
- •5.2. Классификация комплексных соединений
- •5.3. Равновесия в растворах комплексных соединений
- •Общая константа образования
- •5.4. Влияние различных факторов на комплексообразование в растворах
- •5.5. Применение органических реагентов в аналитической химии
- •Лиганды с одним типом донорных атомов о,о-лиганды
- •Шестичленные циклы
- •Органические реагенты
- •6.1. Произведение растворимости малорастворимого электролита
- •Глава 6
- •6.2. Растворимость
- •6.3. Влияние различных факторов на растворимость
- •6.4. Общие принципы растворения осадков малорастворимых электролитов
- •Глава 7
- •7.1. Общая характеристика окислительно-восстановительных реакций
- •7.2. Количественная оценка окислительно-восстановительной способности веществ
- •7.3. Влияние различных факторов на протекание окислительно-восстановительных реакций
- •Глава 8
- •8.1. Отбор пробы
- •Анализируемым образец
- •I эмпирический
- •Генеральная проба
- •Лабораторная проба
- •8.2. Разложение пробы
- •9.1. Общая характеристика и классификация
- •Глава 9
- •9.2. Жидкость - жидкостная экстракция
- •Реэкстракт
- •Реэкстракция
- •Сложные эфиры фосфорной кислоты, фосфоновых, фосфиновых кислот, фосфиноксиды, сульфоксиды, диантипирилметан
- •Третичные амины, четвертичные аммониевые соли, соли тетрафениларсония и тетрафенилфосфония.
- •Глава 10
- •10.1. Приближённые вычисления и значащие цифры
- •3 Значащие цифры
- •1 Значащая цифра
- •10.2. Понятие об аналитическом сигнале
- •10.3. Методы расчёта концентрации вещества по величине аналитического сигнала
- •10.4. Неопределённость и погрешности измерений
- •10.5. Некоторые основные положения математической статистики, используемые в аналитической химии
- •10.6. Пример статистической обработки результатов измерений. Исключение промахов
- •10.7. Основные характеристики методики анализа
- •Раздел 2
- •Глава 11
- •11.3. Понятие о механизме образования осадка
- •11.4. Коллоидная стадия образования осадка
- •11.5. Причины загрязнения осадка и способы их устранения
- •11.6. Основные этапы методики гравиметрического определения методом осаждения
- •11.7. Гравиметрия в фармацевтическом анализе
- •Глава 12 общая характеристика титриметрических методов анализа
- •12.1. Основные понятия титриметрии
- •Исчезновение окраски фенолфталеина
- •Появление розовой окраски раствора
- •12.2. Классификация титриметрических методов анализа и способов титрования
- •12.3. Стандартные растворы и стандартные вещества
- •12.4. Расчёты, связанные с приготовлением растворов титрантов и титрованием
- •Vисх_mрисх_m(hCl) _n(hCl) - m(hCl) _c(hCl) - V - m(hCl) _p _ra(hCl) -p_ ra(hCl) -p _p-ra(hCl)
- •Глава 13 кислотно-основное титрование
- •13.1. Титранты и стандартные вещества
- •13.2. Обнаружение конечной точки титрования. Кислотно-основные индикаторы
- •13.3. Кривые титрования
- •13.4. Факторы, влияющие на величину скачка титрования
- •0,1МNaOh (1), 0,001мhCl 0,001мNaOh (2) и или основания (рис. 13.4).
- •0,1МhCl 0,1мNaOh (3)Прямое титрование таких
- •13.5. Погрешности титрования
- •13.6. Некоторые случаи практического применения кислотно-основного титрования в водных растворах
- •Глава 14 кислотно-основное титрование в неводных средах
- •14.3. Применение в фармацевтическом анализе
- •Глава 15 комплексометрическое титрование
- •15.1. Общая характеристика
- •15.2. Меркуриметрическое титрование
- •Ind HgInd фиолетовый Ind жёлтыйHg[Fe(cn)sNo]
- •15.3. Комплексонометрическое титрование
- •Глава 16
- •16.3. Меркурометрическое титрование
- •Глава 17
- •17.1. Общая характеристика и классификация
- •17.2. Кривые титрования
- •17.3. Способы обнаружения конечной точки титрования. Окислительно-восстановительные индикаторы
- •Глава 18
- •18.1. Иодометрическое титрование
- •18.2. Хлориодометрическое титрование
- •18.3. Иодатометрическое титрование
- •18.4. Броматометрическое титрование
- •18.5. Нитритометрическое титрование
- •I" крахмал избыток NaNo2 i4
- •18.6. Перманганатометрическое титрование
- •18.8. Дихроматометрическое титрование
- •18.8. Цериметрическое титрование
- •Раздел 3
- •Глава 19
- •19.1. Природа и свойства электромагнитного излучения
- •19.2. Классификация спектроскопических методов анализа
- •Глава 20
- •20.2. Отклонения от основного закона светопоглощения
- •20.3. Атомно-абсорбционная спектроскопия
- •20.4. Молекулярная абсорбционная спектроскопия в уф- и видимой области
- •Сурьмяно-цезиевый фотоэлемент кислородно-цезиевый фотоэлемент
- •20.4.3. Практическое применение и основные приёмы фотометрического анализа
- •Измерение светопоглощения хлороформного экстракта
- •Метод отношения пропусканий
- •Метод предельной точности
- •20.5.1. Процессы, приводящие к появлению аналитического сигнала
- •20.5.2. Общая характеристика ик-спектров
- •20.5.3. Измерение аналитического сигнала
- •20.5.4. Практическое применение
- •Глава 21 эмиссионные спектроскопические методы анализа
- •21.1. Атомно-эмиссионная спектроскопия
- •21.1.1. Процессы, приводящие к появлению аналитического сигнала
- •21.1.2. Измерение аналитического сигнала
- •Пламенная фотометрия
- •3000-7000 °C невысокая воспроизводимостьтолько щелочные, щелочноземельные металлы и т.П.
- •Фотоэлементы, фотоумножители, фотодиоды
- •21.1.3. Практическое применение
- •20.2. Люминесцентная спектроскопия
- •20.2.1 Классификация видов люминесценции
- •21.2.2 Механизм молекулярной фотолюминесценции. Флуоресценция и фосфоресценция
- •21.2.3 Основные характеристики и закономерности люминесценции
- •21.2.4. Влияние различных факторов на интенсивность флуоресценции растворов
- •21.2.5. Измерение аналитического сигнала
- •21.2.6. Практическое применение и основные приёмы люминесцентного анализа
- •Рибофлавин офлоксацин
- •Глава 22 общая характеристика и теоретические основы хроматографических методов анализа
- •22.1. Общая характеристика
- •22.2. Классификация хроматографических методов
- •Агрегатное состояние подвижной фазы
- •22.3. Хроматографические параметры
- •22.4. Теории хроматографического разделения
- •Глава 23
- •Сорбент помещают внутрь колонки
- •23.3. Особенности газотвёрдофазной хроматографии
- •23.4. Особенности газожидкостной хроматографии
- •23.5. Индексы удерживания Ковача
- •23.6. Практическое применение
- •Глава 24
- •Жидкостная хроматография
- •24.1. Общая характеристика
- •24.2. Плоскостная хроматография
- •Плоскостная хроматография
- •24.2.1. Методика получения плоскостной хроматограммы
- •24.2.2. Анализ плоскостной хроматограммы
- •24.2.3. Практическое применение
- •24.3. Колоночная жидкостная хроматография
- •24.3.1. Устройство жидкостного хроматографа
- •Ввод пробы
- •24.3.2. Практическое применение
- •24.4. Характеристика отдельных видов жидкостной хроматографии
- •24.4.1. Ионообменная хроматография
- •Сильнокислотные
- •24.4.2. Эксклюзионная хроматография
- •Глава 25 общая характеристика электрохимических методов анализа. Кондукгометрия
- •25.1. Основные понятия, связанные с электрохимическими методами анализа
- •25.2. Классификация электрохимических методов анализа
- •25.3. Кондуктометрия
- •25.3.1. Теоретические основы и классификация
- •25.3.2. Измерение аналитического сигнала
- •25.3.4. Практическое применение
- •25.3.5. Понятие о высокочастотной кондуктометрии
- •Глава 26 потенциометрический и кулонометрический методы анализа
- •26.1. Потенциометрический метод анализа
- •26.1.1. Общая характеристика и классификация
- •26.1.3. Индикаторные электроды
- •Первичные ионоселективные электроды
- •Электроды с подвижными носителями
- •Имеют жидкую мембрану -
- •26.1.4. Прямая потенциометрия
- •26.1.5. Потенциометрическое титрование
- •26.2. Кулонометрический метод анализа
- •26.2.1. Общая характеристика и классификация
- •26.2.2. Прямая кулонометрия
- •26.2.3. Кулонометрическое титрование
- •Глава 27 вольтамперометрический метод анализа
- •27.1. Принцип измерения аналитического сигнала.
- •27.2. Вольтамперограмма
- •Максимум второго рода
- •Максимум первого рода
- •27.3. Некоторые современные разновидности вольт- амперометрии
- •27.4. Практическое применение вольтамперометрии. Амперометрическое титрование
Глава 5
РАВНОВЕСИЯ К0МПЛЕКС00БРА30ВАНИЯ
5.1. Понятие о комплексном соединении
Чаще всего комплексомназывают частицу, образованную в результате донорно-акцепторного взаимодействия атома (иона), называемого центральным атомом (ионом), или комплексообразовате- лем, и заряженных или нейтральных частиц (лигандов). Комплексо- образователь и лиганды должны быть способны к самостоятельному существованию в среде, где происходит реакция комплексообразо- вания.
комплексообразователь лиганды
i I
K3[Fe(CN)6]
ПРЕДМЕТ, ЗАДАЧИ И ОСНОВНЫЕ ПОНЯТИЯ АНАЛИТИЧЕСКОЙ ХИМИИ 3
ХИМИЧЕСКИЕ МЕТОДЫ ОБНАРУЖЕНИЯ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ 9
ХИМИЧЕСКОЕ РАВНОВЕСИЕ В АНАЛИТИЧЕСКОЙ ХИМИИ 25
РАВНОВЕСИЯ К0МПЛЕКС00БРА30ВАНИЯ 76
о 84
РАВНОВЕСИЯ «ОСАДОК-РАСТВОР» 126
p = go = [AB] = P[A][B] = pKg [A][B] L0 S 131
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ 141
РАВНОВЕСИЯ 141
n y n a C 160
В состоянии равновесия AG = 0, AE = 0 и E Ox1 / Red1 = EOx2 / Re d2 162
ПРОБООТБОР И ПР0Б0П0ДГ0Т0ВКА 86
МЕТОДЫ РАЗДЕЛЕНИЯ И КОНЦЕНТРИРОВАНИЯ 98
АНАЛИТИЧЕСКАЯ ХИМИЯ И ХЕМОМЕТРИКА 127
ОБЩАЯ ХАРАКТЕРИСТИКА ТИТРИМЕТРИЧЕСКИХ МЕТОДОВ 187
АНАЛИЗА 187
КИСЛОТНО-ОСНОВНОЕ ТИТРОВАНИЕ 206
КИСЛОТНО-ОСНОВНОЕ ТИТРОВАНИЕ В НЕВОДНЫХ СРЕДАХ 166
КОМПЛЕКСОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ 180
P'ZnY2-' (1 + f) 180
ОСАДИТЕЛЬНОЕ ТИТРОВАНИЕ 201
МЕТОДЫ 212
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОГО 212
ТИТРОВАНИЯ 212
ОБЩАЯ ХАРАКТЕРИСТИКА СПЕКТРОСКОПИЧЕСКИХ МЕТОДОВ АНАЛИЗА 242
АБСОРБЦИОННЫЕ СПЕКТРОСКОПИЧЕСКИЕ МЕТОДЫ АНАЛИЗА 237
ЭМИССИОННЫЕ СПЕКТРОСКОПИЧЕСКИЕ МЕТОДЫ АНАЛИЗА 277
ГАЗОВАЯ ХРОМАТОГРАФИЯ 292
ЖИДКОСТНАЯ ХРОМАТОГРАФИЯ 302
ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕКТРОХИМИЧЕСКИХ МЕТОДОВ АНАЛИЗА. КОНДУКГОМЕТРИЯ 331
ВОЛЬТАМПЕРОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА 346
ОГЛАВЛЕНИЕ 368
(комплексная частица)
Реакцию комплексообразования можно рассматривать как реакцию взаимодействия кислоты и основания Льюиса.

Mn++ L-г ML(n-1)+
\ t
комплексообразователь лиганд
(кислота Льюиса) (основание Льюиса)
Количественной характеристикой способности комплексообра- зователя и лиганда участвовать в донорно-акцепторном взаимодействии при образовании комплексной частицы являются, соответственно, координационное число и дентатность.
Дентатностью лиганданазывается число донорных центров (неподелённых электронных пар либо п-связей) лиганда, участвующих в донорно-акцепторном взаимодействии при образовании комплексной частицы.
Лиганды бывают:
монодентатными(СГ,H2O, NH3),
2
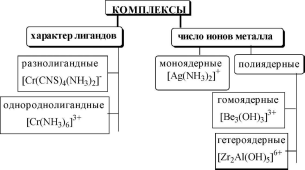
5.2. Классификация комплексных соединений
бидентатными(C2O4
", этилендиамин, 1,10-фенантролин)полидентатными.
! OOC^CH^.v, ,-.-.>CH2^COO!
WcHrcHi-Nxiг-------™;
! OO^rCH^" CH^COO ji ; i '
гексадентатный лиганд
Координационным числомназывается число донорных центров лигандов, с которыми взаимодействует данный центральный атом (ион).
комплексы
с монодентатными лигандами
комплексы
с полидентатными лигандами
КЧ
= число лигандов
КЧ
= число лигандов • дентатность
[Ag(NH3)2]+[Ag^Os^]3-
I
/ I/
КЧ
= 2 КЧ
= 2 - 2=4
у
Ag+
максимальноеКЧ равно 4,характеристическоедля аммиачных комплексов - 2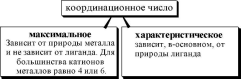
HgCl2
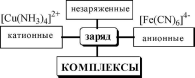
Соединения, образующиеся при взаимодействии насыщенных по координационному числу внутрисферных комплексов и любых частиц, находящихся во внешней сфере, называются внешнесферными комплексами.
Например (внутрисферные комплексные частицы выделены полужирным шрифтом):
[(C4H9)N4]2[Co(SCN)4]; [Ba(OH)d •RSO3; ^d^he^^^^O^, (phen - фенантролин); / +\
[SbCl6]-
fll
При образовании внешнесферного комплекса центральный ион не образует новой химической связи, взаимодействие происходит между лигандами внутренней сферы и частицами внешней сферы. Внешнесферные комплексы отличаются от обычных ионных пар (ионных ассоциатов) тем, что последние образуются в результате только электростатического взаимодействия полностью или частично сольватированных ионов, в то время как при образовании внешне- сферных комплексов происходит образование ковалентной связи, водородной связи, имеет место ион-дипольное, гидрофобное взаимодействие и др.
Циклические комплексные соединения катионов металлов с по- лидентатными лигандами (обычно органическими), в которых центральный ион металла входит в состав одного или нескольких циклов, называются хелатами.
H
H
H
H
\
/
2+
HH
ON
^
/с\ ^
NO
H H
O
/
N
N
V
7
/с\
NN
/ \ / \
H
H H H
O
!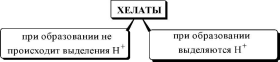
внутрикомплексные соединения
Ковалентные связи, образованные по донорно-акцепторному механизму, часто обозначают стрелкой показывающей переход электронов от донорно- го центра лиганда к иону металла. Поскольку такие связи ничем не отличаются от обычных ковалентных связей, то их можно обозначать и простой чёрточкой.
