
- •Аналитическая химия
- •Часть 1
- •Isbn 985-466-015-х
- •Раздел 1
- •Глава 1
- •Разложение пробы
- •1.3. Виды анализа
- •Экстракционная фотометрия
- •Глава 2
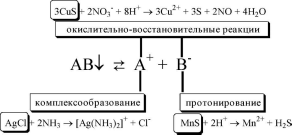
- •2.1. Аналитические реакции
- •2.2. Систематический и дробный анализ
- •Комплексообразование
- •2.3. Общая характеристика, классификация и способы обнаружения катионов
- •2.4. Общая характеристика, классификация и способы обнаружения анионов
- •Глава 3
- •3.1. Общая характеристика химического равновесия. Константа химического равновесия
- •3.2. Активность и коэффициент активности
- •3.3. Отклонения от идеальности в растворах сильных электролитов
- •3.4. Виды констант химического равновесия, используемые в аналитической химии
- •3.5. Общие принципы расчёта состава равновесных систем
- •Глава 4
- •4.1. Важнейшие теории кислот и оснований
- •4.2. Количественное описание силы кислот и оснований
- •4.3. Влияние растворителя на кислотно-основные свойства растворённого вещества
- •4.4. Нивелирующее и дифференцирующее действие растворителя. Сильные и слабые кислоты и основания
- •4.5. Расчёт рН водных растворов различных прото- литов
- •4.6. Расчёт состава равновесных смесей протолитов при заданном значении рН
- •4.7. Кислотно-основные буферные растворы
- •Глава 5
- •5.1. Понятие о комплексном соединении
- •5.2. Классификация комплексных соединений
- •5.3. Равновесия в растворах комплексных соединений
- •Общая константа образования
- •5.4. Влияние различных факторов на комплексообразование в растворах
- •5.5. Применение органических реагентов в аналитической химии
- •Лиганды с одним типом донорных атомов о,о-лиганды
- •Шестичленные циклы
- •Органические реагенты
- •6.1. Произведение растворимости малорастворимого электролита
- •Глава 6
- •6.2. Растворимость
- •6.3. Влияние различных факторов на растворимость
- •6.4. Общие принципы растворения осадков малорастворимых электролитов
- •Глава 7
- •7.1. Общая характеристика окислительно-восстановительных реакций
- •7.2. Количественная оценка окислительно-восстановительной способности веществ
- •7.3. Влияние различных факторов на протекание окислительно-восстановительных реакций
- •Глава 8
- •8.1. Отбор пробы
- •Анализируемым образец
- •I эмпирический
- •Генеральная проба
- •Лабораторная проба
- •8.2. Разложение пробы
- •9.1. Общая характеристика и классификация
- •Глава 9
- •9.2. Жидкость - жидкостная экстракция
- •Реэкстракт
- •Реэкстракция
- •Сложные эфиры фосфорной кислоты, фосфоновых, фосфиновых кислот, фосфиноксиды, сульфоксиды, диантипирилметан
- •Третичные амины, четвертичные аммониевые соли, соли тетрафениларсония и тетрафенилфосфония.
- •Глава 10
- •10.1. Приближённые вычисления и значащие цифры
- •3 Значащие цифры
- •1 Значащая цифра
- •10.2. Понятие об аналитическом сигнале
- •10.3. Методы расчёта концентрации вещества по величине аналитического сигнала
- •10.4. Неопределённость и погрешности измерений
- •10.5. Некоторые основные положения математической статистики, используемые в аналитической химии
- •10.6. Пример статистической обработки результатов измерений. Исключение промахов
- •10.7. Основные характеристики методики анализа
- •Раздел 2
- •Глава 11
- •11.3. Понятие о механизме образования осадка
- •11.4. Коллоидная стадия образования осадка
- •11.5. Причины загрязнения осадка и способы их устранения
- •11.6. Основные этапы методики гравиметрического определения методом осаждения
- •11.7. Гравиметрия в фармацевтическом анализе
- •Глава 12 общая характеристика титриметрических методов анализа
- •12.1. Основные понятия титриметрии
- •Исчезновение окраски фенолфталеина
- •Появление розовой окраски раствора
- •12.2. Классификация титриметрических методов анализа и способов титрования
- •12.3. Стандартные растворы и стандартные вещества
- •12.4. Расчёты, связанные с приготовлением растворов титрантов и титрованием
- •Vисх_mрисх_m(hCl) _n(hCl) - m(hCl) _c(hCl) - V - m(hCl) _p _ra(hCl) -p_ ra(hCl) -p _p-ra(hCl)
- •Глава 13 кислотно-основное титрование
- •13.1. Титранты и стандартные вещества
- •13.2. Обнаружение конечной точки титрования. Кислотно-основные индикаторы
- •13.3. Кривые титрования
- •13.4. Факторы, влияющие на величину скачка титрования
- •0,1МNaOh (1), 0,001мhCl 0,001мNaOh (2) и или основания (рис. 13.4).
- •0,1МhCl 0,1мNaOh (3)Прямое титрование таких
- •13.5. Погрешности титрования
- •13.6. Некоторые случаи практического применения кислотно-основного титрования в водных растворах
- •Глава 14 кислотно-основное титрование в неводных средах
- •14.3. Применение в фармацевтическом анализе
- •Глава 15 комплексометрическое титрование
- •15.1. Общая характеристика
- •15.2. Меркуриметрическое титрование
- •Ind HgInd фиолетовый Ind жёлтыйHg[Fe(cn)sNo]
- •15.3. Комплексонометрическое титрование
- •Глава 16
- •16.3. Меркурометрическое титрование
- •Глава 17
- •17.1. Общая характеристика и классификация
- •17.2. Кривые титрования
- •17.3. Способы обнаружения конечной точки титрования. Окислительно-восстановительные индикаторы
- •Глава 18
- •18.1. Иодометрическое титрование
- •18.2. Хлориодометрическое титрование
- •18.3. Иодатометрическое титрование
- •18.4. Броматометрическое титрование
- •18.5. Нитритометрическое титрование
- •I" крахмал избыток NaNo2 i4
- •18.6. Перманганатометрическое титрование
- •18.8. Дихроматометрическое титрование
- •18.8. Цериметрическое титрование
- •Раздел 3
- •Глава 19
- •19.1. Природа и свойства электромагнитного излучения
- •19.2. Классификация спектроскопических методов анализа
- •Глава 20
- •20.2. Отклонения от основного закона светопоглощения
- •20.3. Атомно-абсорбционная спектроскопия
- •20.4. Молекулярная абсорбционная спектроскопия в уф- и видимой области
- •Сурьмяно-цезиевый фотоэлемент кислородно-цезиевый фотоэлемент
- •20.4.3. Практическое применение и основные приёмы фотометрического анализа
- •Измерение светопоглощения хлороформного экстракта
- •Метод отношения пропусканий
- •Метод предельной точности
- •20.5.1. Процессы, приводящие к появлению аналитического сигнала
- •20.5.2. Общая характеристика ик-спектров
- •20.5.3. Измерение аналитического сигнала
- •20.5.4. Практическое применение
- •Глава 21 эмиссионные спектроскопические методы анализа
- •21.1. Атомно-эмиссионная спектроскопия
- •21.1.1. Процессы, приводящие к появлению аналитического сигнала
- •21.1.2. Измерение аналитического сигнала
- •Пламенная фотометрия
- •3000-7000 °C невысокая воспроизводимостьтолько щелочные, щелочноземельные металлы и т.П.
- •Фотоэлементы, фотоумножители, фотодиоды
- •21.1.3. Практическое применение
- •20.2. Люминесцентная спектроскопия
- •20.2.1 Классификация видов люминесценции
- •21.2.2 Механизм молекулярной фотолюминесценции. Флуоресценция и фосфоресценция
- •21.2.3 Основные характеристики и закономерности люминесценции
- •21.2.4. Влияние различных факторов на интенсивность флуоресценции растворов
- •21.2.5. Измерение аналитического сигнала
- •21.2.6. Практическое применение и основные приёмы люминесцентного анализа
- •Рибофлавин офлоксацин
- •Глава 22 общая характеристика и теоретические основы хроматографических методов анализа
- •22.1. Общая характеристика
- •22.2. Классификация хроматографических методов
- •Агрегатное состояние подвижной фазы
- •22.3. Хроматографические параметры
- •22.4. Теории хроматографического разделения
- •Глава 23
- •Сорбент помещают внутрь колонки
- •23.3. Особенности газотвёрдофазной хроматографии
- •23.4. Особенности газожидкостной хроматографии
- •23.5. Индексы удерживания Ковача
- •23.6. Практическое применение
- •Глава 24
- •Жидкостная хроматография
- •24.1. Общая характеристика
- •24.2. Плоскостная хроматография
- •Плоскостная хроматография
- •24.2.1. Методика получения плоскостной хроматограммы
- •24.2.2. Анализ плоскостной хроматограммы
- •24.2.3. Практическое применение
- •24.3. Колоночная жидкостная хроматография
- •24.3.1. Устройство жидкостного хроматографа
- •Ввод пробы
- •24.3.2. Практическое применение
- •24.4. Характеристика отдельных видов жидкостной хроматографии
- •24.4.1. Ионообменная хроматография
- •Сильнокислотные
- •24.4.2. Эксклюзионная хроматография
- •Глава 25 общая характеристика электрохимических методов анализа. Кондукгометрия
- •25.1. Основные понятия, связанные с электрохимическими методами анализа
- •25.2. Классификация электрохимических методов анализа
- •25.3. Кондуктометрия
- •25.3.1. Теоретические основы и классификация
- •25.3.2. Измерение аналитического сигнала
- •25.3.4. Практическое применение
- •25.3.5. Понятие о высокочастотной кондуктометрии
- •Глава 26 потенциометрический и кулонометрический методы анализа
- •26.1. Потенциометрический метод анализа
- •26.1.1. Общая характеристика и классификация
- •26.1.3. Индикаторные электроды
- •Первичные ионоселективные электроды
- •Электроды с подвижными носителями
- •Имеют жидкую мембрану -
- •26.1.4. Прямая потенциометрия
- •26.1.5. Потенциометрическое титрование
- •26.2. Кулонометрический метод анализа
- •26.2.1. Общая характеристика и классификация
- •26.2.2. Прямая кулонометрия
- •26.2.3. Кулонометрическое титрование
- •Глава 27 вольтамперометрический метод анализа
- •27.1. Принцип измерения аналитического сигнала.
- •27.2. Вольтамперограмма
- •Максимум второго рода
- •Максимум первого рода
- •27.3. Некоторые современные разновидности вольт- амперометрии
- •27.4. Практическое применение вольтамперометрии. Амперометрическое титрование
6.4. Общие принципы растворения осадков малорастворимых электролитов
Растворение осадка, как это следует из произведения растворимости, происходит, если в растворе над осадком произведение активностей ионов станет меньше величины произведения растворимости. Частичное или полное растворение осадков может происходить при разбавлении раствора; нагревании (если, конечно, нагревание приводит к повышению растворимости), увеличении ионной силы; добавлении к раствору вещества, реагирующего с ионами, образующимися при растворении осадка.
Попробуйте объяснить и подтвердить, если необходимо, расчётами, почему Cu(OH)2 растворяется в раствореNH3, аMg(OH)2 - нет, почемуAgCl не растворяется в разбавленнойHNO3, зачем изBaSO4 в процессе переведения его в раствор вначале получают ВаСO3и т.д.
Глава 7
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ
РАВНОВЕСИЯ
7.1. Общая характеристика окислительно-восстановительных реакций
Окислительно-восстановительныминазывают реакции, в процессе которых происходит обмен электронами между реагирующими веществами.
окисление
юсстановление
В любой окислительно-восстановительной реакции окислитель и восстановитель взаимодействуют друг с другом c образованием нового восстановителя и нового окислителя.

Sn4+(+ (2Fe2+
сопряженный
восстановитель
Sn2++ (2Fe3+
сопряженный
окислитель
![]()
Sn2+-2e ^
Sn4+/(Sn2^
Fe3+
+e ^
2+
4+
Sn
Fe
полуреакция восстановления
полуреакция окисления сопряженные окислительно-восстановительные пары
Поскольку в процессе окислительно-восстановительной реакции происходит лишь перераспределение электронов между реагирующими веществами, то число электронов, отданных восстановителем, должно быть равно числу электронов, полученных окислителем.
7.2. Количественная оценка окислительно-восстановительной способности веществ
Обычно для количественной оценки способности веществ отдавать и принимать электроны используют не константы равновесия, а электродные потенциалы. Это возможно потому, что процессы окисления и восстановления могут быть пространственно разделены.
Электродные потенциалы
Электродом в электрохимииназывается поверхность раздела между проводником электрического тока с электронной проводимостью и проводником электрического тока с ионной проводимостью,или, иными словами,место, где электронный механизм переноса электрического заряда изменяется на ионный (и наоборот). В более узком смысле слова электродом часто называют проводник электрического тока с электронной проводимостью.
Рис.
7.1.Схематическое
изображение гальванического элемента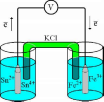
окисления
и восстановления пространственно
разделены
7.1). В сосуде, содержащем Sn2+ и
следующие
Sn4+, будут проходить процессы. ИоныSn2+ будут отдавать электроны платиновой проволоке и превращаться вSn4+. Параллельно будет происходить и обратный процесс. Через некоторое время в системе установится равновесие:
г Sn2+
Вследствие установления данного равновесия поверхность платиновой проволоки и раствор вблизи неё будут иметь различный заряд, произойдёт образование так называемого «двойного электрического слоя» (рис. 7.2). На границе раздела «металл - раствор» возникнет разность потенциалов, называемая электродным потенциалом.
Аналогичные процессы
Sn4+
+2e
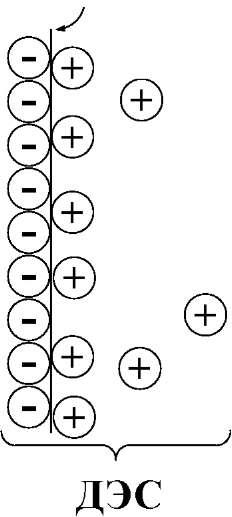
граница
раздела ("электрод") раствор
электролита
металл
2+
Рис. 7.2. Возникновение электродногосодержащейFe2+ иFe3+ Однако
потенциала
так как ионы Fe2+ обладают меньшей способностью отдавать электроны, чемSn2+, а ионыFe3+, соответственно, большей способностью принимать электроны, чемSn4+, то поверхность платиновой проволоки, опущенной в раствор, содержащийFe2+ иFe3+, будет заряжена менее отрицательно, чем опущенной в растворSn2+ иSn4+.
Соединим платиновые пластинки, опущенные в растворы, металлическим проводником. Для замыкания цепи соединим оба раствора солевым мостиком - трубкой, содержащей раствор KCl. В полученной системе, называемой гальваническим элементом,начнёт протекать электрический ток. Если включить в данную цепь потенциометр или высокоомный вольтметр, то можно измерить её ЭДС, которая будет характеризовать способность ионовFe3+ получать электроны отSn2+.
Абсолютную величину электродного потенциала индивидуального электрода определить невозможно. Возможно определить лишь разность потенциалов двух электродов. В принципе, это можно делать для каждой конкретной реакции. Однако гораздо более удобно выбрать какой-нибудь один стандартный электрод, относительно которого затем будут проводиться все измерения электродных потенциалов. В качестве такого электрода сравнения используется стандартный
Стандартный водородный электрод представляет собой платиновую пластинку, насыщенную водородом, которая находится в растворе H2SO4 илиHCl с qh + = 1 (рис. 7.3). Для увеличения
адсорбирующей способности платину покрывают слоем губчатой платины. Для насыщения поверхности платины водородом через раствор пропускают Рис. 7.3 Стандартный водород-газообразный Н2(р = 1атм). Междуво-ный электроддородом, растворённым в платине, и
гидратированными катионами водорода, находящимися в растворе, устанавливается равновесие:
2H+ + 2eг H2(Pt)
Потенциал стандартного водородного электрода принят равным нулю при любой температуре.
Стандартный электродный потенциал полуреакции (E0, ф°) - это ЭДС гальванического элемента, состоящего из находящегося в стандартных условиях электрода, на котором протекает данная полуреакция, и стандартного водородного электрода.
Н,
Н,
/
Pt(H2)
водородный
электрод.
sh2so4
Знак стандартного потенциала полуреакции зависит от выбранного направления полуреакции. При изменении направления знак меняется на противоположный. Например, для полуреакции (А) E0 = +0,771 В, следовательно, для обратной ей полуреакции (Б)E0 = - 0,771 В.
(А) Fe3+ +e ^Fe2+ (Б)Fe2+ -e ^Fe3+
Потенциал, характеризующий процесс восстановления, например, такой как (А), называется восстановительным,а потенциал, характеризующий процесс окисления, например, такой как (Б) - окислительным.В настоящее время величину электродного потенциала полуреакции принято относить к процессу восстановления окисленной формы
Чем больше величина электродного потенциала, тем более сильными окислительными свойствами обладает окисленная форма вещества и более слабыми восстановительными свойствами его восстановленная форма. Например, перманганат-ион при стандартных условиях в кислой среде является более сильным окислителем, чем дихромат- ион.
Cr2O72- +14H+ +6e ^2Cr3+ +7H2O E0 = +1,33 ВMnO4- +8H+ +5e ^ Mn2+ +4H2O E0 = +1,51 В
Если для интересующей нас полуреакции значение Е0в справочной литературе, по той или иной причине, не приведено, то его можно рассчитать, используя потенциалы других полуреакций.
Пример 7.1.Рассчитайте величину Е0для окислительно- восстановительной парыFe3+/Fe4\ если известно, что
Fe2+ +2e ^Fe^ (e0 = -0,473В)Fe3+ +e ^ Fe2+ (e2 = +0,771В)
При сложении первого и второго уравнения мы получим уравнение интересующей нас полуреакции:
Fe3+ +3e ^Fe^
Значение стандартного электродного потенциала данной полуреакции не будет равно сумме E0 и e2, т.е. 0,298В. Величина Е0не зависит от количества вещества (потенциал - это интенсивная, а не экстенсивная величина), поэтому потенциалы нельзя складывать.
AG
= -nFE
В отличие от электродного потенциала AG зависит от количества вещества, поэтомуAG3 =AG1 +AG2. Следовательно
0,058
В0njE?
+n2E2
2-(-0,473) +1-0,771
3
3
n
Разность электродных потенциалов окислителя, участвующего в прямой реакции, и окисленной формы восстановителя, образующегося в процессе реакции, называется ЭДС реакции (ЛЕ).
По величине ЭДС можно судить о том, возможно или нет самопроизвольное протекание данной реакции. ©
ЛЕ > 0
ЛЕ < 0
Пример 7.2.Определить, может ли самопроизвольно протекать при стандартных условиях реакция окисления иодид-ионов ио-

7- 3 +
нами Fe .
2Fe3+ +2I- ^2Fe2+ +I2
- Е0= 0,771 - 0,536 = 0,235В
0
ЛЕ0= Е
Fe3+
/Fe2+
Данная реакция может самопроизвольно протекать в прямом направлении.
Уравнение Нернста
Например,
для Cr2O72-
+14H+ +6e ^2Cr3+
+7H2O
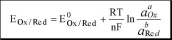
Если объединить постоянные величины в одну константу, а натуральный логарифм заменить десятичным, то при T = 298 К

14
00,059,acr2o7~
aH+
+——lg—
0
+ 0,059 lg
yOx
0,059,
a
Ox
Ca
0,059
+lg
Ox
E
=
E
b
yb
^
Red
C
n
n
aCr 3+
0'
Формальный электродный потенциал Eox/Red" это потенциал полуреакции, измеренный при условии, что концентрации окисленной и восстановленной формы равны 1 моль/л, а концентрации посторонних ионов известны.
Ox/Red
Ox/Red
nyna C
Red Red
E
=E
формальные потенциалы
стандартный
потенциал
1
M H2SO4
10
M NaOH
^if
-0,68B
1 M K2C2O4
Константа равновесия окислительно-восстановительной реакции
Red1
Red2
Ox1
+n1
e Ox2
+n2e
■
E
E
0
Ox1/Red1 ■ 0
Ox2/Red2
Наименьшее общее кратное для n1 иn2 обозначим какm. Суммарное уравнение реакции будет иметь следующий вид
a b
0
K
равн a b
aox1aRed2
aOxi
+bRed2
гaRedi +bOx2,
где
a =m/nb
b =m/n2.
aRe d1
1/Red1
m /a
+
E
lg-
0
ox1
/Red
a
Re
d 2
0,059, aoxx . +lg^ = E 0
ox2 /Red2 m / b
aox2
aRe d2
aox1
aRe d1
b
•lg
-
a
•lgE0 E0 =0,059
Ox1 /Re d1 Ox2 /Re d2 m
a b
ab
aox1
aRed2
m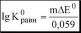
=
—lgK0
равн
m
Обратите внимание, что в выражение для расчёта константы равновесия окислительно-восстановительной реакции входит не произведение числа электронов n1 иn2, а их наименьшее общее кратноеm, которое может быть равно этому произведению, а может быть и не равно.
Если lgK > 0, реакция может самопроизвольно протекать в прямом направлении. Чем больше величинаK, тем больше "глубина" протекания окислительно-восстановительной реакции.
Пример 7.3.Рассчитать термодинамическую константу равновесия реакции
/3- +2S2o32- гS4o|- + 3/-
0
+0,09В
если
E
+0,545В, E
IJ/3I 'S4O2" /2S2O2"
равн
0,059
Кравн
-
1^1015
