
Законы распределения молкул газа
.docРаспределение молекул идеального газа по скоростям (распределение Максвелла).
Молекулы газа, двигаясь хаотически, сталкиваются между собой. В результате столкновений величина скорости каждой из молекул может меняться. Проследив за движением одной из молекул, мы «увидели» бы, что в какие-то моменты времени она движется быстрее, в какие-то - медленнее. Но при большом числе молекул и при неизменных условиях относительное число «медленных» и «быстрых» молекул остается постоянным, т. е. устанавливается распределение молекул газа по скоростям. Закон, описывающий это распределение, был найден Д. К. Максвеллом в 1859 г. и называется распределением Максвелла.
Функция распределения
Максвелла
![]() устанавливает относительное число
молекул, скорости которых попадают в
единичный интервал скоростей вблизи
v,
т.е.
устанавливает относительное число
молекул, скорости которых попадают в
единичный интервал скоростей вблизи
v,
т.е.
![]() ,
,
где n
- общее число молекул в единице объема,
т. е. концентрация; dn
- число молекул в единице объема, скорости
которых лежат в интервале от v
до
![]() .
Для однородного газа, находящегося в
состоянии термодинамического равновесия,
распределение Максвелла имеет вид:
.
Для однородного газа, находящегося в
состоянии термодинамического равновесия,
распределение Максвелла имеет вид:
 .
.

![]() асимптотически стремится к нулю. При
асимптотически стремится к нулю. При
![]() (называемой наиболее вероятной скоростью)
(называемой наиболее вероятной скоростью)
![]() достигает максимума. Площадь, ограниченная
графиком
достигает максимума. Площадь, ограниченная
графиком
![]() и осью скоростей
и осью скоростей
![]() ,
равна
,
равна
![]() .
.
Найдем выражение
для наиболее вероятной скорости. Для
этого необходимо взять производную от
![]() по
v
и приравнять ее нулю:
по
v
и приравнять ее нулю:
![]() ,
или
,
или
 .
.
 ,
,
![]() ,
,
откуда
![]() .
.
Зная функцию
распределения по скоростям, можно найти
среднюю арифметическую скорость молекул
![]() :
:
![]() .
.
Введенные нами
скорости
![]() ,
,
![]() и
и
![]() определяются сходными выражениями,
которые отличаются лишь числовыми
множителями порядка единицы. Все три
скорости необходимы при решении тех
или иных задач статистической физики.
определяются сходными выражениями,
которые отличаются лишь числовыми
множителями порядка единицы. Все три
скорости необходимы при решении тех
или иных задач статистической физики.
Экспериментальная проверка (опыт О.Штерна, 1920г.) подтвердила справедливость полученного Максвеллом закона.
Распределение молекул идеального газа во внешнем потенциальном поле.
При выводе основного уравнения молекулярно-кинетической теории газов предполагается, что молекулы распределены по объему равномерно. Это возможно только при отсутствии внешних сил. На самом деле в земных условиях молекулы испытывают на себе действие поля тяжести, т. е. находятся во внешнем потенциальном поле. В результате действия двух факторов, поля тяжести и теплового движения, в газе устанавливается некоторое распределение молекул по высоте.
Найдем закон, описывающий зависимость давления газа от высоты над поверхностью земли. Известно, что гидростатическое давление жидкости на глубине h равно
![]() ,
,
где
![]() - плотность жидкости. Поскольку жидкости
мало сжимаемы, можно считать их плотность
практически независящей от глубины.
Газы, в отличие от жидкостей, довольно
легко сжимаемы, поэтому их плотность
существенно зависит от высоты. Но и для
газов можно пользоваться подобной
формулой, если перепад высот небольшой.
Предполагая, что высота h
точки наблюдения от поверхности земли
получила элементарное приращение dh,
получим приращение давления
- плотность жидкости. Поскольку жидкости
мало сжимаемы, можно считать их плотность
практически независящей от глубины.
Газы, в отличие от жидкостей, довольно
легко сжимаемы, поэтому их плотность
существенно зависит от высоты. Но и для
газов можно пользоваться подобной
формулой, если перепад высот небольшой.
Предполагая, что высота h
точки наблюдения от поверхности земли
получила элементарное приращение dh,
получим приращение давления
![]() .
.
Из уравнения Клапейрона-Менделеева выразим плотность
![]() .
.
Тогда
![]() ,
, ![]() .
.
Интегрируя в предположении, что температура не зависит от высоты, получим так называемую барометрическую формулу:
![]() ,
,
где p0, p - давление у поверхности земли и на высоте h соответственно.
Аналогичная формула получается для зависимости концентрации молекул от высоты. Т.к. n~p, получаем, что
![]() .
.
Показатель экспоненты можно представить в виде
![]() ,
,
где
![]() - потенциальная энергия молекулы в поле
тяжести Земли. Используя это выражение,
получим, что
- потенциальная энергия молекулы в поле
тяжести Земли. Используя это выражение,
получим, что
![]() .
.
Больцман показал, что эта формула является универсальной, описывающей распределение частиц по значениям потенциальной энергии в любом внешнем потенциальном поле. Это соотношение называют законом распределения Больцмана.
Средняя длина свободного пробега молекул.
При хаотическом
движении молекулы газа сталкиваются
не только со стенками сосуда, но и между
собой. Между столкновениями они движутся
равномерно и прямолинейно и проходят
расстояние, называемое длиной свободного
пробега
![]() .
Для характеристики всей совокупности
молекул газа вводится понятие средней
длины свободного пробега молекул
.
Для характеристики всей совокупности
молекул газа вводится понятие средней
длины свободного пробега молекул
![]() .
.
Модель идеального газа предполагает, что молекулы сталкиваются так же, как обычные шарики, только очень малого диаметра d~10-10 м. В результате каждого столкновения направление движения молекул изменяется. Поэтому траектория молекулы газа представляет собой ломаную линию.
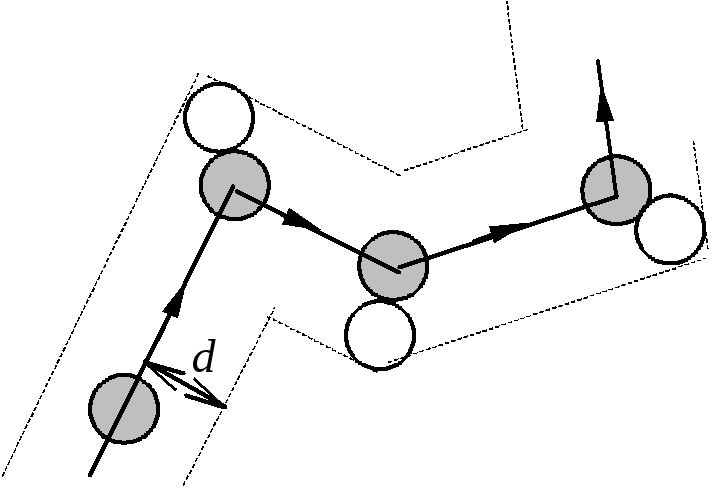
![]() столкновений молекулы в единицу времени
равно произведению объема цилиндра на
концентрацию молекул, т. е.
столкновений молекулы в единицу времени
равно произведению объема цилиндра на
концентрацию молекул, т. е.
![]() .
.
С учетом того, что
все молекулы движутся, возможность
столкновения определяется средней
относительной скоростью
![]() .
Если молекулы газа распределены по
скоростям по закону Максвелла, то
.
Если молекулы газа распределены по
скоростям по закону Максвелла, то
![]() оказывается равной
оказывается равной
![]() .
.
Тогда
![]() .
.
Средняя длина свободного пробега молекул найдется как отношение среднего пути за единицу времени к среднему числу столкновений за единицу времени:
![]() .
.
Представление
молекул в виде шариков, конечно, является
идеализацией. Каждая молекула - это
сложная система, состоящая из ядер и
электронов. Поэтому под d
нужно понимать так называемый «эффективный»
диаметр, который зависит от температуры.
С повышением температуры центры молекул
сближаются при столкновении на меньшее
расстояние, т. е. «эффективный» диаметр
молекул уменьшается, следовательно,
![]() растет. Но эффект роста
растет. Но эффект роста
![]() с повышением температуры довольно
слабый, и в первом приближении им можно
пренебречь.
с повышением температуры довольно
слабый, и в первом приближении им можно
пренебречь.
