
- •М о д у л ь 1. Основні поняття і закони хімії т е м а 1 (вступна). Основні поняття і закони хімії.
- •1.4. Список рекомендованої літератури
- •2.1. Рекомендації до вивчення теоретичного матеріалу
- •2.4. Лабораторна робота
- •2.5. Список рекомендованої літератури
- •3.1.Рекомендації до вивчення теоретичного матеріалу
- •3.2. Приклади розвязування типових задач
- •3.3. Задачі для самостійного рішення: 182, 183, 190, 208
- •3.4. Лабораторна робота
- •3.5. Список рекомендованої літератури
- •4.1. Рекомендації до вивчення теоретичного матеріалу
- •4.2. Приклади розвязування типових задач.
- •4.3. Задачі для самостійного рішення: 720, 724, 736
- •4.4. Лабораторна робота
- •Дослід 3. Утворення сольватокомплексів
- •Дослід 6. Стійкість комплексів
- •4.5. Список рекомендованої літератури
- •М о д у л ь 2. Основні закономірності протікання хімічних реакцій т е м а 5. Енергетика хімічних процесів
- •5.1. Рекомендації до вивчення теоретичного матеріалу
- •5.2. Приклади розвязування типових задач
- •Розв’язок: Температуру початку реакції розрахуємо за формулою:
- •5.3. Задачі для самостійного рішення: № 283, 285, 303, 311
- •5.4. Лабораторна робота
- •5.5. Список рекомендованої літератури
- •Тема 6. Швидкість протікання хімічних реакцій та хімічна рівновага
- •6.2.Приклади розвязування типових задач
- •6.3. Задачі для самостійного рішення: 330, 332, 334, 352
- •6.4. Лабораторна робота
- •Загальні вказівки
- •М о д у л ь 3. Розчини т е м а 7. Розчинність. Способи вираження концентрації
- •8.1. Рекомендації до вивчення теоретичного матеріалу
- •8.3. Задачі для самостійного розвязування: 1030, 1031, 1035, 1037
- •8.4. Лабораторна робота
- •8.5. Список рекомендованої літератури
- •Т е м а 9. Властивості розчинів. Рівноваги у розчинах електролітів
- •9.1. Рекомендації до вивчення теоретичного матеріалу
- •9.2. Приклади розвязування типових задач
- •9.3. Задачі для самостійного рішення: № 516, 544, 586
- •9.4. Лабораторна робота
- •9.5. Список рекомендованої літератури
- •Тема 10. Окисно-відновні реакції
- •10.1. Рекомендації до вивчення теоретичного матеріалу
- •10.2. Приклади рішення типових задач
- •10.3. Задачі для самостійного рішення: 624, 625, 626, 640
- •10.4. Лабораторна робота
- •10.5. Список рекомендованої літератури
- •М о д у л ь 4. Електрохімічні процеси
- •Т е м а 11. Гальванічні елементи
- •11.1. Рекомендації до вивчення теоретичного матеріалу
- •11.2. Приклади розвязування типових задач
- •1.3. Задачі для самостійного рішення: 658, 660, 661
- •11.4. Лабораторна робота
- •11.5. Список рекомендованої дітератури
- •12.1. Рекомендації до вивчення теоретичного матеріалу
- •12.2. Приклади розв’язку типових задач
- •12.4. Лабораторна робота
- •12.5. Список рекомендованої літератури
- •13.1. Рекомендації до вивчення теоретичного матеріалу
- •13.2. Приклади рішення типових задач
- •13.3. Задачі для самостійного рішення 689, 690, 695, 709
- •13.4. Лабораторна робота
- •13.5. Список рекомендованої літератури
- •Тема 14. Властивості неметалів viiа групи (f, Cl, Br, I)
- •14.1. Рекомендації до вивчення теоретичного матеріалу
- •14.2. Приклади розв’язку типових задач
- •14.3. Задачі для самостійного розв’язування: 823, 824, 831.
- •14.4. Лабораторна робота
- •14.5. Список рекомендованої літератури
- •Тема 15. Властивості неметалів viа групи (o, s, Se, Te)
- •15.1 Рекомендації до вивчення теоретичного матеріалу
- •15.2. Приклади розв’язку типових задач
- •15.3. Задачі для самостійного розв’язку
- •15.4. Лабораторна робота
- •15.5. Список рекомендованої літератури
- •Тема 16. Властивості неметалів vа групи (n, p, As, Sb)
- •16.1. Рекомендації до вивчення теоретичного матеріалу
- •16.2. Приклади розв’язування типових задач
- •16.3. Задачі для самостійного розв’язку: 901, 902, 917
- •16.4. Лабораторна робота
- •Дослід 8. Гідроліз фосфатів
- •16.5. Список рекомендованої літератури
- •Тема 17. Властивості неметалів іvа групи (с, Sі)
- •17.1. Рекомендації до вивчення теоретичного матеріалу
- •17.2. Приклади розв’язування типових задач
- •17.3. Задачі для самостійного розв`язку: № 944, 949, 964.
- •17.4. Лабораторна робота
- •17.5. Список рекомендованої літератури
- •М о д у л ь 5. Властивості конструкційних і інструментальних металів і їхніх сполук. Полімерні матеріали
- •18.1. Рекомендації до вивчення теоретичного матеріалу
- •18.2. Приклади розвязування типових задач
- •18.3. Задачі для самостійного рішення: 1009, 1051, 1053
- •18.4. Лабораторна робота
- •Дослід 6. Окисно-відновні властивості сполук титана
- •Дослід 7. Електрохімічне оксидування (анодирування) алюмінію (елементи ндрс)
- •Сполуки водних розчинів для фарбування анодируваного алюмінію
- •18.5. Список рекомендованої літератури
- •Т е м а 19. Властивості заліза, кобальту, нікелю
- •19.1. Рекомендації до вивчення теоретичного матеріалу
- •19.2. Приклади розвязування типових задач
- •19.3. Задачі для самостійного рішення: 1113,1114, 1117, 1118
- •19.4. Лабораторна робота
- •19.5. Список рекомендованої літератури
- •Т е м а 20. Властивості металів підгрупи Cr і Mn і їх сполук
- •20.1. Рекомендації до вивчення теоретичного матеріалу
- •20.2. Приклади розвязування типових задач
- •20.3. Задачі для самостійного рішення: 1084, 1096, 1097
- •20.4. Лабораторна робота
- •20.5. Список рекомендованої літератури
- •21. Властивості металів vb групи (підгрупи ванадію)
- •21.1 Рекомендації до вивчення теоретичного матеріалу
- •21.2. Приклади розв’язування типових задач
- •21.3. Задачи для самостійного розв’язування : №1081, 1082
- •21.4. Лабораторна робота
- •21.5. Список рекомендованої літератури
- •22.1. Рекомендації до вивчення теоретичного матеріалу
- •22.2. Приклади розвязування типових задач
- •22.3. Задачі для самостійного рішення: 1071, 1072, 1077
- •2.4. Лабораторна робота
- •Дослід 3. Окисно-відновні властивості сполук станума і плюмбума
- •Дослід 6. Електролітичне лудіння (з елементами ндрс)
- •22.5. Список рекомендованої літератури
- •Т е м а 23. Властивості конструкційних металів ib і iib груп
- •23.1. Рекомендації до вивчення теоретичного матеріалу
- •23.2. Приклади розвязування типових задач
- •22.3. Задачі для самостійного рішення 995, 984, 1025
- •23.4. Лабораторна робота
- •23.5. Список рекомендованої літератури
- •24.1. Рекомендації до вивчення теоретичного матеріалу
- •24.2. Лабораторна робота
- •24.3. Список рекомендованої літератури
- •Питання до колоквіуму за темами «Будова атома. Періодичний закон. Властивості елементів. Хімічний зв'язок. Комплексні сполуки. Типи взаємодії молекул»
- •Тиск водяної пари при різних температурах
- •Добуток розчинності (др) важкорозчинних сполук (25оС)
- •Індивідуальні завдання до теми «Основні поняття і закони хімії»
- •Індивідуальні завдання до теми : "Електролітична дисоціація, рН, гідроліз солей"
- •Тема 1. (вступна). Основні поняття і закони хімії
- •Тема 2. Закон еквівалентів…………………………………………………………………....7
- •Тема 3. Будова атома. Періодичний закон. Властивості елементів..................................10
- •Тема 4. Хімічний зв'язок. Комплексні сполуки……………………….....................................15
- •Тема 5. Енергетика хімічних процесів………………………………….................................21
- •Тема 6. Швидкість хімічних реакцій і хімічна рівновага……................................................29
- •Тема 7. Розчинність. Способи вираження концентрації……………..................................33
- •Тема 18. Властивості легких конструкційних металів
15.5. Список рекомендованої літератури
Михайленко Я.И.Курс общей и неорганической химии. – М.: Высш. шк., 1966. - С.554-589.
Ахметолв Н.С. Общая и неорганическая химия. – М.: Высш. шк., 2001. – С.338-372.
Тема 16. Властивості неметалів vа групи (n, p, As, Sb)
16.1. Рекомендації до вивчення теоретичного матеріалу
Елементи VА групи відносяться до p-електронних аналогів (валентними електронами є ns2np3 ), але типовими неметалами є лише нітроген і фосфор. Арсен, стибій – металоїди (тобто, “подібні до металів”), а бісмут виявляє переважно металічні властивості. Розподіл електронів по квантовим коміркам:
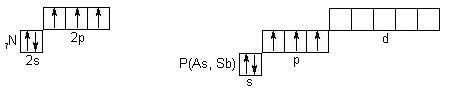
В обох елементів наp-орбіталях розташовані по 3 неспарених електрона, тобто для обох елементів принципово можливі ступені окиснення від -3 до +5 . Але властивості нітрогену (азоту) різко відрізняються від властивостей фосфору. Для досягнення завершеного октету нітроген приймає на 2p-орбіталь електрони з утворенням нітридів (Li3N, Na3N),сполук з двохелектроними зв’язками (NH3, N2,NF3), амідів (NaNH2), імідів(Na2NH). У деяких випадках відсутній завершений октет (NО,NО2),неспарений електрон делокалізується по всій системі зв’язків молекули .
Нарешті, на відміну від фосфору, арсену і стибію, для нітрогену характерна pπ-pπ-взаємодія, тобто, нітроген утворює подвійні і потрійні зв’язки, наприклад, в азидогідрогеновій кислоті HN3 , нітрилах:
Н-N=N≡N CH3-C≡N
Формальні ступені окиснення нітрогену :
-3 -2 -1 +1 +2 +3 +4 +5
NH3 N2H4 NH2OH N2O NO N2O3 NO2 N2O5
Молекулярний азот N2 хімічно мало активний, що обумовлено наявністю потрійного зв’язку між атомами нітрогену: N≡N (∆H0298 = 945кДж/моль). Але при високих температурах азот окиснює метали і неметали з утворенням нітридів:
3Mg + N2 = Mg3N2; 2B + N2 = 2BN
Слід уважно розглянути властивості сполук нітрогену з різними ступенями окиснення, звернувши особливу увагу на їх окисно-відновні властивості. Для нітрогену +3 і +5 існують кислоти HNO2 (слабка) і HNO3 (сильна) відповідно. Нітритна кислота і її солі виявляють окисно-відновну подвійність. Нітратна кислота HNO3 – сильний окисник , окиснює більшість металів і неметалів. Суміші HNO3 і HCl і особливо HNO3 з HF окиснюють навіть Au , Pt , Nb , Zb та інші метали.
Як зазначалось, для фосфора (як і для інших елементів VА групи) pπ- pπ-взаємодія нехарактерна . Найбільш поширені сполуки, у яких фосфор виявляє ступінь окиснення : -3 (PH3), +1 (Na[PO2H2]) ; +3 (PCl3, P2O3 , H3PO3) і +5 (P 2O5, H3PO4 , PCl5). Елементарний фосфор існує у різних модифікаціях (чорний, красний, білий). Хімічно найактивніша біла модифікація. Фосфор (Р0) виявляє властивості як окисника (P2 + 6Na = 2Na3P), так і відновника (P2 + 3Cl2 = 2PCl3). У ступені окиснення +1 фосфор представлений фосфіновою кислотою і її солями - фосфінатами, або гіпофосфінатами. Фосфінати використовують у процесі хімічного нікелювання :
Ni2+ + [PO+12H2]- + 2H2O = NI0 + P+5O3-4 + 4H+ + H20
Оксиди фосфору (P2O3 і P2O5) є андігридами кислот – фосфонової H2[P+3O3H] і фосфатної (H3P+5O4 - ортофосфатна, HP+5O3 - метафосфатна, H2P2O7 - пірофосфатна). Відомі поліфосфатні кислоти Hn+2PnO3n+1 , солі яких називають поліфосфатами.
Найбільш характерними ступенями окиснення для арсена і стібія є +3 +5. Гідрогенові сполуки AsH3 і SbH3 менш стійкі , ніж аналогічні сполуки фосфін PH3 і аміак NH3. Оксиди As2O3(Sb2O3) і As2O5(Sb2O5 ) являють собою андігриди кислот. Обидва елементи і деякі їх сполуки виявляють напівпровідникові властивості.
