
- •М о д у л ь 1. Основні поняття і закони хімії т е м а 1 (вступна). Основні поняття і закони хімії.
- •1.4. Список рекомендованої літератури
- •2.1. Рекомендації до вивчення теоретичного матеріалу
- •2.4. Лабораторна робота
- •2.5. Список рекомендованої літератури
- •3.1.Рекомендації до вивчення теоретичного матеріалу
- •3.2. Приклади розвязування типових задач
- •3.3. Задачі для самостійного рішення: 182, 183, 190, 208
- •3.4. Лабораторна робота
- •3.5. Список рекомендованої літератури
- •4.1. Рекомендації до вивчення теоретичного матеріалу
- •4.2. Приклади розвязування типових задач.
- •4.3. Задачі для самостійного рішення: 720, 724, 736
- •4.4. Лабораторна робота
- •Дослід 3. Утворення сольватокомплексів
- •Дослід 6. Стійкість комплексів
- •4.5. Список рекомендованої літератури
- •М о д у л ь 2. Основні закономірності протікання хімічних реакцій т е м а 5. Енергетика хімічних процесів
- •5.1. Рекомендації до вивчення теоретичного матеріалу
- •5.2. Приклади розвязування типових задач
- •Розв’язок: Температуру початку реакції розрахуємо за формулою:
- •5.3. Задачі для самостійного рішення: № 283, 285, 303, 311
- •5.4. Лабораторна робота
- •5.5. Список рекомендованої літератури
- •Тема 6. Швидкість протікання хімічних реакцій та хімічна рівновага
- •6.2.Приклади розвязування типових задач
- •6.3. Задачі для самостійного рішення: 330, 332, 334, 352
- •6.4. Лабораторна робота
- •Загальні вказівки
- •М о д у л ь 3. Розчини т е м а 7. Розчинність. Способи вираження концентрації
- •8.1. Рекомендації до вивчення теоретичного матеріалу
- •8.3. Задачі для самостійного розвязування: 1030, 1031, 1035, 1037
- •8.4. Лабораторна робота
- •8.5. Список рекомендованої літератури
- •Т е м а 9. Властивості розчинів. Рівноваги у розчинах електролітів
- •9.1. Рекомендації до вивчення теоретичного матеріалу
- •9.2. Приклади розвязування типових задач
- •9.3. Задачі для самостійного рішення: № 516, 544, 586
- •9.4. Лабораторна робота
- •9.5. Список рекомендованої літератури
- •Тема 10. Окисно-відновні реакції
- •10.1. Рекомендації до вивчення теоретичного матеріалу
- •10.2. Приклади рішення типових задач
- •10.3. Задачі для самостійного рішення: 624, 625, 626, 640
- •10.4. Лабораторна робота
- •10.5. Список рекомендованої літератури
- •М о д у л ь 4. Електрохімічні процеси
- •Т е м а 11. Гальванічні елементи
- •11.1. Рекомендації до вивчення теоретичного матеріалу
- •11.2. Приклади розвязування типових задач
- •1.3. Задачі для самостійного рішення: 658, 660, 661
- •11.4. Лабораторна робота
- •11.5. Список рекомендованої дітератури
- •12.1. Рекомендації до вивчення теоретичного матеріалу
- •12.2. Приклади розв’язку типових задач
- •12.4. Лабораторна робота
- •12.5. Список рекомендованої літератури
- •13.1. Рекомендації до вивчення теоретичного матеріалу
- •13.2. Приклади рішення типових задач
- •13.3. Задачі для самостійного рішення 689, 690, 695, 709
- •13.4. Лабораторна робота
- •13.5. Список рекомендованої літератури
- •Тема 14. Властивості неметалів viiа групи (f, Cl, Br, I)
- •14.1. Рекомендації до вивчення теоретичного матеріалу
- •14.2. Приклади розв’язку типових задач
- •14.3. Задачі для самостійного розв’язування: 823, 824, 831.
- •14.4. Лабораторна робота
- •14.5. Список рекомендованої літератури
- •Тема 15. Властивості неметалів viа групи (o, s, Se, Te)
- •15.1 Рекомендації до вивчення теоретичного матеріалу
- •15.2. Приклади розв’язку типових задач
- •15.3. Задачі для самостійного розв’язку
- •15.4. Лабораторна робота
- •15.5. Список рекомендованої літератури
- •Тема 16. Властивості неметалів vа групи (n, p, As, Sb)
- •16.1. Рекомендації до вивчення теоретичного матеріалу
- •16.2. Приклади розв’язування типових задач
- •16.3. Задачі для самостійного розв’язку: 901, 902, 917
- •16.4. Лабораторна робота
- •Дослід 8. Гідроліз фосфатів
- •16.5. Список рекомендованої літератури
- •Тема 17. Властивості неметалів іvа групи (с, Sі)
- •17.1. Рекомендації до вивчення теоретичного матеріалу
- •17.2. Приклади розв’язування типових задач
- •17.3. Задачі для самостійного розв`язку: № 944, 949, 964.
- •17.4. Лабораторна робота
- •17.5. Список рекомендованої літератури
- •М о д у л ь 5. Властивості конструкційних і інструментальних металів і їхніх сполук. Полімерні матеріали
- •18.1. Рекомендації до вивчення теоретичного матеріалу
- •18.2. Приклади розвязування типових задач
- •18.3. Задачі для самостійного рішення: 1009, 1051, 1053
- •18.4. Лабораторна робота
- •Дослід 6. Окисно-відновні властивості сполук титана
- •Дослід 7. Електрохімічне оксидування (анодирування) алюмінію (елементи ндрс)
- •Сполуки водних розчинів для фарбування анодируваного алюмінію
- •18.5. Список рекомендованої літератури
- •Т е м а 19. Властивості заліза, кобальту, нікелю
- •19.1. Рекомендації до вивчення теоретичного матеріалу
- •19.2. Приклади розвязування типових задач
- •19.3. Задачі для самостійного рішення: 1113,1114, 1117, 1118
- •19.4. Лабораторна робота
- •19.5. Список рекомендованої літератури
- •Т е м а 20. Властивості металів підгрупи Cr і Mn і їх сполук
- •20.1. Рекомендації до вивчення теоретичного матеріалу
- •20.2. Приклади розвязування типових задач
- •20.3. Задачі для самостійного рішення: 1084, 1096, 1097
- •20.4. Лабораторна робота
- •20.5. Список рекомендованої літератури
- •21. Властивості металів vb групи (підгрупи ванадію)
- •21.1 Рекомендації до вивчення теоретичного матеріалу
- •21.2. Приклади розв’язування типових задач
- •21.3. Задачи для самостійного розв’язування : №1081, 1082
- •21.4. Лабораторна робота
- •21.5. Список рекомендованої літератури
- •22.1. Рекомендації до вивчення теоретичного матеріалу
- •22.2. Приклади розвязування типових задач
- •22.3. Задачі для самостійного рішення: 1071, 1072, 1077
- •2.4. Лабораторна робота
- •Дослід 3. Окисно-відновні властивості сполук станума і плюмбума
- •Дослід 6. Електролітичне лудіння (з елементами ндрс)
- •22.5. Список рекомендованої літератури
- •Т е м а 23. Властивості конструкційних металів ib і iib груп
- •23.1. Рекомендації до вивчення теоретичного матеріалу
- •23.2. Приклади розвязування типових задач
- •22.3. Задачі для самостійного рішення 995, 984, 1025
- •23.4. Лабораторна робота
- •23.5. Список рекомендованої літератури
- •24.1. Рекомендації до вивчення теоретичного матеріалу
- •24.2. Лабораторна робота
- •24.3. Список рекомендованої літератури
- •Питання до колоквіуму за темами «Будова атома. Періодичний закон. Властивості елементів. Хімічний зв'язок. Комплексні сполуки. Типи взаємодії молекул»
- •Тиск водяної пари при різних температурах
- •Добуток розчинності (др) важкорозчинних сполук (25оС)
- •Індивідуальні завдання до теми «Основні поняття і закони хімії»
- •Індивідуальні завдання до теми : "Електролітична дисоціація, рН, гідроліз солей"
- •Тема 1. (вступна). Основні поняття і закони хімії
- •Тема 2. Закон еквівалентів…………………………………………………………………....7
- •Тема 3. Будова атома. Періодичний закон. Властивості елементів..................................10
- •Тема 4. Хімічний зв'язок. Комплексні сполуки……………………….....................................15
- •Тема 5. Енергетика хімічних процесів………………………………….................................21
- •Тема 6. Швидкість хімічних реакцій і хімічна рівновага……................................................29
- •Тема 7. Розчинність. Способи вираження концентрації……………..................................33
- •Тема 18. Властивості легких конструкційних металів
1.4. Список рекомендованої літератури
Глинка Н.Л. Общая химия. – Л.: Химия, 1988. – С.14-29; 2004. – С.19-25.
Глинка Н.Л. Задачи и упражнения по общей химии. – Л.: Химия, 1985. – С. 11-28.
Фролов В.В. Химия. – М.: Высш. шк., 1986. – С. 11-18.
Кириченко В.І. Загальна хімія: Навч. посібник – К.: Вища шк., 2005. –639 с.
Пилипенко А.Г., Починок В.Я., Середа И.П. и др. Справочник по элементарной химии. – Киев.: Наук. думка, 1985. – С. 5-15.
Сухан В.І., Табенська Т.В., Капустян А.Й., Горлач В.Ф. Посібник для вступників до вищих навч. закладів. – Київ.: Либідь, 1996. – С. 7-52.
Ахметов Н.С. Общая и неорганическая химия. Учеб. для вузов – 4-е изд. – М.: Высш.шк., ИЦ «Академия», 2001. – 743 с.
8. Кириченко В.І. Загальна хімія: Навч. посіб. – К.: Вища шк., 2005. – С. 12-21.
Т е м а 2. Закон еквівалентів
2.1. Рекомендації до вивчення теоретичного матеріалу
Закон еквівалентів експериментально встановлений німецьким хіміком В.Ріхтером (1797 р.) і сформульований Дж. Дальтоном (1803 р.): хімічні елементи і речовини взаємодіють між собою і утворюють нові речовини у кількостях, пропорційних їх еквівалентам. Математичний вираз закону еквівалентів: m1/m2 = Е1/Е2
Еквівалент речовини чи елемента – це реальна або умовна частинка речовини, яка взаємодіє з 1 моль атомів або іонів гідрогену або з ½ моль атомів оксигену. Наприклад, в НВrеквівалент брому становить 1 моль, тому що з 1моль атомів гідрогену з’єднується 1 мольатомів Вr. Еквівалент оксигену в Н2О дорівнює ½ моль, а нітрогену вNH3- 1/3 моль . Числа 1, ½ і 1/3 називаються фактором еквівалентності (f).
Молярна маса еквівалента– маса 1 еквівалента, виражена в грамах (me). Вона дорівнює добутку фактора еквівалентності та молярної маси речовини: me = f ·Mr . Еквівалентна маса гідрогену дорівнює 1г , його еквівалентний об’єм (Ve(H) ) становить 11,2 л. Для оксигену маємо відповідно 8 г/моль (маса еквівалента) і 5,6 л/моль (еквівалентний
об’єм, Vе(О) ) .
Таким чином, закон еквівалентів можна сформулювати так: маси речовин, що беруть участь і утворюються в реакції, відносяться між собою як їх молярні маси еквівалентів: m1/m2 = me(1)/me(2) . Якщо в рекції беруть участь газуваті речовини, розрахунки виконують за формулою: m/V=me/Ve.
Щоб вільно оперувати законом еквівалентів, необхідно навчитися розраховувати молярні маси еквівалентів елементів у сполуках і молярні маси еквівалентів складних речовин.
Молярна маса еквівалента елементав сполуці чисельно дорівнює відношенню його молярної маси до ступеня окислення цього елемента в сполуці, узятого по модулю, чи до його валентності:mе = М/в.
Молярна маса еквівалента складної речовинидорівнює сумі молярних мас еквівалентів складових:
- для оксиду:mе оксиду = mе елемента + 8або відношенню молярної маси оксиду до подвоєної кількості атомів кисню: mе оксиду = Моксиду/ 2n;
- для кислоти: mе кислоти = mе кисл. залишку + 1 або відношенню молярної маси кислоти до її основності: mе кислоти = Мкислоти/ основність. Необхідно враховувати, що основність кислоти визначається по конкретній реакції. Наприклад:
Н2SO4+NaOHNaHSO4+H2O- основність кислоти в даній реакції дорівнює 1.
Н2SO4+ 2NaOHNa2SO4+ 2H2O- основність кислоти в даній реакції дорівнює 2;
- для основи: mе основи = mе металу + 17або відношенню молярної маси основи до його кислотності: mе основи = Моснови/кислотність. Кислотність основи визначається за рівнянням реакції. Наприклад:
Cr(OH)3+HClCr(OH)2Cl+H2O- кислотність гидроксиду хрому в даній реакції дорівнює 1;
- для солі: mе солі = mе катіону + mе аніону або відношенню молярної маси солі до добутку кількості іону (катіону чи аніону) на його заряд по модулю: mе солі = Мсолі/ nz, деn– число катіонів (чи аніонів); z – заряд іону (по модулю).
Приклади розвязування типових задач
Задача 1.Обчисліть еквівалентну масу металу і його оксиду, якщо в 0,42 г оксиду міститься 0,30 г цього металу.
Розв’язок.Знаходимо масуоксигену,
що міститься в оксиді:m![]() =m
=m![]() –m
–m![]() = 0,42 – 0,30 = 0,12 (г). Визначаємо еквівалентну
масу металу за законом еквівалентів:
= 0,42 – 0,30 = 0,12 (г). Визначаємо еквівалентну
масу металу за законом еквівалентів:![]() =
=![]()
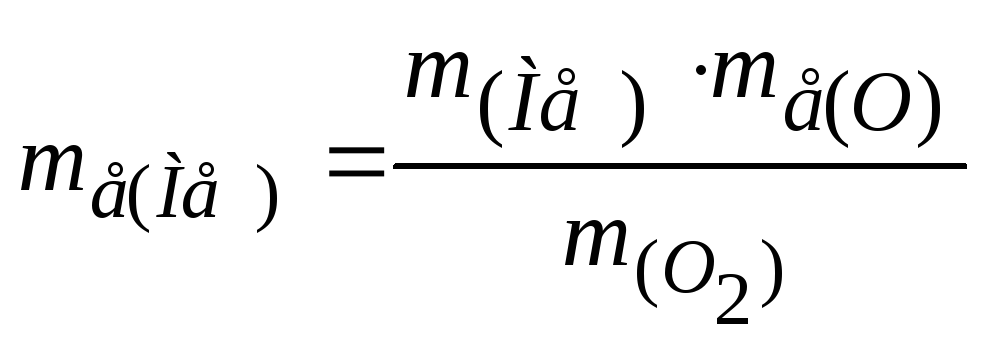 = 0,308:0,12
= =20 (г/моль).
= 0,308:0,12
= =20 (г/моль).
Еквівалентну масу оксиду металу розраховуємо за формулою:
![]() =
=
![]() + 8 = 20 + 8 = 28 (г/моль).
+ 8 = 20 + 8 = 28 (г/моль).
Задача 2.Визначити еквівалентні маси металу і його оксиду, якщо 4,61 г цього металу витісняє з кислоти 0,375 г водню (н.у.).
Розв’язок. Відповідно до закону
еквівалентів,![]() .
.
![]() = 4,611:0,375
= 12,29 (г/моль).
= 4,611:0,375
= 12,29 (г/моль).
![]() =
=
![]() + 8 = 12,29 + 8 = 20,29 (г/моль).
+ 8 = 12,29 + 8 = 20,29 (г/моль).
Задача 3.Визначіть еквівалентну масу металу, якщо на утворення 2,72 г його оксиду потрібно 0,328 л О2, що знаходиться при температурі 270С и тиску 303,9 кПа.
Розв’язок.Спочатку знайдемо масу
кисню, використовуючи рівняння
Клапейрона-Менделєєва:![]() =
=![]() =
(303,90,32832):(8,31300)
= 1,28 (г).
=
(303,90,32832):(8,31300)
= 1,28 (г).
Далі визначаємо масу металу:
![]() =
=
![]() -
-
![]() = 2,72 - 1,28 = 1,44 (г).
= 2,72 - 1,28 = 1,44 (г).
Еквівалентні маси металу й оксиду
розрахуємо як і в попередньому прикладі:
![]() = 1,448:1,28 = 9 (г/моль);
= 1,448:1,28 = 9 (г/моль);
![]() =
=
![]() + 8 = 9 + 8 = 17 (г/моль).
+ 8 = 9 + 8 = 17 (г/моль).
Задача 4.Обчисліть еквівалентну масу хлору в його оксиді, який містить 61,2% оксигену. Яку формулу має оксид ?.
Розв’язок. Знайдемо вміст хлору в оксиді: 100 – 61,2 = 38,8 (%). Користуючись законом еквівалентів, запишемо:
m(Cl) / m(O2) = me(Cl) / me(O) , або: me(Cl) = m(Cl)·8 / m(O2) = (38,8·8)/61,2 = 5,07 г/моль-екв.
Маса еквівалента хлору дорівнює відношенню молярної (атомної) маси хлору до його валентності: me(Cl)=Ar(Cl)/B.
Отже: в = Ar(Cl) : me(Cl) = 35,45 : 5,07 = 7 .
Формула оксида Сl2O7 .
Задачі для самостійного рішення: 1, 10, 38
