
- •М о д у л ь 1. Основні поняття і закони хімії т е м а 1 (вступна). Основні поняття і закони хімії.
- •1.4. Список рекомендованої літератури
- •2.1. Рекомендації до вивчення теоретичного матеріалу
- •2.4. Лабораторна робота
- •2.5. Список рекомендованої літератури
- •3.1.Рекомендації до вивчення теоретичного матеріалу
- •3.2. Приклади розвязування типових задач
- •3.3. Задачі для самостійного рішення: 182, 183, 190, 208
- •3.4. Лабораторна робота
- •3.5. Список рекомендованої літератури
- •4.1. Рекомендації до вивчення теоретичного матеріалу
- •4.2. Приклади розвязування типових задач.
- •4.3. Задачі для самостійного рішення: 720, 724, 736
- •4.4. Лабораторна робота
- •Дослід 3. Утворення сольватокомплексів
- •Дослід 6. Стійкість комплексів
- •4.5. Список рекомендованої літератури
- •М о д у л ь 2. Основні закономірності протікання хімічних реакцій т е м а 5. Енергетика хімічних процесів
- •5.1. Рекомендації до вивчення теоретичного матеріалу
- •5.2. Приклади розвязування типових задач
- •Розв’язок: Температуру початку реакції розрахуємо за формулою:
- •5.3. Задачі для самостійного рішення: № 283, 285, 303, 311
- •5.4. Лабораторна робота
- •5.5. Список рекомендованої літератури
- •Тема 6. Швидкість протікання хімічних реакцій та хімічна рівновага
- •6.2.Приклади розвязування типових задач
- •6.3. Задачі для самостійного рішення: 330, 332, 334, 352
- •6.4. Лабораторна робота
- •Загальні вказівки
- •М о д у л ь 3. Розчини т е м а 7. Розчинність. Способи вираження концентрації
- •8.1. Рекомендації до вивчення теоретичного матеріалу
- •8.3. Задачі для самостійного розвязування: 1030, 1031, 1035, 1037
- •8.4. Лабораторна робота
- •8.5. Список рекомендованої літератури
- •Т е м а 9. Властивості розчинів. Рівноваги у розчинах електролітів
- •9.1. Рекомендації до вивчення теоретичного матеріалу
- •9.2. Приклади розвязування типових задач
- •9.3. Задачі для самостійного рішення: № 516, 544, 586
- •9.4. Лабораторна робота
- •9.5. Список рекомендованої літератури
- •Тема 10. Окисно-відновні реакції
- •10.1. Рекомендації до вивчення теоретичного матеріалу
- •10.2. Приклади рішення типових задач
- •10.3. Задачі для самостійного рішення: 624, 625, 626, 640
- •10.4. Лабораторна робота
- •10.5. Список рекомендованої літератури
- •М о д у л ь 4. Електрохімічні процеси
- •Т е м а 11. Гальванічні елементи
- •11.1. Рекомендації до вивчення теоретичного матеріалу
- •11.2. Приклади розвязування типових задач
- •1.3. Задачі для самостійного рішення: 658, 660, 661
- •11.4. Лабораторна робота
- •11.5. Список рекомендованої дітератури
- •12.1. Рекомендації до вивчення теоретичного матеріалу
- •12.2. Приклади розв’язку типових задач
- •12.4. Лабораторна робота
- •12.5. Список рекомендованої літератури
- •13.1. Рекомендації до вивчення теоретичного матеріалу
- •13.2. Приклади рішення типових задач
- •13.3. Задачі для самостійного рішення 689, 690, 695, 709
- •13.4. Лабораторна робота
- •13.5. Список рекомендованої літератури
- •Тема 14. Властивості неметалів viiа групи (f, Cl, Br, I)
- •14.1. Рекомендації до вивчення теоретичного матеріалу
- •14.2. Приклади розв’язку типових задач
- •14.3. Задачі для самостійного розв’язування: 823, 824, 831.
- •14.4. Лабораторна робота
- •14.5. Список рекомендованої літератури
- •Тема 15. Властивості неметалів viа групи (o, s, Se, Te)
- •15.1 Рекомендації до вивчення теоретичного матеріалу
- •15.2. Приклади розв’язку типових задач
- •15.3. Задачі для самостійного розв’язку
- •15.4. Лабораторна робота
- •15.5. Список рекомендованої літератури
- •Тема 16. Властивості неметалів vа групи (n, p, As, Sb)
- •16.1. Рекомендації до вивчення теоретичного матеріалу
- •16.2. Приклади розв’язування типових задач
- •16.3. Задачі для самостійного розв’язку: 901, 902, 917
- •16.4. Лабораторна робота
- •Дослід 8. Гідроліз фосфатів
- •16.5. Список рекомендованої літератури
- •Тема 17. Властивості неметалів іvа групи (с, Sі)
- •17.1. Рекомендації до вивчення теоретичного матеріалу
- •17.2. Приклади розв’язування типових задач
- •17.3. Задачі для самостійного розв`язку: № 944, 949, 964.
- •17.4. Лабораторна робота
- •17.5. Список рекомендованої літератури
- •М о д у л ь 5. Властивості конструкційних і інструментальних металів і їхніх сполук. Полімерні матеріали
- •18.1. Рекомендації до вивчення теоретичного матеріалу
- •18.2. Приклади розвязування типових задач
- •18.3. Задачі для самостійного рішення: 1009, 1051, 1053
- •18.4. Лабораторна робота
- •Дослід 6. Окисно-відновні властивості сполук титана
- •Дослід 7. Електрохімічне оксидування (анодирування) алюмінію (елементи ндрс)
- •Сполуки водних розчинів для фарбування анодируваного алюмінію
- •18.5. Список рекомендованої літератури
- •Т е м а 19. Властивості заліза, кобальту, нікелю
- •19.1. Рекомендації до вивчення теоретичного матеріалу
- •19.2. Приклади розвязування типових задач
- •19.3. Задачі для самостійного рішення: 1113,1114, 1117, 1118
- •19.4. Лабораторна робота
- •19.5. Список рекомендованої літератури
- •Т е м а 20. Властивості металів підгрупи Cr і Mn і їх сполук
- •20.1. Рекомендації до вивчення теоретичного матеріалу
- •20.2. Приклади розвязування типових задач
- •20.3. Задачі для самостійного рішення: 1084, 1096, 1097
- •20.4. Лабораторна робота
- •20.5. Список рекомендованої літератури
- •21. Властивості металів vb групи (підгрупи ванадію)
- •21.1 Рекомендації до вивчення теоретичного матеріалу
- •21.2. Приклади розв’язування типових задач
- •21.3. Задачи для самостійного розв’язування : №1081, 1082
- •21.4. Лабораторна робота
- •21.5. Список рекомендованої літератури
- •22.1. Рекомендації до вивчення теоретичного матеріалу
- •22.2. Приклади розвязування типових задач
- •22.3. Задачі для самостійного рішення: 1071, 1072, 1077
- •2.4. Лабораторна робота
- •Дослід 3. Окисно-відновні властивості сполук станума і плюмбума
- •Дослід 6. Електролітичне лудіння (з елементами ндрс)
- •22.5. Список рекомендованої літератури
- •Т е м а 23. Властивості конструкційних металів ib і iib груп
- •23.1. Рекомендації до вивчення теоретичного матеріалу
- •23.2. Приклади розвязування типових задач
- •22.3. Задачі для самостійного рішення 995, 984, 1025
- •23.4. Лабораторна робота
- •23.5. Список рекомендованої літератури
- •24.1. Рекомендації до вивчення теоретичного матеріалу
- •24.2. Лабораторна робота
- •24.3. Список рекомендованої літератури
- •Питання до колоквіуму за темами «Будова атома. Періодичний закон. Властивості елементів. Хімічний зв'язок. Комплексні сполуки. Типи взаємодії молекул»
- •Тиск водяної пари при різних температурах
- •Добуток розчинності (др) важкорозчинних сполук (25оС)
- •Індивідуальні завдання до теми «Основні поняття і закони хімії»
- •Індивідуальні завдання до теми : "Електролітична дисоціація, рН, гідроліз солей"
- •Тема 1. (вступна). Основні поняття і закони хімії
- •Тема 2. Закон еквівалентів…………………………………………………………………....7
- •Тема 3. Будова атома. Періодичний закон. Властивості елементів..................................10
- •Тема 4. Хімічний зв'язок. Комплексні сполуки……………………….....................................15
- •Тема 5. Енергетика хімічних процесів………………………………….................................21
- •Тема 6. Швидкість хімічних реакцій і хімічна рівновага……................................................29
- •Тема 7. Розчинність. Способи вираження концентрації……………..................................33
- •Тема 18. Властивості легких конструкційних металів
15.2. Приклади розв’язку типових задач
Задача 1. Наважку технічної солі BaCl2·2H2O0,5965г обробляли надвишком сульфатної кислоти. Маса осаду барія сульфату після прожарювання складала 0,4646г. Визначте вміст чистого кристалогідрату BaCl2·2H2O в технічній солі.
Розв´язок: Аналіз солі барію відбувається згідно з рівнянням:
BaCl2·2H2O + H2SO4 = BaSO4↓ + 2HCl + 2H2O
244,30 233,40
Таким чином, 233,40г BaSO4 відповідають 244,30г BaСl2·2H2O
0,4646гBaSO4 х г BaСl2·2H2O
х = (0,4646·244,30)/233,40 = 0,4862г BaСl2·2H2O
Вміст чистого BaСl2·2H2O в технічній солі складає:
![]()
Задача 2. Визначте [H+] в 0.025 м розчині H2S.
Розв´язок: Розчин H2Sу воді являє собою слабку кислоту, для якої К1 = 1·10-7, а К2 = 1,2∙10-18. Отже практично всі іони Н+ утворюються за рахунок дисоціації кислоти по першій стадії:
H2S ↔ HS+ + S-
а рівняння константи дисоціації має вигляд:
![]()
Якщо позначити [H+]= [HS-]
=x,то
отримаємо К =
![]()
Звідси х =
[H+]=
![]() = 3,77·10-5
моль/л
= 3,77·10-5
моль/л
Задача 3. Відносна електронегативність (χ) у оксигена 3,5, а у карбона 2,5. Незважаючи на це, розподіл зарядів в молекулі чадного газу такий: δ-СО+δ . Як пояснити такий розподіл зарядів з точки зору метода валентних зв'язків(ВЗ)?
Розв'язок:Розподіл електронної густини при утворені молекули СО можна показати графічно:
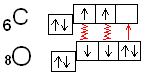
В молекулі СО два зв'язки
утворюються по ковалентному механізму,
а один - по донорно-акцепторному
(дативному) механізму. В останньому
випадку донором електронної пари є
оксиген, акцептором - атом карбону. Отже,
розподіл електронної густини такий:![]()
![]()
15.3. Задачі для самостійного розв’язку
15.4. Лабораторна робота
Необхідні прилади, устаткування, реактиви: сухі реактиви – MnO2, KMnO4, Na2SO3 , порошки Fe, S; розчини – Na2SO3 , H2O2 (3% i 30%), Na2S, Na2S2O3 , Pb(NO3)2 , KOH, H2SO4 , HCl(розб.,конц.), KMnO4 , K2Cr2O7 , сульфати або хлориди цинку, мангану, кадмію, купруму, нікелю; KІ; водні розчини хлору, брому, йоду. Штатив з лапкою.
Дослід 1. Одержання кисню О2 і сірки S
а) У широку пробирку або циліндр наливають ≈5 мл гідроген пероксиду Н2О2 (30%) і додають декілька кристалів каталізатора МnО2 або КМnO4 (обережно, додавати невеликими порціями!). Спостерігають бурхливу реакцію диспрорцінування Н2О2. Виділення О2 контролюють за допомогою тліючої трісочки, яка спалахує в атмосфері О2.
б) Для одержання О2 в пробірку насипають ≈1г КMnO4 і сильно прожарюють у полум’ї пальника. Виділення О2 контролюють, як і в попередньому досліді. Після охолодження пробірки добавляють в неї 4-5 мл води, перемішують. Спостерігають утворення зеленого розчину К2MnO4 і бурого осаду MnO2.
в) Одержати сірку можна кількома способами. У пробірку наливають 2-3 мл розчину Na2SO3, підкислюють розчином H2SO4 , додають розчин Na2S2O3 і далі - 1-2 мл сульфатної кислот
Дослід 2. Окисно-відновні властивості гідрогена пероксида
а) До 2 мл солі Рb2+ додають розчин Na2S, при цьому утворюється чорний осад РbS. Для кращого осадження його підігрівать, після чого зливають з осаду розчин і додають ≈3мл 3%-ного розчину H2O2. Утворюється білий осад PbSO4 . Записати рівняння реакцій.
б) До 2 мл солі Cr3+ додають краплями розчин лугу. Спочатку випадає осад Cr(ОН)3, який розчинюється в надлишку КОН, з утворенням комплексу [Cr(ОН)4 ]- зеленого кольору. До нього додають розчин Н2О2 і підігрівають до переходу зеленого кольору в жовтий - (K2CrO4). Записати рівняння відповідних реакцій .
в) У пробірку наливають розчин KMnO4, підкислюють його і додають розчин H2O2. Спостерігають обезбарвлення розчину і виділення О2 .
Дослід 3. Окисні властивості сірки (виконують у шафі)
У пробірці змішують 1,7г порошку Fe і 1г порошку S. Закріплюють у штативі вертикально і сильно прогрівають полум’ям пальника (обережно, реакція сильно екзотермічна!). Записують спостереження.
Дослід 4. Одерження сульфідів металів
До розчинів солей Zn2+, Mn2+, Cd2+, Pb 2+, Cu2+, Ni2+, додають 2-3 краплі розчину Na2S. Відмічають колір осадів, що утворилися.
Дослід 5. Відновні властивості сульфідів
В одну пробірку наливають розчин KMnO4, в іншу - розчин K2Cr2O7, підкислюють обидва розчини і додають декілька крапель розчину Na2S. Записують спостереження і рівняння відповідних реакцій.
Дослід 6. Одержання SO2 (виконується у витяжній шафі)
У пробірку насипають невелику кількість порошку Na2SO3 і краплями додають розбавлений розчин HCl. Спостерігають виділення газу, який випробовують вологим синім лакмусовим папірцем.
Дослід 7. Окисно-відновна подвійність сульфітів
а) У дві пробірки наливають розчин Na2SO3, підкислюють його і додають кілька крапель розчинів Na2S - у першу пробірку і розчин KІ - у другу. Записують спостереження, складають рівняння реакцій і розраховують Е.Р.С.
б) На підкислений розчин Na2SO3 у чотирьох пробірках діють розчинами Br2, І2, KMnO4, K2Cr2O7. Записують спостереження, складають рівняння відповідних реакцій і підраховують Е.Р.С. для кожної реакції.
Дослід 8. Відновні властивості тіосульфату натрію Na2SO3
У чотири пробірки наливають окремо розчин Cl2 (хлорної води), розчини KMnO4, K2Cr2O7 i Ш2 (йодної води). Розчини KMnO4 і K2Cr2O7 підкислюють H2SO4. По краплям додають у кожну пробірку розчин тіосульфату Na2S2O3. Спостерігають зміну забарвлення розчинів, складають рівняння кожної реакції, маючи на увазі, що сильними окисниками (перші три пробірки) тіосульфат окислюється до NaHSO4, а більш слабкими (І2) - до тетратіонату Na2S4O6.
