
MolBiol_sivolob
.pdf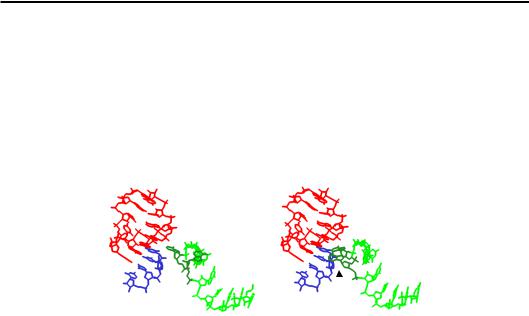
Розділ 8. Синтез білків
антикодонову частину аа-тРНК на кодоні мРНК. Оскільки субодиниці рибосоми взаємодіють між собою, структурна перебудова маленької субодиниці не залишається непомітною для великої: конформаційні зміни відбуваються і тут. Одним із результатів перебудови є зміна взаємодії між EF1 і відповідним сайтом його зв'язування в основі стебла L7/12, яка приводить до активації GTPази, – відбувається гідроліз GTP, конформаційна перебудова EF1 із втратою спорідненості до рибосоми та тРНК і дисоціація фактора.
|
тРНК |
|
|
16S |
|
кодон |
|
|
|
|
|
A1493 |
||
|
A1492 |
|
Рис. 8.19. Взаємодія в межах А-сайта на маленькій субодиниці між кодоном, антикодоновою петлею тРНК і частиною рРНК 16S у випадку неспорідненого (ліворуч, 1N36 – друга кодон-антикодонова пара основ є некомплементарною)
і спорідненого (праворуч, 1IBM) антикодонів
Акомодація аа-тРНК завершує першу стадію елонгаційного циклу. Перед гідролізом GTP розміщення аа-тРНК на рибосомі суттєво відрізняється від “кінцевої точки” процесу зв'язування – локалізації
вА-сайті. Оскільки сайти зв'язування тРНК формуються двома субодиницями (мають дві “половини”), “остаточний” А-сайт позначають як А/А. У складі комплексу з EF1 антикодонова частина розміщена
вА-сайті на маленькій субодиниці, але акцепторна частина утримується в основі стебла L7/12 на великій – так зване А/Т положення (рис. 8.20). При цьому антикодонове стебло суттєво вигинається – фіксація антикодона та акцепторного стебла підтримує напружену конформацію тРНК. Після гідролізу GTP, коли EF1 дисоціює, один із фіксаторів зникає – тРНК, ніби пружина, розпрямляється, її акцепторне стебло автоматично опиняється в А-сайті на великій субодиниці – у зоні пептидилтрансферазного центру. Ефективність цього процесу акомодації (рис. 8.20) залежить від жорсткості фіксації антикодонової петлі тРНК на маленькій субодиниці. Якщо взаємодія між кодоном
245

Сиволоб А.В. Молекулярна біологія
і антикодоном не є повністю комплементарною, аа-тРНК просто дисоціює від рибосоми – це друга (після первинного зв'язування) можливість виправити помилку впізнання кодона.
A/A
акомодація
A/T
Рис. 8.20. А/Т (1QZA) і А/А (1QZB) положення аа-тРНК на рибосомі до й після акомодації відповідно
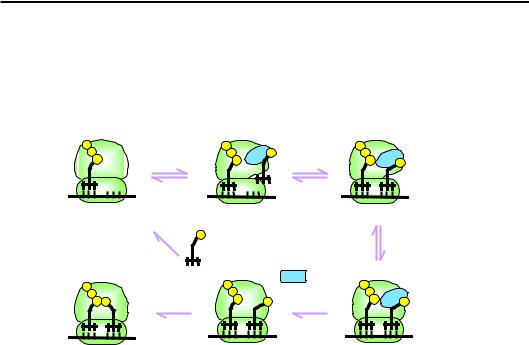
Загальний сценарій зв'язування аа-тРНК з рибосомою зобра-
жено на рис. 8.21.
•На першому етапі початкового відбору аа-тРНК відбувається швидка асоціація / дисоціація потрійних комплексів EF1·GTP–аа-тРНК з відкритою формою рибосоми, яка фіксується за рахунок взаємодій з EF1. Відкрита форма сприяє також дисоціації деаміноацильованої тРНК з Е-сайта рибосоми (не показано на рис. 8.21).
•При утворенні комплементарної кодон-антикодонової подвійної спіралі, вона стабілізується за рахунок взаємодій з нуклеотидами рРНК 16S. Локальна конформаційна зміна 16S, яка є наслідком цих взаємодій, спрацьовує як тригер структурної перебудови спочатку маленької, потім великої субодиниць. Унаслідок перебудови антикодонова петля тРНК жорстко замикається на маленькій субодиниці, акцепторне стебло – на великій у основі пальця L7/12, і EF1 набуває GTPазної активності.
•Гідроліз GTP розмикає ланцюг подій на дві частини, роблячи його необоротним. Після гідролізу EF1·GDP дисоціює, залишаючи аа-тРНК у напруженій конформації.
246
Розділ 8. Синтез білків
•Далі процес розгалужується: або, при недостатньо міцних кодон-антикодонових взаємодіях, відбувається дисоціація аа-тРНК, яка повертає систему до вихідного стану, або здійснюється акомодація – релаксація напруженої аа-тРНК, яка виводить її акцепторний кінець до пептидилтрансферазного центру.
Початкове 
 123
123 
 зв'язування
зв'язування
|
|
|
|
Впізнання |
|
|
|
|
1 |
2 |
T 4 |
кодона |
1 |
2 |
|
|
|
|
|
G |
P |
|
|
|
|
P |
|
3 |
|
|
|
|
3 |
G |
4 |
5' |
3' |
5' |
3' |
5' |
3' |
P |
A |
|
P A |
|
P A |
Структурна 4 зміна
EF1 рибосоми
123 4 |
123 |
GDP |
4 |
12 |
|
P |
|
3 |
T |
4 |
|
G |
|
||
5' |
3' |
5' |
|
3' |
5' |
3' |
P |
A Акомодація |
P A |
Гідроліз |
|
P A |
|
|
|
|
|
GTP |
|
|
Рис. 8.21. Схема основних подій при зв'язуванні аа-тРНК з А-сайтом рибосоми. Е-сайт тРНК не показано для спрощення
Загальним наслідком процесу зв'язування, таким чином, є повна підготовка системи трансляції до наступного етапу елонгаційного циклу.
Транспептидація
Реакція перенесення пептидилу – транспептидація – полягає в руйнуванні ковалентного зв'язку між карбоксильною групою С-кінцевої амінокислоти пептидилу та 3'-кінцевою ОН-групою пептидил-тРНК і утворенні натомість пептидного зв'язку між звільненою карбоксильною групою та аміногрупою амінокислоти у складі аа-тРНК. Таким чином, при транспептидації пептидил переноситься з Р- до А-сайта рибосоми: в А-сайті опиняється пептидил-тРНК із подовженим на одну амінокислоту пептидилом, у Р-сайті залишається деаміноацильована тРНК (див. рис. 8.15).
Стандартна вільна енергія гідролізу зв'язку між пептидилом і тРНК оцінюється приблизно в –7,5 ккал/моль, енергія гідролізу пептидного зв'язку –0,5 ккал/моль. Отже, загальний енергетичний ба-
247
Сиволоб А.В. Молекулярна біологія
ланс транспептидації ~ –7,0 ккал/моль: це спонтанний процес, який не потребує джерел енергії – енергію було заощаджено при аміноацилюванні тРНК (див. підрозділ, присвячений тРНК).
N
NH Rn-1
CH
C
O 

NH
CH
Rn  C
C
OH O
A O  O
O
C
C
P
N |
A |
|
|
|
N |
||
|
|
H |
|
N |
|
2 |
|
N |
|||
|
|||
|
N |
|
|
O |
H |
H |
|
N |
|||
|
Rn+1 |
||
|
CH |
||
|
|
C O |
|
|
OH |
O |
|
A O  O
O
C
C
A
N
NH Rn-1
CH
C O 

NH
Rn CH C
OH O
A O  O
O
C
C
P
N |
A |
|
|
N |
|
|
H |
|
N |
2 |
|
N |
||
|
||
|
N+ |
|
|
H |
O- |
|
|
|
N |
|
|
|
|
|
|
NH |
|
|
|
|
|
|
|
|
||
|
|
Rn+1 |
|
|
|
|
|
AN |
||
|
CH |
|
NH |
|
|
|
N |
|||
|
|
C |
O |
Rn-1 |
|
|
|
|
H |
|
|
|
CH |
|
N |
|
|
2 |
|||
OH |
O |
|
C |
|
|
|
N |
|||
|
|
|
|
|
|
|||||
|
|
|
|
N |
|
|||||
|
|
|
|
O |
|
|
|
|||
|
|
|
|
NH |
|
|
|
|||
|
|
|
|
|
|
|
|
|
||
|
O |
|
|
|
|
|
|
|
|
|
A |
|
O |
|
CH |
|
O |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
C |
|
Rn |
C |
NH |
|
|
||
|
|
|
C |
OH |
OH |
|
|
CH |
|
Rn+1 |
|
A |
|
|
|
|
|
C |
O |
||
|
|
|
|
|
|
|
|
|||
|
|
|
O |
O |
|
OH |
O |
|
||
|
|
|
|
|
|
|||||
|
|
|
|
A |
|
|
|
|
|
|
|
|
|
|
C |
|
|
O |
|
O |
|
|
|
|
|
|
|
A |
|
|||
|
|
|
|
|
C |
|
|
|
C |
|
|
|
|
|
P |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
A |
|
|
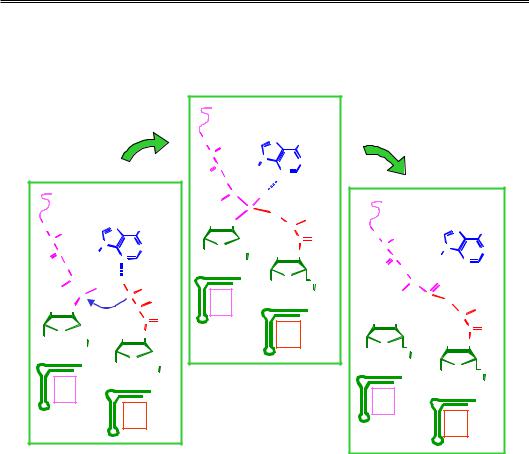
Рис. 8.22. Процес перенесення пептидилу з Р-сайта на аа-тРНК
вА-сайті через інтермедіатну сполуку, стабілізовану взаємодією
заденозином (А синього кольору) рРНК 23S. Амінокислотні бокові залишки R пронумеровані в порядку приєднання їх до поліпептидного ланцюга
Процес транспептидації, що відбувається безпосередньо після акомодації аа-тРНК, є найшвидчим етапом елонгаційного циклу. Каталіз реакції здійснюється пептидилтрансферазним центром великої субодиниці рибосоми, розташованим в основі центрального протуберанця (див. рис. 8.8) і формується пептидилтрансферазною петлею рРНК 23S. У радіусі ~18 Å від субстратів реакції немає жодної білкової хімічної групи, тобто рибосома – це рибозим. Слід, проте, ще раз зауважити, що вільна рРНК 23S не має каталітичної активності – активна конформація рРНК реалізується лише в комплексі з певним мінімальним набором білків.
248

Розділ 8. Синтез білків
Реакція транспептидації проходить через утворення інтермедіатної сполуки з формуванням зв'язку між N аміногрупи аа-тРНК і С, яким пептидил приєднаний до тРНК, атом оксигену набуває при цьому негативного заряду (рис. 8.22). Утворенню інтермедіату передує захоплення протона аміногрупи атомом N3 аденіну, що знаходиться в активному центрі. Легка іонізація N3 зумовлена його особливим мікрооточенням у складі рРНК 23S, протонований азот стабілізує негативно заряджений О. Далі протон переноситься на 3'-ОН групу пеп- тидил-тРНК, яка, відповідно, стає деаміноацильованою – втрачає зв'язок із С, замість якого остаточно формується пептидний зв'язок.
Механізм каталізу транспептидації є цілком аналогічним до такого білкових ферментів (див. розділ 2): рибосома здійснює жорстке взаємне орієнтування субстратів у активному центрі (і ця обставина – ентропійний каталіз – є головним фактором прискорення реакції транспептидації), а також завдяки створенню специфічного мікрооточення певної хімічної групи (аденіну) забезпечує стабілізацію проміжного високоенергетичного стану.
Транслокація
Результатом транспептидації є значне перегрупування лігандів, зв'я- заних з рибосомою: пептидил-тРНК опиняється в А-сайті, деаміноацильована тРНК – у Р-сайті. Ураховуючи підвищену спорідненість акцепторної частини пептидил-тРНК до Р-сайта, рибосома має спонтанно пересунутися вздовж мРНК у напрямку до її 3'-кінця, і таке пересування – транслокація – має розпочатися з руху великої субодиниці (рис. 8.23). На проміжній стадії виникають гібридні сайти А/Р і Р/Е – стани, коли акцепторні частини тРНК уже знаходяться в Р (або Е) сайті на великій субодиниці, але антикодонові частини – ще в А (або Р) сайті.
Зрозуміло, що рух субодиниць передбачає послаблення взаємодій між ними – певний розблокований після транспептидації, відкритий структурний стан рибосоми. Зрозуміло також, що послаблення взаємодій між субодиницями є енергетично невигідним. Відповідно, хоча транслокація є внутрішньою властивістю рибосоми і відбувається спонтанно (вільна енергія знижується в кінцевому стані за рахунок високої спорідненості пептидил-тРНК до Р-сайта), швидкість руху є дуже повільною в позафакторній системі in vitro, оскільки процес проходить через проміжний високоенергетичний стан. In vivo фактором прискорення процесу є білок EF2 (інше позначення – EF-G).
249
Сиволоб А.В. Молекулярна біологія
пептидил
E |
POH A |
|
E |
P |
A |
|
тРНК |
|
Велика
субодиниця
E OH P |
A |
|
E |
P |
A |
|
EOH P |
A |
E OH P |
A |
||
E |
P |
A |
|
E |
P |
A |
|
|
|
Маленька |
|
|
|
|
|
|
субодиниця |
|
|
|
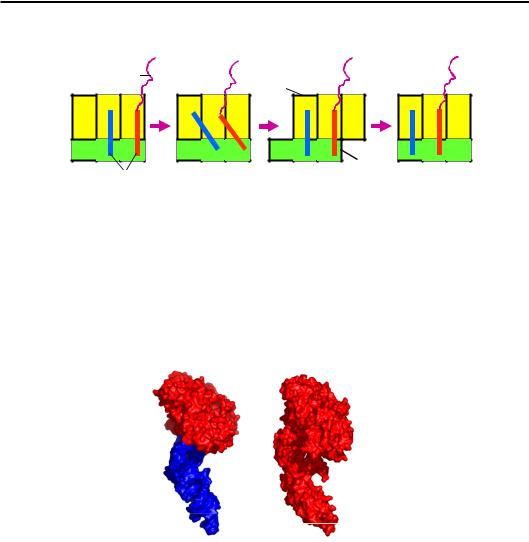
Рис. 8.23. Схема транслокації рибосоми через проміжну стадію гібридних сайтів
Частина молекули EF2 є гомологічною білку EF1 – також має сайт зв'язування GTP/GDP і також взаємодіє з великою субодиницею рибосоми в основі пальця L7/12. Але у складі білка є ще один додатковий домен, який мімікрує під структуру антикодонової частини тРНК, – структура білка в цілому нагадує комплекс EF1–тРНК (рис. 8.24).
EF1 EF2
тРНК
Рис. 8.24. Поверхня комплексу EF1–тРНК (структура з рис. 8.17) і білка EF2 (2EFG)
Фактор EF2 існує у принаймні чотирьох структурних станах залежно від типу зв'язаного ліганду:
1)EF2·GTP поза рибосомою – має високу спорідненість до рибосоми;
2)EF2·GTP на рибосомі – активна GTPаза;
3)EF2·GDP·Pi – після гідролізу GTP (Pi – неорганічний фосфат);
4)EF2·GDP після дисоціації фосфату – має низьку спорідненість до рибосоми.
250

Розділ 8. Синтез білків
Вільний від будь-якого ліганду білок не має впливу на транслокацію, однак у комплексі з будь-яким гуаніновим нуклеотидом (включаючи також аналоги GTP, що не можуть бути гідролізовані) фактор прискорює транслокацію за рахунок своєї спорідненості до проміжного відкритого стану рибосоми. Проте у випадку гідролізу GTP (який передує остаточній транслокації) швидкість переміщення рибосоми підвищується ще в ~50 разів: найефективнішим “стабілізатором” відкритого стану рибосоми виявляється форма EF2·GDP·Pi.
Отже, сценарій транслокації можна уявити наступним чином
(рис. 8.25).
•Після транспептидації рибосома перебуває в рівновазі між закритою та відкритою формою. Тільки друга форма здатна до транслокації, але вона у той самий час є більш високоенергетичною – рівновага зсунута в бік закритої форми.
•Взаємодія з EF2·GTP стабілізує відкриту форму рибосоми. Швидко після зв'язування, за рахунок взаємодії з сайтом G-білків у основі стебла L7/12, EF2 набуває GTPазної активності – відбувається гідроліз GTP і перехід EF2 у структурну форму, що найефективніше сприяє розблокуванню рибосоми.
•У розблокованій формі рибосома рухається вздовж мРНК (зв'язок мРНК з молекулами тРНК зберігається, тобто вона переміщується також відносно тРНК). Цей рух є броунівським (одномірна дифузія під дією теплових флуктуацій), але спорідненість пептидил-тРНК до Р-сайта робить напрямок до 3'-кінця мРНК більш імовірним. Крім того, “тРНК-подібний” структурний домен EF2 взаємодіє з маленькою субодиницею в межах А-сайта, сприяючи витісненню звідти антикодонової частини пептидил-тРНК.
•Одночасно з переміщенням, і незалежно від нього, відбувається дисоціація неорганічного фосфату. EF2, який залишається в комплексі з GDP, втрачаючи спорідненість, дисоціює від рибосоми, яка, у свою чергу, повертається до закритого структурного стану.
Урезультаті система є готовою до наступного елонгаційного циклу: новий кодон опинився в А-сайті, сам А-сайт є вільним від тРНК. Деаміноацильована тРНК, яка в результаті транслокації опинилася
вЕ-сайті рибосоми, може дисоціювати звідти відразу, або залишитися до етапу зв'язування наступної аа-тРНК.
251



