
- •10.Применение второго начала тд к живым организмам. Математическое выражение 2 начала тд для открытых систем.
- •11. Энергия Гиббса как функция состояния системы и критерий направленности процесса.
- •14. Закон действующих масс для химического равновесия. Константа химического равновесия, способы ее выражения. Прогнозирование смещения химического равновесия.
- •18. Понятие о стационарном состоянии живого организма, его характеристики. Сходство и отличие стационарного состояния от химического равновесия. Гомеостаз и адаптация организма.
- •20. Концентрация растворов, способы ее выражения. Массовая доля, молярная концентрация, моляльная концентрация, молярная концентрация эквивалента, молярная доля и титр.
- •22. Насыщенные, ненасыщенные и перенасыщенные растворы. Растворимость, единицы ее измерения. Влияние температуры на процесс растворения твердых, жидких и газообразных веществ
- •23. Законы Генри, Дальтона, Сеченова. Применение этих законов при лечении кессонной болезни, лечении в барокамере и исследовании электролитного состава крови.
- •34. Буферная емкость. Влияние добавления или щелочи на pH среды буферных систем. Буферная емкость по кислоте(Ва) и по щелочи(Вв). Факторы, определяющие буферную емкость.
- •35. Буферные системы крови. Бикарбонатная, фосфатная, белковая и гемоглобиновая буферные системы. Их состав, механизм действия в присутствии кислот и щелочей.
- •36. Нарушение кислотно-щелочного равновесия. Ацидоз, алкалоз. Способы их устранения.
- •39. Влияние концентрации на скорость химической реакции. Закон действующих масс.
- •41. Кинетическое уравнение реакции второго порядка. Расчет константы скорости для реакций второго порядка. Период полураспада для реакций второго порядка. Понятие о фармакокинетике.
- •42. Зависимость скорости реакции от температуры. Правило Вант-Гоффа.
- •43. Теория активных соударений Аррениуса. Энергия активации. Уравнение Аррениуса в экспоненциальном и дифференциальном виде. Связь величины энергии активации со скоростью реакции.
- •44. Понятие о теории переходного состояния. Катализ и катализаторы. Механизм действия гомогенного катализа.
- •45. Биологические катализаторы – ферменты. Особенности ферментативного катализа. Уравнение
- •46. Комплексные соединения. Состав и строение, исходя из теории лигандообменных равновесий а. Вернера.
- •48. Внутрикомплексные соединения. Строение и типы связей в молекуле внутрикомплексных соединений.
- •51. Устойчивость комплексных соединений. Первичная и вторичная диссоциация комплексных соединений. Константы нестойкости и устойчивости комплекса. Константы устойчивости комплексных соединений.
- •52. Биогенные элементы. Органогенные элементы и их роль в живой клетке. Металлы жизни.
- •56. Химия элементов d-блока. Электронные структуры атомов и катионов. Наиболее важные биогенные элементы d-блока.
- •71. Адсорбция. Понятие адсорбента и адсорбтива. Адсорбционная система типа жидкость-жидкость. Уравнение Гиббса для расчета адсорбции, его анализ. Изотерма адсорбции. Строение адсорбционного слоя.
- •73. Дисперсные системы. Классификация по степени дисперсности и агрегатному состоянию. Особенности коллоидного состояния. Условия и методы получения коллоидных растворов.
- •74. Методы очистки коллоидных растворов. Фильтрация, ультрафильтрация, диализ. Электродиализ. Вивидиализ. Принцип работы искусственной почки.
- •75. Электрокинетические явления. Электрофорез и Электроосмос. Строение коллоидной частицы. Мицелла, гранула, адсорбционный и диффузный слой. Стабилизация структуры мицеллы.
- •76. Устойчевость коллоидных систем. Агрегативная и кинетическая устойчевость коллоидных систем. Явление коагуляции.
51. Устойчивость комплексных соединений. Первичная и вторичная диссоциация комплексных соединений. Константы нестойкости и устойчивости комплекса. Константы устойчивости комплексных соединений.
Внутренняя и внешняя структура комплекса сильно различается по устойчивости. В растворах комплексных соединений имеет место первичная и вторичная диссоциация.
Первичная диссоциация – отщепление сферы внешней от внутренней протекает как у сильных электролитов практически полностью(необратимо)
[Ag(NH₃)₂]Cl
 [Ag(NH₃)₂]+
+ Cl-
[Ag(NH₃)₂]+
+ Cl-
Вторичная диссоциация характеризует диссоциацию самого иона, а т.к. лиганды находятся во внутренней сфере и связаны с центральным ионом значительно прочнее, поэтому отщепляются лишь в небольшой степени(обратимый процесс)
[Ag(NH₃)₂]+
 Ag+
+ 2NH₃
Ag+
+ 2NH₃
Вторичная стадия диссоциации подчиняется закону действующих масс и характеризуется константой нестойкости – характеризует неустойчивость комплекса иона.
Kн
=
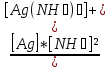 = 6,8 * 10-8
= 6,8 * 10-8
Величина обратная Kн называется Куст
Куст
=
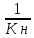
52. Биогенные элементы. Органогенные элементы и их роль в живой клетке. Металлы жизни.
Биогенные элементы - элементы необходимые для построения и жизнедеятельности клеток и организмов.
Al, O, N, S, P, С, Са, Mg, К, Na, Сl, I, Mn, Со, Те, Мо, V, Fe, Sb, Br, F, Li
Среди них наблюдают «10 металлов жизни»: Са, Mg, К, Na – I остов десятки сотни г, Fe, Со, Mn, Сu, Zn, Мо – II остов десятки доли г
Zn – поджелудочная железа, половые органы, гипофиз
I – щитовидная железа
F – эмаль зубов
Аs, Аl, V – волосы, ногти
Са, Нg, Мb – почки
Мn, Сr, Вr – гипофиз
Макроэлементы – галогены – составляющие белков, нуклеиновых кислот, углеводов, липидов. Органогены: О, С, Н, Р, S, N
Р – твердые ткани зубов в виде гидроксиолатитов
В организме человека поддерживается баланс оптимальной концентрации биогенных элементов – гомеостаз. Нарушение этого баланса приводит к различным заболеваниям.
53. Классификация химических элементов в организме по Вернадскому. Роль макро – и микро- элементов в живом организме. Концентрирование химических элементов в органах, тканях и биожидкостях человека. Эндемические элементы.
В зависимости от среды содержания элементов в живых организмах Вернадский разделил их на 3 группы:
Макроэлементы: 10-2% в организме, к ним относят О, С, Н, N, P, S – органогены, Са, Мg,Na, K, Li
Микроэлементы: 10-3 – 10-5% в пределах Zn, Cr, Su, Se, l, Cu, As, F, Br, Co, Fe, Mo
Входят в состав ферментов, гормонов, витаминов, биологически активных веществ в качестве комплексообразователя; участвуют в обмене веществ, процессах размножения, тканевом дыхании; участвуют в ОВР.
Влияют на процесс кроветворения, проницаемость сосудов и тканей.
Ультрамикроэлементы – не превысят 10-5% Hg, Au, То, Ra, Аl, U, Ni, В, V, Ва
Макроэлементы – галогены – составляющие белков, нуклеиновых кислот, углеводов, липидов. Органогены: О, С, Н, Р, S, N
Р – твердые ткани зубов в виде гидроксиолатитов.
Са – в костной и зубной ткани
NaCl – во внеклеточных областях
К, Мg – во внутриклеточных областях
Мg – твердые ткани зубов в виде Мg3(PO4)2
К, Na – в виде фторидов, в состав костной ткани
В организме человека поддерживается баланс оптимальной концентрации биогенных элементов – гомеостаз. Нарушение этого баланса приводит к различным заболеваниям.
F – кариес
I – эндемические заболевания
Эндемические заболевания: с аномалиями содержания некоторых элементов в почве, водоемах, той или иной биологической зоны.
54. Общая характеристика s-элементов. Валентные электроны. Изменение активности s-элементов в группе. Степень окисления. Щелочные металлы, их химические свойства. Особенности свойств лития. Оксиды, пероксиды, надпероксиды щелочных металлов. Биологическая роль натрия и калия. Натрий-калиевый насос. Соединения щелочных металлов, применяемых в медицине.
Находятся в Iа и IIа групп главной подгруппы, а также Не.
Валентными являются s-электроны. ns1 – I группа Н, Li, Na, Rb, Cs, Fe
ns2 – II группа Be и щелочноземельные металлы: Mg, Са, Sr, Ва, Ra
Свойства щелочных металлов: сверху вниз
Радиус атомов в Iа подгруппе увеличивается
Энергия ионизации уменьшается
Сверху вниз растет активность. Исходя из строения атомы Iа группы проявляется степень окисления = +1, все металлы – восстановители, а их ионы в степени окисления +1 будут окислителями.
Li – проявляет стабильную степень окисления = +1 тем не менее из-за наличия 2р оболочки. Химия Li отличается от химии его соседей по группе
Li+1 – лучший комплексообразователь
Все щелочные металлы энергично соединяются с кислородом, только Li образует оксид лития, а остальные металлы дают пероксиды и надпероксиды.
Химические свойства:
Взаимодействие с кислородом:
4Li
+ O2
 2Li2O
2Li2O
2Na
+
O2
 Na2O2
Na2O2
К
+
O2
 КO2
КO2
Пероксиды и надпероксиды являются солями сильных оснований и слабых кислот => подвергаются гидролизу
Na2O2
+Н2О
 2NaOH + Н2О2
2NaOH + Н2О2
КО2
+
Н2О
 2КОН + Н2О2
+ О2
2КОН + Н2О2
+ О2
Пероксиды и надпероксиды сильные окислители используются для получения кислорода на космических кораблях и подводных лодках.
Взаимодействие с водой:
2Li
+ 2Н2О
 2LiОН + Н2
2LiОН + Н2
Взаимодействие с кислотами
Взаимодействие с водородом
Взаимодействие с галогенами
Все соли щелочных металлов растворимы в воде, только литий образует плохорастворимые соли: Li3PO4, Li2CO3, LiF
Концентрация ионов натрия внутри клетки в 15раз меньше, чем во внеклеточной жидкости, а концентрация ионов калия в 35 раз больше внутри клетки, чем вне её.
Натрий-калиевый раствор обеспечивает перенос ионов, через плазматическую мембрану, против градиента концентрации за счет гидролиза 1 молекулы АТФ, 3 иона натрия выводят из клетки, а 2 иона калия поставляет внутрь клетки. Этот дисбаланс электрических зарядов служит при чиной возникновения разности потенциалов на плазматической мембране. Внутренняя сторона мембраны заряжена отрицательно по отношению к внешней поверхности мембраны.
Na+ - необходим для сокращения мышц
К+ - способствует расслаблению
Избыток Na+ - гипертония, отеки
Na+ - участвует в поддержании соматического давления(гомеостаза), обеспечивает кислотно-основное равновесие, регулирует водный обмен. Регулирует рН внутренней среды организма, участвует в передаче нервных импульсов через мембраны нервных клеток.
К+ - распространен в печени, почках, сердце, крови, море: участвует в функционировании сердца, проведении нервных импульсов, участвует в обменных реакциях.
Недостаток К – мышечная слабость, раздражительность, спазмы мышц
Избыток К – возбуждение ЦНС, маниакальное состояние причина остановки сердца
NaCl – используют дл промывания желудка, очистки гнойных ран, при отравлении Ag+
Li – в печени, почках, селезенке, легких, молоке, мышцах. Оказывает положительное влияние на больных с маниакальной депрессией, снижает эмоциональное напряжение (Li2CO3)
NaHCO3 – при ацидозе, сахарном диабете, повышает кислотность желудочного сока, при воспалительных заболеваниях глаз, горла, за счет выделяющейся щелочи
КСl – уменьшает возбудимость сердечной мышцы
Na2SO4*10 Н2О – глауберова соль – расслабляющее средство
55. s-элементов llа группы. Степени окисления. Тип гибридизации атомных орбиталей. Щелочноземельные элементы. Особенности свойств бериллия. Биологическая роль ионов магния и кальция. Антагонизм ионов магния и кальция. Соединения магния и кальция, применяемы в медицине.
Степень окисления +2 Ве, Mg, Са, Sr, Ва, Ra
sp-гибридизация
Ca, Sr, Ве – проявляют большие сходства между собой и называются щелочноземельными
Ве – «стоит особняком» из-за наличия гелиевого экрана
Амфотерность Ве:
ВеО
+ 2НСl
 ВеСl2
+ Н2О
ВеСl2
+ Н2О
ВеО
+ 2NaOH +
Н2О
 Na2[Ве(ОН)4]
Na2[Ве(ОН)4]
При
сплавлении ВеО + 2КOH
 К2ВеО2
+ Н2О
К2ВеО2
+ Н2О
Са+2 – регулятор внутриклеточных процессов: сокращение мышц, регуляции сердечного ритма, передача нервного импульса, участвует в свертывании крови, влияет на кислотно-основный баланс, оказывает влияние на активность эндокринной системы. Противовоспалительное действие.
Избыток Са+2 – опасность остановки сердца, увеличивается свертываемость крови
Mg+2 – биологические антагонисты ионов Са+2: поддерживает осмотическое давление внутри клеток; образует комплекс с АТФ, белками; входит в состав ферментов; с их участием формируются рибосомы, активируется процесс синтеза белка; способствует понижению артериального давления крови; усиливает перестатику кишечника; усиливает секрецию желчи.
Са(С6Н11О6)2 – глюконат кальция – восполнение недостатка кальция
СаСl2*6Н2О – кровеостанавливающее, противовоспалительное действие, антидот при отравлениях солями магния
СаСО3 – антоцидное средство, при повышении кислотности желудочного сока
МgO – «жженая магнезия» - антоцидное средство при повышенной кислотности желудочного сока
МgO с МgO2 – «магний перекись» 85% и 15% антоцидное и бактериальное средство
MgSO4*Н2О – «горькая соль» - успокаивающее, снотворное, слабительное средство
Mg(ОН)2*MgCO3*H2О – «белая магнезия» - антоцидное, легкое слабительное средство
