
- •Контрольная работа № 3 Витамины.
- •1. Понятие о витаминах. Заслуги ученых в развитии учения о витаминах.
- •2. Классификация и номенклатура витаминов. Провитамины.
- •3. Гиповитаминозы, авитаминозы, гипервитаминозы, причины их возникновения.
- •4. Механизм действия жирорастворимых витаминов.
- •5. Механизм действия водорастворимых витаминов.
- •6. Витамин а. Хим. Строение, суточная потребность, био. Роль, явление недостаточности.
- •7. Витамин д. Хим. Строение, суточная потребность, био. Роль, явление недостаточности.
- •8. Витамин е. Хим. Строение, суточная потребность, био. Роль, явление недостаточности.
- •9. Витамин к. Хим. Строение, суточная потребность, био. Роль, явление недостаточности.
- •10. Витамин с. Хим. Строение, суточная потребность, био. Роль, явление недостаточности.
- •12. Витамин в2. Хим. Строение, распространение, суточная потребность, био. Роль, явление недостаточности.
- •13. Витамин в6. Хим. Строение, распространение, суточная потребность, био. Роль, явление недостаточности.
- •14. Витамин в12. Хим. Строение, распр., сут. Потребность, био. Роль, явление недостаточности.
- •15. Витамин Вс, Хим. Строение, распространение, суточная потребность, био. Роль, явление недостаточности.
- •16. Витамин рр, Хим. Строение, распространение, суточная потребность, био. Роль, явление недостаточности.
- •17. Витамин в5, Хим. Строение, распространение, суточная потребность, био.Роль, явление недостаточности.
- •18. Витамин н. Хим. Строение, распространение, суточная потребность, био. Роль, явление недостаточности.
- •19. Антивитамины. Механизм действия. Примеры.
12. Витамин в2. Хим. Строение, распространение, суточная потребность, био. Роль, явление недостаточности.
Витамин В2 (рибофлавин, витамин роста).
С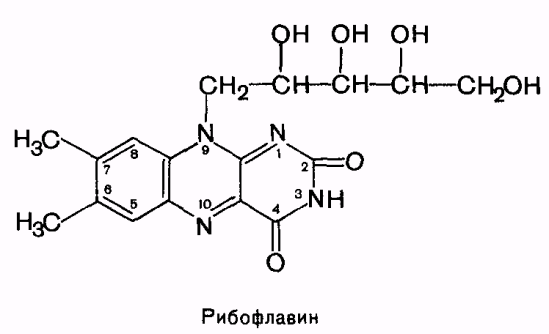 одержание:
1,7 мг (больше
в стар. возрасте и при тяжёлой физ.
работе). Почти во всех тканях и растениях;
хлеб, яйца, молоко, семена злаков. В
молоке в свободном состоянии, а в печени
и почках животных прочно связан с белками
в составе ФАД и ФМН.
одержание:
1,7 мг (больше
в стар. возрасте и при тяжёлой физ.
работе). Почти во всех тканях и растениях;
хлеб, яйца, молоко, семена злаков. В
молоке в свободном состоянии, а в печени
и почках животных прочно связан с белками
в составе ФАД и ФМН.
Структура: в основе гетероцикл. соединения изоаллоксазил, к которому в положении 9 присоединён 5-атомный спирт рибитол. Хорошо растворим в Н2О, устойчив в кислых ррах, разруш. в рН>=7. Чувствителен к УФ. Легко оксил. и восстанавливается. Жёлтый – в окис. форме, в восстан – бесцветный.
Недостаток: остановка роста, выпадение волос, воспалит. процессы языка, губ, углов рта, катаракта, кератиты, васкуляризация роговой оболочки. Авитаминоз: общая мыш. слабость и слабость сердечной мышцы.
Механизм/ Био. роль:
Входит в состав флавиновых коферментов, в частности ФМН, ФАД. 2 типа реакций, катализируемых этими ферментами:
1) фермент осущ. прямое окисление с участием О2 (дегидрирования). Это оксидазы L- и D-аминк-т, альдегидроксидаза, ксантиноксидаза и др;
2) вторая группа реакций, катализируемых флавопротеинами, характеризуется переносом электронов и протонов не от исходного субстрата, а от восстановленных пиридиновых коферментов.
ФМН синтезируется в организме животных из свободного рибофлавина и АТФ при участии спец. фермента рибофлавинкиназы:
Рибофлавин + АТФ =Mg2+= Рибофлавин-5’-фосфат (ФМН) + АДФ.
Образование ФАД в тканях также протекает при участии спец. АТФ-зависимого фермента ФМН-аденилтрансферазы:
ФМН + АТФ =Mg2+= ФАД + пирифосфат.
13. Витамин в6. Хим. Строение, распространение, суточная потребность, био. Роль, явление недостаточности.
Витамин В6 (пиридоксин, антидерматидный).
С одержание:
2 мг (косвенные
подсчёты, т.к. синтезируется микрофлорой
кишечника).
Хлеб,
горох, фасоль, мясо, почки, печень.
одержание:
2 мг (косвенные
подсчёты, т.к. синтезируется микрофлорой
кишечника).
Хлеб,
горох, фасоль, мясо, почки, печень.
Структура: Производное 3-оксипиридина. 3 производных: пиридоксин, пиридоксаль и пиридоксамин. В6 хорошо
растворим в Н2О и С2Н5ОН. Чувствительны к влиянию света при рН=7.
Недостаточность: акродиния (поражение кожи лапок, хвоста, носа, ушей). Шелушение кожи, её изъязвления. У человека недостаточность реже, хотя некоторые паллегроподобные дерматиты, не поддающиеся лечению РР, легко проходят при введении пиридоксина. У детей дерматиды, поражение НС (эпилептиформные припадки. Из биохим. нарушений при недостаточности В6 – гомоцистинурия и цистатионинурия, нарушения обмена типтофана, выражающиеся в повышении экскреции с мочой ксантуреновой к-ты и снижении кол-ва экскретируемой кинуреновой к-ты.
Механизм/ Био. роль:
К оферментные
фун-и выполняют только фосфорилированные
производные пиридоксаля и пиридоксамина.
Пиридоксалькиназа активна в ткани
мозга:
оферментные
фун-и выполняют только фосфорилированные
производные пиридоксаля и пиридоксамина.
Пиридоксалькиназа активна в ткани
мозга:
Пиридоксаль +АТФ = Пиридоксальфосфат + АДФ.
В животных тканях происходит взаимопревращения пиридоксальфосфата и пиридоксаминфсофата, в частности в реакциях трансаминирования, дезаминирования и декарбоксилирования аминок-т.
Пиридоксальфосфат явл. простетической группой аминотрансфераз, катализирующих обратимый перенос аминогруппы от аминок-т на альфа-кетокислоту, и декарбоксилаз аминок-т, осуществляющих необратимое отщепление СО2 от СООН-группы с образованием биогенных аминов. Установлена коферментная роль пиридоксальфосфата в ферментативных реакциях неоксиленного дезаминирования серина и треонина, оксиления трипфтофана, превращение S-содержащих аминок-т, взаимопревращения серина и глицина.
