
4 курс / Общая токсикология (доп.) / Toxikologia_ryb_Lukyanenko
.pdfконцентрациями в десятки раз более слабыми (0,001 N). Сходное поведение было отмечено и в растворах сернокислой меди. Растворы 0,01 или 0,001 рыбы не избегали, но в более концентрированных растворах (0,04 и 0,1) отмечена отчетливая способность рыб избегать эти токсические растворы.
По мнению Д. Джонса, имеется группа веществ, в которых реакция избегания проявляется слабо или отсутствует. В первую очередь это относится к растворам хлористой ртути.
Важное практическое значение имеют опыты с ядами, действующими преимущественно на нервную систему. Обнаружено, что гольяны плохо или совсем не способны избегать растворы с высокими концентрациями фенола (40, 100 и 400 мг/л). В растворах фенола 10 и 20 мг/л получены неопределенные данные, уменьшение концентрации фенола до 4 мг/л приводило к увеличению процента рыб, переходящих из токсического раствора в чистую воду. В течение 13 мин гольяны переходили зону вода-раствор около 30 раз, но так и не избежали развития некоторых симптомов фенольной интоксикации. Эти опыты согласуются с ранними наблюдениями В. Хейна (Hein, 1908) над форелью, которая избегала незначительные (4,5 мг/л) концентрации фенола и уходила в чистую воду.
М. М. Калабина и Ц. И. Роговская (1934) также считают, что рыбы уходят из загрязненных фенольными сточными водами рек в более чистые места при концентрациях фенола значительно меньших, чем минимальные смертельные (0,2-10 мг/л).
В опытах Д. Джонса с паракрезолом гольяны избегали токсический раствор 300 мг/л и совершенно не входили в него. Проявление реакции избегания было отмечено и при концентрации паракрезола 200 мг/л. При большем разведении, однако, способность гольянов обнаруживать и избегать токсические растворы резко упала. Тем не менее зона вода - раствор в опытах с паракрезолом 30, 40 и 100 мг/л являлась препятствием для рыб и можно было отметить некоторую негативную реакцию к токсическому раствору, хотя и менее выраженную, чем в опытах с концентрациями 200 и 300 мг/л.
Сходные данные получены и в опытах с ортокрезолом. Гольяны избегали растворы с высокими концентрациями яда - 400 мг/л, а при снижении концентрации ортокрезола (200, 100 и 30 мг/л) способность рыб «распознавать» растворы быстро уменьшается. Так, например, гольяны упорно входили из чистой воды в токсический раствор с концентрацией ортокрезола 200 мг/л. После восстановления рефлекса равновесия в чистой воде они вновь заплывали в токсический раствор. Поведение гольянов в растворах фенольных стоков химических фабрик, содержащих фенол, крезолы и небольшое количество ксиленола, было в основном сходно с тем, что отмечалось в опытах с чистыми крезолами. При разведении фенольных сточных вод (1:3 и 1:6) наблюдалась ярко выраженная реакция избегания токсического раствора. Последующее разведение токсического раствора (1:10; 1:20; 1:40 и 1:100) приводило к резкому уменьшению способности гольянов распознавать и избегать эти растворы.
На основе полученных данных Д. Джонс (1951, 1957) приходит, к выводу, что гольяны слабо или вовсе не способны обнаруживать и избегать различные концентрации веществ, действующих, по-видимому, на нервную систему рыб (фенол, орто- и паракрезол, анилин и т. д.). Избегание гольянами некоторых высоких концентраций (300 и 400 мг/л) орто- и паракрезола автор объясняет раздражающим влиянием этих веществ, отпугивающим рыб. Сопоставляя результаты своих опытов, Джонс предлагает следующее объяснение неспособности рыб избегать растворы фенольного ряда. Время, необходимое рыбам для избегания растворов фенольного ряда, и время, нарушающее такую способность, весьма близко по своему значению, вследствие чего рыбы не способны избегать ядовитые растворы. В опытах с растворами свинца и цинка время, необходимое для проявления реакции избегания, представляет собой небольшую часть времени, нарушающего способность осуществить ее, поэтому рыбы избегают эти растворы. Нам представляется, что такое объяснение весьма искусственно, так как в опытах с пара- и ортокрезолом имело место обратное явление: высокие концентрации яда, для которых характерно очень короткое время потери рефлекса равновесия и координированных движений, избегались гольянами, а более низкие нет. Чтобы обойти это противоречие, Джонс делает малоправдоподобное предположение о том, что у крезолов следует различать два механизма действия: а) возбуждающее, которое вызывает реакцию избегания; б) интоксикационный эффект, нарушающий координированное плавание. Исходя из этого (по Джонсу), при высоких концентрациях крезолов (300 и 400 мг/л) преобладает возбуждающее действие, а при более низких (200, 100 мг/л и ниже) возбуждающее влияние резко падает, в то время как интоксикационное остается. Такое предположение недостаточно обосновано и противоречит имеющимся экспериментальным данным, согласно которым время потери рефлекса равновесия в диапазоне концентраций от 100 до 400 мг/л примерно одинаково и даже несколько меньше при более высоких концентрациях. Известно, что чрезмерное раздражение рецепторов боковой линии приводит к потере рефлекса равновесия. Поэтому нельзя согласиться с мнением Джонса относительно механизмов реакции «обнаружения и избегания» рыбами ядов промышленных сточных вод. Описываемая реакция «обнаружения и избегания (of detecting and avoiding) на самом деле состоит из двух самостоятельных реакций: реакции обнаружения и реакции избегания, которые, разумеется, связаны между собой, но эта связь носит причинно-следственный характер. Между тем никто не обращал внимания на это весьма существенное обстоятельство, вследствие чего нередко впадали в ошибку при истолковании экспериментальных данных. Д. Джонс (1957), например, пишет: «рыбы почти не способны обнаруживать и избегать более высокие концентрации этих веществ» (имеется в виду фенол, пара- и ортокрезол) или «эти токсические растворы, которые
111
не распознаются, действуют как вид западни». Подобное утверждение не соответствует как фактическим данным самого Джонса, в частности, результатам опытов с растворами аммиака, меди и фенола, так и данным других авторов. Д. Хаслер и В. Висби (Hasler, Wisby, 1950), например, с помощью метода условных рефлексов выявили способность Hybor-hynchus not at us распознавать фенол в концентрациях 0,01 мг/л, а некоторые особи даже концентрации 0,0005 мг/л, что в сотни раз меньше концентраций, указанных Джонсом, который считает, что рыбы не обнаруживали концентрации фенола 100 мг/л и ниже. Данные Д. Хаслера и В. Висби согласуются с результатами опытов X. Нейрат (Neurath, 1949), X. Тейхмана (Teichmann, 1957), А. Марестрёма (Marestrom, 1959)
идругих относительно порогов обоняния рыб к различным органическим веществам. Так, Нейрат (1949) показала, что рыбы различают концентрации фенилэтилал-коголя в 250 раз меньшие, чем человек. Эти данные
нашли подтверждение в опытах Тейхмана (1957) по определению порога чувствительности угря к Р- фенилэтилалкоголю, который оказался равным 3-10-20.
Все эти данные показывают, что обонятельный анализатор, с присущей ему высокой чувствительностью, может играть ведущую роль в обнаружении и различении рыбами химических веществ, оказывающих токсическое действие на рыб.
Физиологические механизмы реакции обнаружения и реакции: избегания также различны. В основе реакции обнаружения токсических веществ лежит функциональная активность химического-анализатора, который объединяет вкус, обоняние и общее химическое чувство рыб. Поступающая информация анализируется центральной нервной системой и передается в локомоторный аппарат, функциональная активность которого лежит в основе реакции избегания. Исходя из этой схемы, обосновывающей различие между реакциями обнаружения и избегания, можно понять результаты опытов Джонса с ядами типа фенола. Эти яды, парализуя локомоторный аппарат рыб, делают невозможным осуществление реакции избегания, не оказывая при этом влияния на реакцию-обнаружения. Гораздо труднее понять описанную Джонсом реакцию рыб в растворах аммиака и меди, названную нами «парадоксальной» реакцией избегания.
Реакции обнаружения и избегания имеют огромный теоретический и практический интерес, их необходимо изучать в дальнейшем. Основное внимание следует уделить расширению ассортимента веществ, способных привлекать рыб или отпугивать от загрязненных стоков промышленных предприятий, поскольку работы в этом плане имеют важное значение не только для токсикологии рыб, но и при решении ряда других практических вопросов, таких, как привлечение рыб в рыбоподъемники и отпугивание от гидротехнических сооружений.
Вэтом плане интересны опыты Л. Марестрёма (Marestromr, 1959) с тринитрофенолом. Оказалось, что это вещество обладает явно выраженным привлекающим действием для рыб, отчетливая реакция которых отмечается при концентрации 0,38-10-5 и достигает максимума при концентрации 8-10-5. Более высокие концентрации 2,4,6-тринитрофенола 28-10-5 вызывают интоксикацию рыб. Из работ последнего времени (Jones et al., 1956, 1960) следует отметить обстоятельное исследование Л. Хогланда (Hoglund, 1961),. направленное на выявление реакции плотвы в условиях недостатка кислорода, избытка углекислоты и действия растворенных сульфитов. Рыбы избегали воду с низким содержанием кислорода и избытком углекислоты. Кроме того, они избегали растворы сульфитов, причем с удалением органов обоняния эта способность заметно снижалась.
Данные Л. Хогланда по избеганию рыбами сульфитных соединений подтверждают наблюдение Д. Джонса
идр. (Jones et al... 1956) об избегании рыбами сульфатных и сульфитных загрязнений бумажной фабрики. Экспериментальные данные позволяют предположить, что обнаружение и избегание рыбами ядов может
иметь существенное значение и в естественных условиях. Так, в сообщении С. П. Федия (1961) в Днепровском и Каховском водохранилищах с ростом концентрации мышьяка заметно уменьшается число видов рыб и резко снижается плотность ихтиофауны. Об этом свидетельствуют и многочисленные факты исчезновения ценных промысловых видов, как правило высокотребовательных к качеству воды, в загрязненных реках или в районах крупных промышленных узлов на Волге.
МЕХАНИЗМЫ ОТРАВЛЕНИЯ РЫБ. РОЛЬ РАЗЛИЧНЫХ ОТДЕЛОВ ГОЛОВНОГО МОЗГА РЫБ В РЕАКЦИИ НА ТОКСИЧЕСКОЕ ДЕЙСТВИЕ ЯДОВ ОРГАНИЧЕСКОГО РЯДА
Изучение механизмов токсического действия вредных веществ промышленных стоков представляет интерес для правильного выбора метода определения величины пороговой и предельно допустимой концентрации химического соединения.
В зависимости от химической природы действующего токсического агента его губительное действие может быть реализовано разными путями. В большинстве случаев яды неорганической природы и, прежде всего, соли тяжелых металлов, минеральные кислоты и сильные щелочи главным образом повреждают жабры. Различные соли свинца, цинка, меди, ртути, серебра, никеля, кадмия осаждают продукты секреции слизистой жабр, межпластинчатое пространство заполняется этим осадком и нормальное движение жаберных нитей становится невозможным. По уточненным данным английской лаборатории (W. P. R.,1957), первоначальный и основной токсический эффект солей тяжелых металлов - отделение эпителия от нитей жаберных пластинок.
112
Около половины жаберного эпителия сбрасывается ко времени потери рефлекса равновесия и 3/4 во время гибели. Высокие концентрации щелочей и кислот также вызывают коагуляцию жаберного секрета. В этих случаях непосредственной причиной гибели отравленных рыб служит удушье или асфиксия. Асфиксия может быть обусловлена двумя причинами: либо прекращением доступа кислорода к жабрам при нормальном уровне гемоглобина, либо нарушением условий транспортировки кислорода гемоглобином. Из этого следует, что соли тяжелых металлов, кислоты и щелочи вызывают асфиксию первым путем. Некоторые яды органического ряда, например ротенон, также оказывают действие на структуру жабр, и одно время считали, что механизм действия этого вещества объясняется гистолизом жабр и нарушением кровообращения. По данным П. Линдала и К. Оверга (Lindhal, Overg, 1960), первичное действие ротенона заключается в подавлении дыхания путем нарушения переноса электронов.
Цианистый водород и растворенные цианиды также вызывают асфиксию, но посредством угнетения способности тканей утилизировать кислород. Сероводород и растворимые сульфиды, как и цианистые соединения, тормозят утилизацию кислорода организмом. Это яды с выраженным внутренним действием. Сюда относятся вещества, оказывающие специфическое воздействие на гемоглобин рыб: сульфат натрия, цианистый калий, углекислый газ, аммиак. Углекислый газ, в частности, имеет выраженное сродство к гемоглобину и резко уменьшает способность крови переносить кислород. Аммиак также действует на рыб как внутренний яд. Хотя механизм его действия на рыб не изучен, однако у людей, как известно, он разрушает эритроциты, а гемоглобин при этом превращается в гематин.
Разделение ядов промышленных сточных вод по типу их действия на наружные и внутренние (Doudoroff, 1957) условно. Следует говорить о преимущественном наружном или внутреннем действии ядов на рыб, ибо с изменением концентрации токсического агента может меняться не только степень токсического эффекта, но и степень повреждения различных систем и структур организма, т. е. выраженность этого эффекта. Это в первую очередь относится к ядам неорганической природы. Действие на организм ядов органического ряда носит более сложный характер, они вызывают одновременное поражение различных функциональных систем и, прежде всего, центральной нервной системы.
Механизм отравления рыб ядами органической природы, такими, как разнообразные гомологи фенольного ряда, инсектициды, гербициды, многие красители и т. д., редко служил предметом специального внимания. Многие исследователи, на основе наблюдений за поведением рыб в токсических растворах этой группы веществ и внешним симптомокомплексом отравления рыб, приходят к выводу, что соединения этого ряда действуют на нервную систему. Но прямых доказательств участия центральной нервной системы в развитии токсического процесса представлено не было.
Мы предприняли ряд исследований, направленных на выявление роли центральной нервной системы в развитии внешних симптомов отравления рыб ядами органической природы. Фармакологический анализ путей воздействия фенола на рыб и механизмов ответной реакции, проведенный с помощью наркотиков и местных анестетиков (уретана, новокаина и кокаина), курареподобных препаратов (сукцинилхолина, флакседйла и парамиона), антихолине-стеразных препаратов (фосфакола, прозерина и эзерина), показал (Лукьяненко, 1965), что центральная нервная система и, в частности, головной мозг играет ведущую роль в проявлении и развитии внешних симптомов отравления рыб ядами органического ряда. Опыты с курареподобными препаратами выявили, что фенол и некоторые его гомологи (крезолы) не оказывают прямого раздражающего действия на мышцы тела рыб. Использование антихо-линзстеразных препаратов позволило обнаружить важную роль динамики ацетилхолинового метаболизма и, прежде всего, системы ацетилхолин - холинэстераза в холинэргических синапсах центральной нервной системы и нервно-мышечных синапсах в развитии сложного комплекса реакции рыб на токсическое воздействие. Эта точка зрения подтверждена биохимическими данными по изменению активности холинэстеразы под влиянием фенола (Лукьяненко и Петухова, 1966).
Оставался открытым вопрос о значении головного и спинного мозга в реакциях рыб на токсическое действие различных ядов с выраженным центральным действием. Известно, например, что в реакции рыб на действие альтерирующего раздражителя физической природы, каким является электрический ток, ведущее место занимает спинной мозг (Haskell et. al, 1954; Halsband, 1955 и др.). Определение роли головного и спинного мозга в развитии отравления рыб ядами органического ряда чрезвычайно важно и в практическом отношении. В зависимости от полученных данных будет решаться вопрос и об использовании тех или иных методов определения изменений функций нервной системы для биологического нормирования предельно допустимых концентраций этой группы веществ. Скажем, если окажется, что сдвиги наступают вследствие нарушении в деятельности спинного мозга, то для определения токсичности интересующей нас группы веществ будут использованы методы изучения функций цереброспинальной нервной системы, а не высших отделов центральной нервной системы.
Для решения поставленных вопросов проведен экспериментальный анализ роли головного и спинного мозга в реакции рыб на фенольное раздражение.
В первой серии опытов, проведенной на 25 спинальных карасях, полученных путем удаления головного мозга, было установлено, что реакция рыб на токсическое воздействие фенолом, проявляющаяся в бурной двигательной активности и последующих судорогах, отсутствовала. Спинальные рыбы, погруженные в раствор
113
фенола с концентрацией 100 мг/л, оставались неподвижными на всем протяжении наблюдений (до 2 ч). При воздействии на спинальных рыб переменным электрическим током они вздрагивали и перемещались.
Из данных этой серии опытов следует, что головной мозг играет определяющую роль в реакции рыб на воздействие фенолом.
Обезглавленные караси не реагировали на токсическое воздействие фенолом, как и караси, у которых был полностью вылущен головной мозг.
Реакция на электрический ток у обезглавленных карасей сохранялась.
Следующая серия опытов, поставленная на 25 карасях, была проведена для того, чтобы выявить влияние высокой перерезки спинного мозга на внешнюю картину фенольной интоксикации. Для этого спинной мозг отделялся от головного на уровне грудных плавников.
Поведение таких карасей в растворе фенола несколько отличалось от рыб из предыдущих опытов. У большинства подопытных карасей, погруженных в раствор фенола, отмечались беспокойные движения грудных плавников и мышц головы. Однако рыбы оставались неподвижными на дне аквариума. У некоторых особей наблюдались редкие вздрагивания всего туловища, но судороги, подобные тем, которые отмечались у контрольных карасей, так и не развивались.
В19 случаях из 25 отделение спинного мозга от головного на уровне грудных плавников более или менее полно снимало фенольную реакцию и прежде всего ее наиболее характерные компоненты - двигательную активность и судороги. У оставшихся шести карасей, несмотря на полную перерезку связей между головным и спинным мозгом, имели место интенсивные подергивания головной части туловища и спинного плавника. В отдельных случаях было замечено редкое импульсивное перемещение таких карасей под влиянием фенольного раздражения. Внимательный визуальный анализ характера перемещения оперированных карасей в токсическом растворе фенола позволяет предположить, что двигателем при таком перемещении является не хвостовая часть тела, как это происходит в норме, а передняя часть туловища. Ведущую роль при этом играют приводящие и отводящие мышцы грудных плавников, а задняя часть туловища выполняет статическую функцию.
Вопытах на 10 карасях было установлено, что внутримозговая инъекция 0,1 или 0,05 мл фенола (10 и 5 мг) через 30 - 40 сек приводила к развитию бурной двигательной активности и потере рефлекса равновесия. При предварительном разделении спинного и головного мозга ни в одном из 10 случаев описанные симптомы Г действия фенола не развились. Поэтому можно предположить, что фенол, проникая в общий круг кровообращения, не оказывает прямого действия на возбудимость спинного мозга, вследствие чего караси остаются неподвижными.
Как известно, передний мозг костистых рыб играет ведущую роль в дифференциации обонятельных раздражителей. Кроме того, по мнению некоторых авторов (Kumacura, 1928; Janzen, 1932) передний мозг рыб принимает участие в сложной координирующей деятельности центральной нервной системы. Поскольку фенол обладает выраженным запахом, можно было предположить, что раздражение, поступающее по обонятельному тракту в передний мозг, определяет латентный период наступающего генерализованного возбуждения в центральной нервной системе рыб. Для проверки этого предположения были проведены опыты на 15 карасях с вылущенным передним мозгом. Через 24 - 72 ч оперированных рыб, у которых не было заметных нарушений в статической или моторной функции, помещали в раствор фенола 100 мг/л. Реакция карасей на фенольное раздражение ничем существенно не отличалась от реакции контрольных карасей и развивалась полностью. Средняя величина латентного периода фенольной реакции подопытных карасей, равная 47 сек, оказалась весьма близкой латентному периоду контрольных карасей, равному 43 сек. Данные этой серии опытов отводят предположение, что переднему мозгу рыб принадлежит ведущая роль в определении скорости развития первоначального двигательного возбуждения, наступающего под влиянием фенола.
Чтобы проанализировать природу реакций, полученных у рыб с высокой перерезкой спинного мозга, и выяснить, сохранятся ли они, если будут нарушены не только нервные связи между спинным и головным мозгом, но и гуморальные, были проведены 15 опытов с препаратом изолированной головы. Сразу после отделения от туловища изолированную голову помещали в токсический раствор фенола. Через 60-90 сек после погружения появлялись дыхательные движения оперкулярных крышек. Опыты показали, что после прекращения притока крови дыхательный центр карасей может действовать еще около 1 ч. Частота дыхательных движений широко варьирует и в значительной мере определяется особенностями использованных препаратов. Амплитуда колебаний оперкулярных крышек, как правило, находится в обратной связи с частотой дыхательных движений: чем выше частота дыхательных движений, тем меньше амплитуда и наоборот. Через 2-4 мин после погружения препарата в раствор фенола появляются сильные и беспорядочные движения парных грудных плавников. Сокращение мускулатуры грудных плавников вызывает перемещение головы по дну аквариума. Одновременно появляются сокращения мышц головы и вращательные движения глазных яблок. Частота дыхания, вначале высокая, постепенно убывает (рис. 51), при этом амплитуда дыхательных движений также значительно уменьшается. Все отмеченные на препарате изолированной головы реакции мышечной системы грудных плавников, головы и глазных яблок продолжаются обычно не более 7-12 мин, постепенно угасая, и голова остается неподвижной на дне аквариума. Даже через 1 ч, когда движение оперкулярных крышек становится очень редким и еле заметным, препарат изолированной головы реагирует вздрагиванием на воздействие
114

электрическим током (при напряжении на электродах около 5V).
Рис. 51. Динамика изменения дыхания препарата изолированной головы карася под влиянием фенольного раздражения: 1, 2, 3 - отдельные препараты.
Следует прийти к выводу, что в основе отмеченных реакций препарата изолированной головы на воздействие фенолом лежат нервные импульсы, генерируемые в головном мозгу и посылаемые по четырем парам черепномозговых нервов: III - oculomotorius, IV - trochlearis, V - trigeminus и VII - facialis. Из них глазодвигательный и блоковой нерв, ядра которых расположены на основании среднего мозга, иннервируют сложную мышечную систему глазного яблока, а тройничный и лицевой с ядрами в продолговатом мозгу обеспечивают чувствительными и двигательными волокнами рыло и челюсти. То обстоятельство, что V и VII пары черепномозговых нервов являются смешанными (наряду с двигательными волокнами имеются и чувствительные), лишает нас возможности решить вопрос о том, является ли фенол гуморальным раздражителем, для нервных центров головного мозга, ибо не исключена возможность, что фенол может оказывать раздражающее действие на периферические чувствительные нервные окончания указанных нервов.
Эти опыты проливают свет на особенности поведения в токсическом растворе фенола спинальных рыб, полученных путем высокой перерезки связей между спинным и головным мозгом по сравнению со спинальными карасями, полученными путем полного удаления головного мозга. Отмеченные у первых карасей под влиянием фенола реакции со стороны мышечной системы передней части туловища обусловлены импульсами из головного мозга, посылаемыми по черепномозговым нервам, иннервирующим головную часть туловища карасей.
Еще одна серия опытов была поставлена, чтобы выявить влияние разобщения спинномозговых путей на время гибели в токсическом растворе фенола. Оперированные караси поступали в опыт через 24 ч после высокой перерезки спинного мозга (табл. 53).
Таблица 53
Время гибели подопытных и контрольных карасей в растворе фенола 100 мг/л
Время гибели подопытных карасей оказалось несколько короче, чем у контрольных, однако проверка достоверности выявленного различия по Вилкоксону не подтвердила его реальности.
115
Полученные материалы показывают, что разобщение нервной связи между центром и периферией не оказывает существенного влияния ни на исход фенольной интоксикации, ни на время гибели.
Суммируя приведенные данные, можно прийти к выводу, что удельный вес и значение головного и спинного мозга в развитии внешнего симптомокомплекса фенольной интоксикации далеко не равнозначно. Головной мозг имеет более важное значение и играет ведущую роль в определении наиболее характерных компонентов реакции рыб на токсическое действие ядов органического ряда - двигательной активности вначале и судорог в последующем. При полном удалении головного мозга ни одна из этих реакций не развивается. Локомоторный аппарат спинного мозга приводится в действие импульсами из головного мозга. Следовательно, спинной мозг является обычным звеном рефлекторной дуги и выступает как проводящий орган импульсов, вызванных фенольным раздражением из различных отделов головного мозга к периферическому нейромускулярному аппарату рыб.
Интересно обнаруженное различие в механизмах локомоторной реакции рыб, обусловленной химическим раздражителем-фенолом и физическим - электротоком. В то время как спинальные рыбы не реагировали на химическое раздражение, они реагировали на воздействие электрическим током вздрагиванием и перемещением. Следовательно, спинной мозг имеет более важное значение в реакции рыб на ток. Хотя головной мозг рыб играет ведущую роль в определении характера фенольной реакции рыб, однако значение его отделов (продолговатый, средний, промежуточный и передний) в этой реакции неравноценно.
У карасей, лишенных переднего мозга, скорость наступления и динамика развития комплекса реакций, обусловленных фенолом, почти не отличались от интактных рыб. Внешняя картина феноль-ного отравления с характерными для нее нарушениями статической и моторной функции, которые наступают после полного удаления или раздражения среднего мозга и мозжечка, сходна.
Интенсивное движение грудных плавников и вращение глаз, которые вызывал фенол на изолированной голове, по свидетельству Н. В. Пучкова (1954), можно получить при униполярном раздражении различных участков зрительных долей среднего мозга. Следует вспомнить также, что одной из самых ранних и типичных реакций рыб на фенольное раздражение является потеря рефлекса равновесия, а центры равновесия находятся в основании среднего мозга. Это наводит на мысль, что среднему мозгу принадлежит ведущая роль в развитии целой гаммы рефлекторных реакций рыб, возникающих под влиянием ядов органического ряда. Возникающее возбуждение распространяется по многочисленным путям, связывающим mesencephalon с остальными отделами мозга (из tectum выходят центробежные волокна tractus tecto-thalamicus, tractus tecto-bulbaris и tractus tectospinalis). Особую роль в реакциях рыб на фенольное раздражение играют два последних нервных тракта, соединяющих крышу среднего мозга с продолговатым и спинным. В сетевидной формации продолговатого мозга, как и в среднем, локализуется рефлекторный центр равновесия, представляющий собой ядра слухового нерва (VIII пара), к которому идут волокна от лабиринта и сложная локомоторная система. Двигательные расстройства
ипотеря рефлекса равновесия, по-видимому, и определяются токсическим воздействием органических ядов на средний и продолговатый мозг, которые вместе с мозжечком регулируют тонус мышц, локомоторные движения и равновесие тела.
Это подтверждается не только существующими анатомо-мор-фологическими связями между средним мозгом и другими отделами центральной нервной системы, но и экспериментальным анализом механизмов отдельных реакций, составляющих внешние симптомы фенольного отравления.
Важную роль в определении характера и исхода фенольной интоксикации играет и продолговатый мозг. Есть основание полагать, что основной причиной гибели рыб в токсических растворах многих ядов органической природы является необратимый паралич дыхательного центра, расположенного в продолговатом мозгу. Кроме того, от продолговатого мозга среди других шести пар черепномоз-говых нервов (V-X пары) отходят тройничный
илицевой нервы, по которым, как показали наши опыты на препарате изолированной головы, передается двигательное возбуждение на головную часть туловища.
Исходя из полученных данных, считаем особо перспективным использование различных показателей деятельности центральной нервной системы и, прежде всего, условных рефлексов, в качестве наиболее чувствительных тестов для определения хронического действия малых концентраций различных гомологов фенольного ряда или других соединений органической природы, оказывающих токсическое влияние на организм путем нарушения нормальной деятельности центральной нервной системы.
КРИТЕРИИ И МЕТОДЫ ОПРЕДЕЛЕНИЯ ТОКСИЧНОСТИ
Проблема ликвидации пагубного влияния ядов промышленных сточных вод на рыб не может быть решена до тех пор, пока промышленность не будет располагать данными по биологическому нормированию вредных веществ для рыбохозяйственных водоемов.
В настоящее время установлены предельно допустимые концентрации лишь для немногих веществ, поэтому необходимо значительно активизировать такие исследования и в кратчайший срок получить сведения по ПДК наиболее агрессивных компонентов промышленных сточных вод.
116
Необходима общая методическая основа для проведения ихтио-токсикологического эксперимента и оценки полученных данных. В связи с этим важное значение приобретает вопрос об унификации критериев токсичности.
О ФИЗИОЛОГИЧЕСКОЙ И БИОЛОГИЧЕСКОЙ НОРМЕ
Пока степень токсичности промышленных сточных вод оценивали на основе метода «рыбной пробы» и в качестве показателя токсичности использовали смерть испытуемых рыб, вопрос о критериях токсичности представлялся простым - погибла рыба или выжила. Для более точной оценки токсичности различных компонентов сточных вод и определения ПДК необходимо выявить пороговые концентрации, вызывающие определенный токсический эффект, отметить который можно только путем сопоставления с контрольными животными. Встает вопрос о норме организма или «нормальной величине» того или иного показателя. Н. С. Строганов (1941) предложил понятие «биологической нормы организма», критерием которой может служить сохранение вида. Этот критерий имеет вполне определенное значение для оценки правильности и эффективности биологического нормирования вредных веществ в естественном водоеме, но не имеет непосредственного значения в методическом отношении. Мы полагаем, что при проведении опытов по биологическому нормированию вредных веществ для рыбохозяй-ственных водоемов и определении порогового токсического эффекта сточных вод первостепенное значение имеет физиологическая норма организма. Об этом свидетельствует не только многолетний опыт санитарно-токсикологических исследований по гигиеническому нормированию вредных веществ в водоеме, но и первые опыты на рыбах, проведенные в нашей и ряде других лабораторий. Чтобы избежать затруднений, связанных с индивидуальной изменчивостью многих физиологических параметров и биохимических показателей, отражающих постоянство внутренней среды, по которым часто судят о токсическом эффекте различных веществ, необходимо иметь сведения о нормальной величине этих показателей. В международной медицинской практике принято считать нормальными такие величины физиолого-биохимических показателей, которые лежат в области М+26. Эти показатели отличаются от средней величины не более чем на удвоенную величину стандартного отклонения. Критерий ±26 нормальной величины физиолого-биохимических показателей базируется на правилах вариационной статистики и теории вероятности. Использование этого критерия позволяет точно и надежно оценивать результаты лабораторного исследования, делает возможным унифицировать понятие нормальной величины, исключив тем самым различные эмпирические формулировки, широко встречающиеся в литературе по токсикологии рыб. Установлено, что зона М±2б включает 96% всех нормальных величин. Следовательно, величина того или иного показателя, лежащая вне зоны М±28, по теории вероятности может быть нормальной в 4% случаев и патологической в 96%. Надежность критерия ±26, удовлетворяющая даже клиницистов, вполне достаточна для оценки порогового токсического эффекта и в опытах на рыбах.
Пороговые концентрации
Подобно тому как амплитуда смертельных концентраций ограничена снизу величиной CL0, а сверху CL100 или CL05 и CL95, так и область токсических концентраций имеет свои верхние и нижние лимиты. Концентрации, ограничивающие зону токсического действия снизу, именуют пороговыми концентрациями и определение их, по мнению Н. В. Лазарева (1940), Н. С. Правдина (1947), В. А. Рязанова (1959), С. Н. Черкинского (1959) и других, является важнейшей задачей токсикологии. Н. С. Правдин (1947) писал что «токсикологическое значение пороговых концентраций заключается в том, что они являются одним из отправных моментов для установления допустимых концентраций».
Но смысл и токсикологическое содержание «пороговой концентрации» весьма расплывчаты и условны даже в сравнении с понятием «смертельная концентрация». Если величина смертельной концентрации определяется, в конечном счете, свойствами яда и уровнем устойчивости испытуемого животного, то пороговая концентрация существенно зависит еще от метода ее установления. Поскольку разрешающие способности различных методик неодинаковы, постольку выводы авторов о пороговой токсичности испытуемого вещества также различны и трудно сопоставимы. Нередко разные авторы для оценки пороговой концентрации одного и того же вещества используют сдвиги в различных функциональных системах и органах, не сообразуясь при этом с механизмами реализации токсического действия данного вещества. Случается, что даже в одной и той же работе при оценке величины пороговой концентрации используют различные критерии. Так, например, X. Денцер (Denzer, 1959) в качестве пороговой концентрации различных веществ для рыб приводит то порог повреждения, то критический порог.
Трудности, возникающие перед исследователями при установлении величины пороговой концентрации, обусловлены и неопределенностью токсикологического содержания «порогового эффекта». Мы считаем, что в качестве пороговой концентрации должна быть принята такая концентрация, которая вызывает какие-либо
117

выраженные патологические сдвиги в любой отдельно взятой функциональной системе организма. При этом токсический эффект может учитываться как в альтернативной, так и градированной форме.
Влияние ядов на физиологические функции рыб
Априорно можно считать, что степень ранимости различных функциональных систем организма будет определяться как природой действующего токсического агента, так и концентрацией вещества. Поэтому, особенно если не известна токсикодинамика исследуемого вещества, для выявления порогового токсического эффекта или определения причины гибели рыб в естественном водоеме необходимо использовать возможно более широкий набор тестов, позволяющий составить представление о функциональном состоянии организма в целом. В качестве примера сошлемся на данные, полученные в нашей лаборатории (Лукьяненко и др., 1966) при патофизиологическом исследовании осетров и севрюг, отравленных сточными водами сложного состава. У больных и здоровых рыб определяли: количество гемоглобина в крови, число эритроцитов, осмотическую резистентность эритроцитов, содержание и уровень активности гуморального фактора естественного иммунитета - комплемента, коллоидную устойчивость сывороточных белков (коагуля-ционная лента Вельтмана), электрофоретический состав сывороточных белков, электрокардиограмму и пневмограмму. Основные результаты исследования представлены в табл. 54. У всех подопытных рыб было зарегистрировано резкое падение количества гемоглобина в крови. В среднем по группе количество гемоглобина снизилось до 2,8 г% при норме 7- 9 г%. У некоторых рыб количество гемоглобина падало до 1,1 -1,2 г%, т.е. было в 5-7 раз ниже нормы. Резко снижалось и число эритроцитов у подопытных рыб, которое варьировало от 0,65 млн. шт. до 1,2 млн. шт. при норме у здоровых севрюг 1,6-2,0 млн. шт.
Таблица 54.
Характеристика функционального состояния отравленных рыб выловленных на эксперементальной тоне ЦНИОРХ («Мужичья»)
Определение осмотической резистентности эритроцитов (ОРЭ) показало, что у больных рыб она равна 0,18-0,24% хлористого натрия, а у здоровых рыб 0,16-0,26%. Следовательно, уровень ОРЭ у больных и здоровых рыб примерно одинаков. Развитие анемии (снижение количества гемоглобина и числа эритроцитов), повидимому, не связано непосредственно с гемолизом и может быть обусловлено метгемоглобинообразованием.
Следующая группа показателей характеризует состояние белкового обмена у отравленных рыб, понимание которого позволяет осветить функциональное состояние печени, а также выраженность и направленность синтетических процессов в организме. Для этого была поставлена коагуляционная лента Вельтмана и предпринята электрофоретическая разгонка сывороточных белков. Только у севрюги № 5 (см. табл. 54) коагуляционная лента оказалась в пределах нормы: 6-7 единиц. Во всех остальных случаях лента Вельтмана была резко смещена влево и укорочена на 2-3 единицы, что свидетельствует о серьезном нарушении в соотношении альбумин-глобулинов, увеличении грубодисперсных фракций и понижении коллоидной устойчивости белков.
118

Электрофоретический анализ сывороточных белков позволил конкретизировать характер сдвигов белкового метаболизма, выявленных с помощью коагуляционной ленты Вельтмана. Оказалось, что у отравленных рыб резко снижено количество альбуминов и гамма-глобулинов. Общее количество глобулинов увеличено за счет грубодисперсных фракций альфа- и бета-глобулинов, количество которых увеличено в 2-3 раза, по сравнению с нормой. Эти исследования свидетельствуют о нарушении функционального состояния печени и нормального хода синтеза белка, что согласуется с данными К. В. Мартино, полученными в лаборатории болезней рыб КаспНИИРХ, согласно которым в печени имеются серьезные деструктивные изменения.
Активность комплемента-важнейшего фактора защитной функции крови у отравленных и здоровых рыб находится примерно на одном уровне: 0,02-0,08.
Электрофизиологический анализ функционального состояния сердечной и дыхательной функций выявил значительные изменения в их деятельности. Дыхание у отравленных рыб аритмичное и замедленное: 20-25 в минуту против 100-115 в контроле.
Имеется отчетливая брадикардия - частота сердцебиения у отравленных рыб в 2-3 раза ниже, чем в контроле. Отмечена резкая деформация электрокардиограммы (рис. 52): заметно сокращено время систолы желудочка, смещен влево и стерт зубец Т, исчез зубец Р и патологически очерчен зубец 5. Весь этот комплекс сдвигов свидетельствует о нарушении проводимости между желудочком и предсердием, наступившем, повидимому, вследствие асфиксии сердечной мышцы.
Рис. 52. Электрокардиограммы здоровой (а) и отравленной (б) севрюг.
Полученные нами данные, характеризующие функциональное состояние различных физиологических систем отравленных и контрольных рыб, свидетельствуют о том, что выраженность патологических сдвигов деятельности различных систем неодинакова. Сравнительное изучение различных функциональных систем организма позволяет выявить слабое звено в комплексе сдвигов и по этому слабому звену обосновано судить о пороговом токсическом эффекте и пороговой концентрации вредного вещества. В данном случае таким показателем была концентрация гемоглобина, поскольку речь шла о яде с преимущественным действием на кровь.
Имеются данные о влиянии ядов промышленных сточных вод на многие другие общие показатели функционального состояния организма. Среди них можно отметить изменение живой массы рыб (Брюхатова, 1937; Пажитков, 1937, Скадовский, 1937; Строганов, 1937, 1940; Веселов, 1957; Вернидуб, 1962) электробиологической реакции (Halsband, Meyer-Waarden, 1960), изменение предпочитаемой температуры (Вернидуб, 1962), изменение количества потребляемого кислорода (Fromm, Sehiffman, 1958; Вернидуб, 1962), изменение белкового состава сыворотки крови (Фудзия, Тикуни, 1954, 1958; Neuhold, Sigler, 1960).
Широко используются различные гематологические показатели: количество гемоглобина и число эритроцитов, рН и окислительно-восстановительный потенциал крови, величина поверхности эритроцитов и их объем (гематокрит), осмотическая резистентность эритроцитов (Строганов и Пажитков, 1943; Schiffmann, Fromm, 1959; Weiss, 1961; Вернидуб, 1962; Телитченко, Говорова, 1962; Горчакова и Телитченко, 1963;' Halsband, Halsband, 1963 и др.).
Особого внимания заслуживает опыт использования метода «кислотных эритрограмм» для раннего обнаружения отравления рыб ядами промышленных сточных вод (Телитченко и Говорова, 1962). С помощью этого метода удается выявить нарушения в эри-тропоэзе рыб на основе определения уровня осмотической резистентности эритроцитов, поскольку устойчивость эритроцитов тесно связана с их возрастом. Устойчивость эритроцитов под влиянием радиоактивных веществ в первые несколько дней снижается (разрушение старых эритроцитов), а в последующие дни увеличивается за счет появления в кровяном русле молодых эритроцитов (рис. 53). Использование метода эритрограмм весьма перспективно в работе с веществами выраженного гемолитического действия.
119
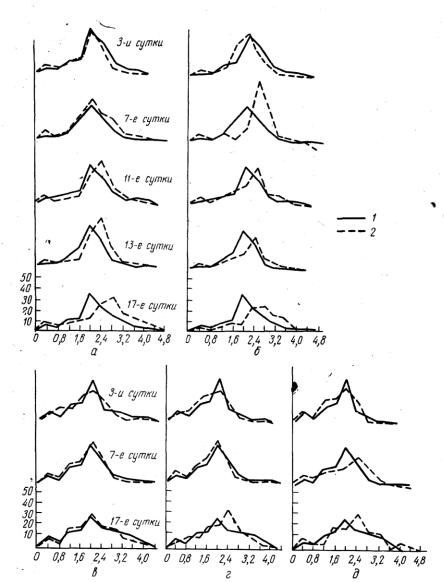
Рис. 53. Эритрограммы карпов, находившихся в растворах азотнокислого уранила
итория с разной концентрацией U23S и Th232:
а- 5 мг/л U238; 6 - 50 мг/л U238; в - 0,5 мг/л Th232; г - 10 мг/л Th232;
д - 25 лг/тг Th232; 1 - контррль; 2 - опыт.
На оси ординат отложены проценты гемолизировавшихся эритроцитов, на оси ординат - время, мин, (по Телитченко и Говоровой, 1962).
Предельно допустимые концентрации (ПДК)
Слабая разработка биологических нормативов вредных веществ для рыбохозяйственных водоемов в значительной мере объясняется отсутствием общепринятых критериев и методов определения величины ПДКОбычно каждый исследователь основывается на личных соображениях в выборе метода определения ПДК. В санитарной токсикологии рекомендация той или иной величины ПДК основывается не только на экспериментальных данных, но и сопоставляется с зоной токсического действия, т. е. с диапазоном концентраций от пороговых до смертельных. В 1947 г. П. С. Правдин сформулировал положение, согласно которому «узкая зона токсического действия требует, чтобы допустимая концентрация находилась возможно ниже порога токсического действия, чтобы она возможно дальше отстояла от пороговой концентрации. Наоборот, чем шире зона токсического действия, тем вещество менее опасно в смысле возможности острого отравления, тем ближе к пороговой концентрации может быть и допустимая концентрация».
Анализ литературных данных по токсичности различных ядов промышленных сточных вод для рыб
120
