
4 курс / Общая токсикология (доп.) / Obschaya_ikhtiotoxikologia_Lukyanenko
.pdfсформулирована К. Проссером [292]: акклимация — это «компенсаторное изменение, возникающее в организме в ответ на длительное отклонение какого-то одного фактора внешней среды (обычно в лабораторных условиях) от первоначального уровня» (с. 19). Мы уже отмечали, что термин «акклимация» характеризует приспособление организма к экологически неустранимым факторам (соленость, температура и т. д.), а потому неадекватен при описании приспособления к патологическим, в данном случае токсическим, факторам. И хотя в последней очень интересной работе В. В. Хлебовича [377] есть раздел, специально посвященный вопросам акклимации к токсикантам, автор использует этот термин чаще как синоним адаптации. Словом, акклимация — это не кратковременная компенсаторная реакция, а приспособительная реакция организма на какой-то один природный фактор, к которым токсиканты, в частности пестициды, никак нельзя отнести.
Следует особо подчеркнуть, что мнение Б. А. Флерова [365] об отсутствии у рыб способности приобретать индивидуальную устойчивость, т. е. адаптироваться к токсикантам, находится в разительном противоречий с абсолютным большинством экспериментальных данных, как новейших, так и полученные до его публикаций.
Напомним, что в зарубежной литературе первые фрагментарные сведения по адаптации рыб к различным ядам стали появляться в начале 50-х годов [517, 565, 735, 411, 659, 469]. Показано, что устойчивость рыб к некоторым дезинфикаторам увеличивается после предварительного выдерживания особей в растворах с песмертельными концентрациями. Если в начале опытов рыбы погибали при концентрации яда 5 мг/л, то впоследствии они выдерживали концентрации от 9 до 36 мг/л [517, 659]. Аналогичный эффект — повышение устойчивости рыб, о которой судили по времени их выживания после предварительного контакта с токсикантами, отмечен в опытах с цинком [565, 411] и медыо [735].
Серия работ по адаптации рыб к фенолу выполнена [469, 163, 867, 213]. Во всех этих работах выявлен адаптационный эффект, о чем свидетельствуют выживаемость рыб и некоторые показатели их физиологического состояния. Постепенное увеличение концентрации фенола от 6 до 13 мг/л на протяжении 7 сут повышала устойчивость адаптированных окуней к тестирующему раствору-фенола концентрацией 18 мг/л. Время проявления токсического эффекта у адаптированных окуней при этой концентрации фенола составляло в среднем 69 мин, что в 3,5 раза больше, чем у неадаптированных рыб (19,2 мин).
Обстоятельное изучение адаптации некоторых видов рыб (Phoxinus phoxinus, Rhodeus sericeus amarus) выполнено В. Мелэци [687]. В качестве токсикантов использованы фенол, ртуть, цианиды, аммоний, цинк, свинец и хром. Подопытных рыб выдерживали в сублетальных концентрациях яда от 2 до 4 сут, затем подвергали воздействию этих же веществ в остротоксичных концентрациях. Для оценки выраженности адаптационного эффекта рассчитывали коэффициент приспособления, представляющий собой отношение времени выживания 50 % адаптированных рыб к времени выживания контрольных. В опытах со всеми веществами обнаружено повышение устойчивости адаптированных рыб, хотя выраженность эффекта зависела от природы вещества, времени адаптации и индивидуальных особенностей рыб. В большинстве опытов коэффициент адаптации рыб составлял от 1,2 до 2,2 и в опытах с фенолом оказался весьма высоким — 2,1. По вполне понятным причинам коэффициент приспособления оказался ниже у тех рыб, которые дольше выдерживались в растворах яда сублетальных концентраций (развитие трудно компенсируемых нарушений гомеостаза).
Результаты опытов В. Мелэци подверглись острой критике Б. А. Флеровым [365] па том основании, что автор выдерживал подопытных рыб в субтоксических растворах только 2-4 сут вместо 14 сут, необходимых для акклимации рыб к природным факторам [378]. Однако следует напомнить, что 14-суточная акклимации рыб имеет место в опытах с экологически «неустранимыми» факторами, но никак не в опытах с токсикантами. Здесь выступают другие закономерности; и глубина адаптации определяется не только временем выдерживания рыб в токсических, растворах, но и сонцентрацией последних, а также природой яда и видом рыб [163]. Оценивая данные В. Мелэци [687], Б. А. Флеров [365] пишет: «из-за слишком короткой экспозиции в сублетальных концентрациях и высокой тестирующей концентрации автор, по нашему мнению, имел дело с кратковременной компенсаторной реакцией, а не с явлением фенотипической адаптации». Любопытно, что в собственнных опытах, поставленных с целью выявления способности гуппи адаптироваться к полихлорпинену, Б. А. Флеров [364] использовал точно такую же кратковременную экспозицию (2 и 5 сут) и остротоксичную тестирующую концентрацию пестицида (0,5 мг/л), однако считал, что он изучает адаптацию рыб, а не акклимацию.
Избранная В. Мелэци схема постановки опыта вполне правомерна, ибо чем выше сублетальная концентрация токсиканта, в которой выдерживают подопытных рыб, тем короче должно быть время экспозиции, чтобы были запущены компенсаторные реакции, но не успели развиться необратимые патологические нарушения. Конечно, лучше экспериментальным путем найти оптимальное соотношение между «адаптогенной» концентрацией вещества и временем экспозиции адаптируемых рыб в токсическом растворе, как это было в наших опытах с фенолом [163]. Но факт остается фактом: рыбы способны приобретать повышенную устойчивость даже при кратковременной адаптации к токсикантам. Об этом свидетельствует совпадение выводов В. Мелэци [687] с выводами других авторов, изучавших адаптацию рыб к солям тяжелых металлов [565, 411, 735, 663], фенолу [163, 213] и аммонию [774, 349], причем в последних двух работах, как и в нашей [163], адаптация рыб к токсикантам осуществлялась значительно более 2 нед.
В первой из этих двух работ (774] форель адаптировалась в течение трех недель в субтоксической концентрации, а затем подвергалась воздействию остротоксичной концентрации NH3. Процент выживаемости адаптированных рыб (100%) оказался в два раза выше чем контрольных (50 %).
Эти данные были подтверждены и значительно расширены Р. Турстоном [349], обнаружившим весьма интересный факт: предварительно адаптированная радужная форель приобретала повышенную индивидуальную
устойчивость к остротоксичным концентрациям аммония, однако перевод адаптированной рыбы в чистую воду приводил через 2 сут к утрате приобретенной ею устойчивости. Наконец, в работе, выполненной Г. В. Поповой [281], представлены новые доказательства наличия у рыб индивидуальной адаптации к токсическим веществам. Двухмесячное выдерживание карпов в растворе прометрина (0,1 мг/л) резко повышало устойчивость адаптированных рыб в сравнении с устойчивостью контрольных. Это проявилось как в увеличении процента выживания адаптированных рыб в растворе прометрина концентрацией 15 мг/л в течение 24 ч (100%-ное выживание адаптированных и 100%-ная гибель контрольных), так и в значительном увеличении времени выживания адаптированных рыб в остротоксичной концентрации яда. Интересно другое — чувствительность к ядам адаптированных рыб, показателем которой служили поведенческие реакции и некоторые гематологические параметры, оказалась выше чувствительности интактных рыб. Неспнецифическое повышение устойчивости карпов к остротоксичной концентрации прометрииа (20 мг/л) можно вызвать длительным (2-месячным) лишением рыб пищи. В опытах с другим пестицидом — абатом — автор выявила лишь кратковременное повышение устойчивости рыб к токсиканту, после которого наблюдались срыв защитных компенсаторных механизмов и более интенсивное развитие интоксикации. На основе полученных данных автор приходит к вполне обоснованному выводу о том, что «привыкание, характеризующееся временным повышением устойчивости организма к токсиканту, сменяется фазой истощения, наступающей вследствие нарушения компенсаторноприспособительных механизмов, обусловленного длительным влиянием раздражителя» [163].
Совокупность накопленных к настоящему времени экспериментальных данных однозначно свидетельствует о наличии у рыб фенотинической компенсаторной адаптации к токсическим веществам. Она представляет собой результирующую максимального напряжения компенсаторных механизмов и потому, естественно, носит временный характер, обеспечивающий выживание особи в кратковременных экстремальных условиях. Если воздействие яда на организм длительное, т. с. носит хронический характер, то вслед за компенсаторной адаптацией неизбежно наступают истощение организма, срыв компенсаторных механизмов и развитие выраженной интоксикации. Однако даже кратковременная адаптация рыб к ядам имеет приспособительное значение и играет существенную роль в природе. Отрицание этого факта основано на методически несовершенных опытах, некорректной интерпретации их результатов и субъективном толковании понятия «адаптация».
Сегодня необходимо перейти к следующему этапу экспериментальной разработки проблемы индивидуальной адаптации рыб к токсическим веществам — выявлению конкретных механизмов этого феномена. Работы в этом плане на рыбах практически отсутствуют. Между тем общая и санитарная токсикология далеко продвинулась на пути расшифровки механизмов фенотипической адаптации (привыкания) теплокровных животных к токсическим веществам. Выявлены общие и частные механизмы адаптации животных на разных уровнях организации, зависимость этого сложного процесса от природы яда, его концентрации и путей поступления в организм, а также от видовых, возрастных и индивидуальных особенностей организма [199, 63]. Контакт организма с токсикантом приводит к включению различных механизмов, препятствующих поступлению яда в кровяное русло и внутренние органы, снижающих концентрацию токсиканта в организме за счет его связывания с полисахаридами и белками в крови, депонирования в нейтральных тканях, усиления детоксицирующих процессов и ускорения элиминации из организма. Наряду с этим снижается проницаемость клеточных мембран контактирующих поверхностей и гистогемэтических барьеров внутри организма, увеличивается сорбцнонная и детоксикационная способность барьерных систем и, наконец, снижается чувствительность, а точнее, повышается устойчивость клеток, тканей и органов-мишеней. Таким образом, компенсаторная адаптация организма — это сложное взаимодействие десятков физиолого-биохимических процессов, обеспечивающих его выживание в условиях краткосрочного или более длительного воздействия на организм стрессорных раздражителей химической природы, к которым относятся и различные токсиканты.
Важная роль в развитии компенсаторной адаптации принадлежит ферментным системам организма. Например, в основе адаптационных механизмов, развивающихся у теплокровных животных при действии фосфорорганических соединений, лежит усиление синтеза ацетнлхолинэстеразы, облегчение и ускорение процесса реактивации фермента и устойчивое функционирование комплекса ацетил-холин-ацетилхолингстсразы на новом уровне [139].
Учитывая однотипность реакций рыб и теплокровных животных на токсические вещества, сходство механизмов развития токсического процесса, вызванного той или иной группой веществ, есть основания полагать, что и механизмы фенотипической физиологической адаптации у рыб и других классов позвоночных животных будут сходными. Завершая критический анализ экспериментальных данных по адаптации рыб к ядам, рассмотрим еще один аспект этой проблемы.
В 60-х годах стали появляться сообщения о повышенной устойчивости к ДДТ гамбузий, обитающих в водоемах, обрабатывавшихся этим пестицидом [464, 505]. Дальнейшее изучение этого вопроса показало [603, 848, 849, 546, 547, 474], что повышение токсико-резистентности гамбузий в естественных условиях действительно может иметь место. Так, СL50 устойчивых гамбузий, отловленных в дренажных каналах оросительной системы дельты р. Миссисипи, в десятки и сотни раз выше, чем СL50 нормальных рыб [603, 849]. Правда, адаптация рыб к токсикантам носит нсспецифический характер. Гамбузии приобретают повышенную устойчивость не только к хлорорганическим пестицидам, применявшимся вблизи данного дренажного водоема, но и к другим, в частности, к стробану [546, 547].
Предприняты попытки раскрыть природу повышенной устойчивости популяций некоторых видов рыб,
обитающих в загрязненных водоемах, к токсическим веществам. Теоретически мыслимы три варианта формирования в водоеме устойчивой к ядам популяции. Первый из них — генотиннческая адаптация популяции, в основе которой лежат элиминация слабоустойчнвых особей, выживание особей с повышенной устойчивостью, размножение этих особей, увеличение их численности, обусловливающие формирование в водоеме резистентной к данному токсикату популяции того или иного вида рыб. Второй вариант — постепенное (из поколения в поколение) повышение устойчивости каждой особи конкретной популяции или большинства ее особей к той или иной группе веществ, т. е. фенотипнческая или физиологическая адаптация. Наконец, в основе третьего варианта формирования устойчивой популяции рыб в загрязненном водоеме могут лежать механизмы генотипической и фенотипической адаптации, удельный вес которых определяется видовыми особенностями рыб, условиями их обитания, природой токсического фактора и его концентрацией. Следует особо подчеркнуть трудность экспериментального анализа природы адаптации популяций рыб, обитающих в естественных водоемах. Тем не менее такие попытки предпринимаются. Одна из них выполнена Б. А. Флеровым [364] на модели фенольной интоксикации гуппи. В опытах использовано 100 рыб (50 самок и 50 самнов), которые были помещены в раствор фенола концентрацией 37,5 мг/л при температуре 20-21°С. 95% подопытных рыб погибли в течение 24 ч (1±0,1 сут), а оставшиеся в живых 5 рыб (3 самца и 2 самки) помещены в чистую воду. Через 15 сут после отравления рыб самок подсаживали к самцам для получения потомства, которое подращивали до наступления половой зрелости (4-5-месячиый возраст), и затем вновь помещал в раствор фенола (37,5 мг/л). Гуппи первого поколения выживали в течение 4,9±0,6 сут, гуинн второго поколения — 4,7±0,1 сут, и гуппи третьего поколения — 6,5±0,2 сут. На основе этих данных автор приходит к выводу, что «устойчивость уже первого поколения рыб значительно (судя по среднему времени выживания, в пять раз) превышала таковую исходного. Резистентность гуппи второго поколения практически не отличалась от первого. У рыб третьего поколения устойчивость к фенолу достоверно повышалась даже по сравнению со вторым поколением, а по отношению к исходному она была выше в 6,5 раза» (с. 65). И далее «установленный факт приобретения рыбами повышенной резистентности в последующих поколениях (большее время выживания в остротоксическнх растворах) со всей очевидностью свидетельствует о том, что приспособление гидробнонтов к токсическому фактору (в нашем случае повышение устойчивости рыб к фенилу) происходит в результате отбора — сохранения наиболее устойчивых организмов и элиминации слабых» (с. 66). Однако с подобным утверждением едва ли можно согласиться и вот по какой причине.
Среднее время выживания исходного (контрольного) поколения гуппи в растворе фенола концентрацией 37,5 мг/л, равное 1±0,1 сут, оказалось патологически низким, резко отличным от времени выживания других контрольных групп гуппи, использованных Б. А. Флеровым [364], при идентичной концентрации фенола и одинаковых условиях проведения опытов. Приведем несколько примеров. В табл. 1 этой работы указано, что среднее время выживания 141 экз. контрольных гуппи в растворе фенола концентраций 37,5 мг/л и температурой 18-20° С составило 4,9±0,31 сут. В табл. 2 приведено среднее время выживания 62 экз. контрольных рыб этого же вида в растворе фенола концентрацией. 37,5 мг/л. равное 5,8±0,31 сут, а в табл. 3 — среднее время выживания 30 экз. контрольных гуппи — 4±0,65 сут и 27 экз. контрольных рыб — 4,2±0,42 сут.
Таким образом, среднее время выживания контрольных рыб, т. е. гуппи, не подвергавшихся предварительной обработке фенолом в той или иной концентрации. (10 повторностей на 260 экз. гуппи), варьировало, по данным Б. А. Флерова [362], от 4,0 до 5,8 сут (в среднем 4,7 сут), и вдруг в работе, опубликованной годом позже, исходное поколение, т. е. 95 экз. из 100 экз. подопытных гуппи, не обрабатывавшихся раньше фенолом, гибнет в рекордно короткие сроки — почти в пять раз быстрее (всего за 1 сут), чем рыбы предыдущих контрольных серий. К сожалению, автор не обращает внимания на этот факт и не раскрывает причин столь разительных расхождений в результатах опытов, представленных в публикациях с интервалам всего лишь в один год [362, 364]. Однако если учесть эти расхождения, то становится очевидным, что так называемая повышенная устойчивость рыб второго и третьего поколений, время выживания которых равно соответственно 4,9±0.6 и 4,7±0,1 сут, находится в диапазоне времени выживания нормальных гуппи контрольных групп в растворе фенола концентрацией 37,5 мг/л, а «рекордсмены» повышенной устойчивости — гуппи третьего поколения, среднее время выживания которых составило 6,5±0,5 сут, мало чем отличаются по времени выживания от гуппи другой контрольной группы (5,8±0,31 сут).
Итак, критический анализ данных, представленных Б. А. Флеровым, не позволяет согласиться со сделанным им выводом о том, что «приспособление рыб к токсическому фактору происходит в результате отбора: сохранения наиболее устойчивых организмов и элиминации слабых». Возможно, такой путь генотипической адаптации имеет место в природных популяциях некоторых видов рыб, но в эксперименталытх условиях выявить его Б. А. Флерову не удалось. И не только потому, что токсикорсзистентность потомства гуппи сравнивалась с необычайно низкой токсикорезистентностью исходного контрольного поколения. Устойчивость природных популяций, длительное время обитающих в загрязненных водоемах [663, 549, 603, 849], как правило, значительно выше устойчивости популяций этих видов рыб из чистых водоемов. Так, по данным А. Холдена [603], концентрация пестицида, вызывающая гибель особей резистентной популяции, в 42—570 раз выше концентрации, при которой гибнут особи нормальной популяции, а, по данным других авторов [849], устойчивость резистентных гамбузий к хлорорганическим пестицидам на 3 порядка выше устойчивости нормальных гамбузий. Эти данные наводят на мысль, что генотипическая адаптация рыб обеспечивает значительно более высокую и прочную устойчивость к токсикантам в сравнении с фенотипической (физиологической) компенсаторной адаптацией. Именно по этому существеннему признаку выявленные Б. А. Флеровым [364] различия в токсикорезистентности исходных и дочерних поколений гуппи никак нельзя
рассматривать как экспериментальное доказательство ведущей роли отбора (генотипическая адаптация) в приобретении рыбами устойчивости к токсикантам. Напомним, что как исходное, так и последующие поколения гуппи погибали при одной и той же концентрации фенола (37,5 мг/л) с разницей лишь в несколько суток, причем время гибели отобранных в результате селекции резистентных гуппи (5—6 сут) практически равно времени гибели многих других выборочных совокупностей этих рыб, не подвергавшихся ранее воздействию фенола.
Критически оценивая результаты этих опытов, мы вовсе не отрицаем роли отбора в проявлении генотипической адаптации рыб к ядам и принципиальной возможности ее воспроизведения в экспериментальных условиях. В литературе имеется пример такого рода [603], когда путем селекции вроде бы удалось вывести гамбузий, устойчивых к ДДТ. Интересен механизм этой устойчивости, связанный, по-видимому, с повышением тканевой устойчивости рыб к токсиканту и накоплением высоких концентраций пестицида в нейтральных тканях, в частности в жировой ткани. Хищные рыбы, питающиеся такими гамбузиями, погибают, а выделяющийся резистентными гамбузиями пестицид оказывает токсическое воздействие на нормальных рыб. О важной роли жира в качестве «депо» хлорорганических пестицидов свидетельствует его повышенное содержание в теле и печени резистентных гамбузий в сравнении с нерезистентными [546, 547]. Проницаемость клеточных мембрац для ДДТ у резистентных гамбузий ниже, чем у обычных, мембраны их клеток связывают меченые 14 С пестициды (ДДТ, эндрин) сильнее, вследствие чего у резистентных гамбузий в нервной ткани накапливается меньше токсикантов, чем у обычных рыб.
Все эти материалы свидетельствуют о том, что адаптация популяций рыб может происходить не только на основе изменений генофонда (генотшшческая), но и за счет конкретных физиолого-биохимических механизмов (фенотиническая) исходного генофонда популяции. Механизмы генотипическон и фенотшшческой адаптации могут проявляться как совместно, так и раздельно, т. е. приспособление популяции может иметь и генотипическую, и фенотипическую природу. Вопрос состоит в том, как долго организм и популяция могут находиться в состоянии адаптации к чрезвычайным по силе токсическим раздражителям? Имеющиеся экспериментальные данные однозначно свидетельствуют о том, что у рыб можно вызвать индивидуальное приспособление, т. с. фенотипическую адаптацию, однако она носит фазовый характер, вследствие чего период относительно высокой устойчивости к токсикантам сменяется ее резким снижением и гибелью рыб [163, 281]. В связи с этим существующее мнение о большой адаптационной пластичности гидробнонтов и, в частности, рыб, их способности выносить большие токсические нагрузки за счет адаптации к различным токсикантам не учитывает всей сложности этой проблемы, противоречит экспериментальным данным н потому является несостоятельным.
КУМУЛЯЦИОННЫЙ ЭФФЕКТ
Обычно под кумуляцией понимают накопление в организме токсического вещества или вызнанных им эффектов. В связи с этим различают кумуляцию материальную, т. е. накопление вещества, и функциональную, представляющую собой суммацию токсических эффектов. При хроническом влиянии ядов на рыб, особенно, если речь идет о ядах внутреннего действия, в организм рыбы попадает х токсического агента, а выводится или разрушается за равный промежуток времени у этого агента. Если у < х, то в организме но истечении каждых суток, например, останется х - y = z токсического агента,. т. е. такое количество яда, которое само по себе не может вызвать каких-либо признаков интоксикации. По мере накопления в организме яда, предположим, за 20 сут его количество составит 20 z, т. е. концентрацию, способную вызывать токсический эффект.
Скорость и выраженность кумуляции зависят от многих переменных и в первую очередь физикохимических свойств вещества, концентрации яда, времени его действия, скорости выделения из организма или разрушения в организме, физиологического состояния организма и др. Можно думать, что кумулироваться способен любой токсический агент, скорость выделения которого ниже скорости его поступления в организм.
Существуют два основных метода определения скорости элиминации яда из организма. Один из них заключается в определении количества вещества, выделяющегося каким-либо одним путем (например, почками или кишечником), другой — в определении концентрации яда в крови. Если исчезновение вещества из крови идет по экспоненциальной кривой, то концентрацию у вещества в крови через t мин после разового введения (при условии, что вещество не депонируется в организме) можно рассчитать по формуле у = y0e –Kt, где у0 — начальная концентрация вещества в крови; е — основание натуральных логарифмов; К — константа скорости выделения вещества (определяется опытным путем). Однако чаще интерес представляют не только количество выведенного из организма яда, но и скорость его выделения или время исчезновения из крови половины поступившего в нее яда T50%, рассчитываемое по формуле T50=[(t1 – t2)log] / [log y1 – log y2], где y1 и у2 — содержание вещества в крови
вмоменты времени t1 и t2 после его попадания в организм.
Взависимости от физико-химических свойств исследуемого вещества может иметь место либо материальная, либо функциональная кумуляция, а в отдельных случаях и та, и другая.
Примером функциональной кумуляции может быгь свинцовое отравление, а ряд других солей тяжелых металлов оказывают токсическое действие на организм в малых концентрациях посредством материальной кумуляции. Функциональная кумуляция встречается чаще, чем материальная. Особая опасность функциональной кумуляции состоит в том, что она может иметь место даже при действии препаратов, быстро разрушающихся и выделяющихся из организма. В этом случае после каждого попадания яда в организм сохраняется следовая реакция, которая, суммируясь с последующей, приводит к проявлению токсического эффекта. Большинство
клеточных и эпзиматических ядов действует посредством функциональной кумуляции. В связи с этим можно полагать, что фосфорорганические пестициды, представляющие собой энзиматические яды, характеризующиеся высокой токсичностью для рыб, прч хроническом воздействии малыми концентрациями могут привести к развитию функциональной кумуляции. Экспериментального изучения кумуляционного эффекта в опытах на рыбах до настоящего времени не проводилось в связи с чем мы поставили ориентировочные опыты на модели фенольной интоксикации личинок леща.
Опыты велись по двум схемам. Согласно одной из них личинки (этап С2) подвергались ежедневному воздействию раствора фенола концентрацией 15 мг/л на протяжении 6 ч, после чего их помещали в чистую воду. Через 10 сут подопытные рыбы были разбиты на две подгруппы и помещены в остротоксичные растворы фенола (50 и 100 мг/л). Опыты показали, что время гибели личинок, предварительно подвергшихся воздействию раствора фенола концентрацией 50 мг/л, составляло 16 ч, а контрольных — 34 ч, при концентрации яда 100 мг/л — 2 ч 15 мин, а контрольных — 7 ч. Следовательно, устойчивость к яду подопытных личинок леща оказалась в 2-3 раза ниже устойчивости контрольных, т. е. имел место кумуляционный эффект, природу которого определить пока затруднительно.
По второй схеме опытов личинок леща (этап С2) предварительно выдерживали в растворе фенола концентрацией 10 мг/л на протяжении 10 сут, после чего их погружали в растворы яда более высокой концентрации (50 и 100 мг/л). Как и в первом случае, имело место значительное укорочение времени гибели обработанных рыб в сравнении со временем гибели контрольных. Так, время гибели подопытных рыб в растворе фенола концентрацией 50 мг/л равно 9 ч, а контрольных — 28 ч, при концентрации раствора фенола 100 мг/л — 1 ч 35 мин, а контрольных — 6 ч 20 мин.
Полученные данные вносят необходимые коррективы в понимание роли концентрации токсического вещества в формировании у рыб адаптационного эффекта к ядам. В частности, временная адаптация рыб к фенолу возможна только при действии относительно низких концентраций яда (1-5 мг/л), ибо дальнейшее повышение его концентрации до 10-15 мг/л приводит уже к проявлению кумуляционного эффекта.
Результаты представленных выше опытов позволяют считать, что кумуляционный эффект может иметь существенное значение в определении устойчивости рыб к ядам промышленных сточных вод. В связи с этим при установлении биологических нормативов сброса промышленных сточных вод в рыбохозяйственные водоемы необходимо иметь в виду также возможность кумуляции той или иной группы веществ или обусловленных имиг токсических эффектов и делать соответствующие поправки при определении ПДК различных компонентовпромышленных сточных вод.
ГЛАВА I V
ЗАВИСИМОСТЬ ТОКСИЧЕСКОГО ЭФФЕКТА ОТ КОНЦЕНТРАЦИИ ЯДА И ВРЕМЕНИ ЕГО ДЕЙСТВИЯ НА РЫБ
КОНЦЕНТРАЦИЯ ЯДА
Исход опытов по испытанию токсичности того или иного вещества для рыб определяется двумя важнейшими переменными: концентрацией яда и временем его действия на организм. Концентрация токсиканта при: постоянном времени действия на организм играет решающую роль в определении выраженности и исхода токсического процесса, а стало быть, и в оценке самого факта вредности исследуемого соединения для рыб.
Вопрос о концентрациях химического вещества, при которых оно становится токсичным или летальным, был и остается одним из самых трудных и противоречивых. Об этом свидетельствует огромный диапазон концентраций, указываемых различнымд авторами, в качестве токсических или летальных буквально по каждому классу изученных химических соединений, будь то соли тяжелых металлов, щелочи, кислоты, пестициды или другие яды органического ряда. В качестве примера сошлемся на литературные данные, характеризующие токсичность фенола для рыб. По данным одних авторов, повреждающие или летальные концентрации фенола изменяются от менее чем 1 до 5 мг/л [441, 797, 798,.. 542, 490, 809], по данным других [599, 76, 310, 261, 537, 540], порог токсичности или летального действия: фенола для различных видов рыб лежит в пределах. 10—20 мг/л. В то же время, по мнению ряда исследователей [809, 714, 310, 769, 537, 40], в этих же пределах: лежит область относительно безвредных концентраций яда (0,1-18 мг/л).
Таким образом, токсические и летальные концентрации фенола, полученные авторами в различных методических условиях, различаются подчас в 10-20 раз!
Аналогичная картина вырисовывается при анализе литературных данных, характеризующих минимальные летальные или токсические концентрации других химических веществ с той лишь разницей, что нередко расхождения между данными различных авторов еще более внушительны. Так, концентрация цианидов 10 мг/л, приведенная А. Кейсом [637] в качестве «возможно токсичной для рыб», примерно в 100 раз превышает концентрации, вызывающие летальное отравление многих видов рыб. Чрезвычайная противоречивость в рекомендациях отдельных авторов относительно минимальных летальных концентраций различных компонентов промышленных сточных вод для рыб в значительной мере объясняется отсутствием единых критериев оценки токсичности испытуемых веществ, недостаточным вниманием к количественной характеристике реакций рыб па ядовитые вещества. Между тем вопросы количественной оценки токсичности химических веществ привлекают

все большее внимание специалистов в связи с необходимостью эффективного разрешения основной задачи токсикологии — установления ПДК вредных веществ во внешней среде. Аналогичная задача — определение и обоснование ПДК различных ядовитых компонентов сточных вод — стоит и перед ихтиотоксикологией.
В связи с единством основных задач, стоящих перед общей токсикологией и ихтиотоксикологией, их методологическим родством мы считаем необходимым в конспективной форме изложить основные идеи, принципы и методы количественной оценки токсического эффекта, используемые в общей токсикологии.
Известно, что реакции животного на токсическое раздражение возникают при определенной концентрации или дозе токсического агента, а интенсивность их нарастает параллельно увеличению концентрации токсиканта. Иными словами, реакции организма, обусловленные воздействием токсических агентов, носят градированный характер, что позволяет весьма полно характеризовать токсикодинамику испытуемого вещества, но чрезвычайно затрудняет количественную оценку его токсической активности. Для преодоления этого препятствия было предложено использовать не всю гамму возникающих в организме сдвигов, а лишь конечный эффект, т. е. гибель или выживание животного. Такой способ оценки токсического эффекта в альтернативной форме по принципу «все или ничего» (квантовые реакции) получил в настоящее время широкое распространение и позволил наиболее точно на основе математических методов проводить количественную оценку токсических свойств изучаемого соединения и сопоставлять получаемые результаты.
Исходя из этого, в настоящее время принято различать летальные дозы и концентрации (соответственно DL и CL) и токсические дозы и концентрации, т. е. не вызывающие летального исхода, но оказывающие вполне определенный эффект (DE и СЕ — эффективные). Чаще для характеристики токсичности испытуемого вещества исследователи стремятся располагать данными о всей амплитуде токсических и летальных концентраций, начиная от максимально переносимых CL0 (концентрация максимально переносимая) и минимальной летальной CLM (концентрация летально-минимальная) до CL100 (концентрация летальная для 100% испытуемых животных).
Летальные концентрации. В ихтиотоксикологии абсолютное большинство авторов, характеризуя степень токсичности того или иного вещества, обычно используют в качестве критерия CL100, т. е. наименьшую концентрацию, вызывающую гибель всех взятых в опыт рыб. Однако из работ Ш. Д. Мошковского [241], Н. С. Правдина [289] и некоторых других известно, что критерий CL100, как и DL100, несет ограниченную информацию о степени токсичности того или иного яда и в значительной мере определяется количеством использованных в опыте животных. Если обозначить вероятность гибели каждой рыбы, подвергшейся воздействию яда данной концентрации, через Р, то вероятность гибели всех рыб п в растворе яда этой концентрации будет равна Рп. В то же время вероятность того, что какая-то одна (или несколько) из взятых в опыт рыб выживает, окажется равной 1-Рп. Величина 1-Рп с повышением количества рыб п возрастает и (1-Рn)→1. Следовательно, чем больше по объему испытуемая группа рыб, тем больше вероятность, что какая-то рыба при данной концентрации выживет, а стало быть, CL]00 с возрастанием количества используемых в опыте рыб будет увеличиваться. Вполне понятно, что все сказанное относится и к CL0, только в этом случае с увеличением количества подопытных рыб п будет уменьшаться минимальная летальная концентрация. Если учесть к тому же, что в большинстве ихтиотоксикологических экспериментов количество подопытных рыб бывает весьма ограничено, а нередко и совсем не указывается, то станет понятной неопределенность и малая ценность приводимых данных.
Более важным показателем зоны летальных концентраций исследуемого вещества является CL50 (средняя летальная концентрация, вызывающая гибель 50% животных). В ихтиотоксикологии этот критерий был впервые введен П. Дудоровым [532], предложившим биологический метод оценки токсичности веществ, основывающийся на определении среднего предела устойчивости (TLM — толерантный лимит). Он представляет собой концентрацию яда, которая убивает 50% испытуемых рыб за 24, 48 и 96 ч в экспериментальных условиях. В настоящее время в США этот метод оценки токсичности вещества принят большинством исследователей.
Имеется несколько хорошо разработанных методов расчета и определения CL50. Среди методов математического расчета CL50 наибольшее распространение получили два: метод Кербера [635] и метод Першина [269]. Первый из них предполагает одинаковое количество подопытных животных (не меньше 6) на каждую из 4- 5 испытуемых концентраций в диапазоне от CL0 до CL100 (желательны одинаковые интервалы между концентрациями):
где М — число погибших животных от исчисляемой концентрации; H — число погибших животных от предыдущих концентраций; а — исчисляемая концентрация; b — предыдущая концентрация.
По методу Першина расчет CL50 возможен и в том случае, если интервалы между концентрациями неодинаковы и количество подопытных животных на каждую концентрацию также различно:

При расчете CL50 по методу Першина М и Н представляют собой не числа погибших животных, а проценты летальности.
Другая группа методов основана на определении CL50 по кривой летальности, или характеристической кривой, отражающей распределение индивидуальной устойчивости животных к исследуемому токсическому агенту. Большинство авторов считают при этом, что распределение частот индивидуальных эффектов в вариационном ряду приближается к нормальному распределению (кривая Гаусса-Лапласа). Характеристическая кривая строится путем нанесения доз или концентраций на оси абсцисс, а процента летальности (или частоты любого другого учитываемого токсического эффекта) — на оси ординат.
Подчас зависимость между концентрацией и эффектом (в данном случае процентом гибели животных) при графическом изображении приобретает форму симметричной S-образной кривой (рис. 6). Происхождение сигмоидной формы характеристической кривой, по мнению В. М. Карасика [108], легче всего объяснить исходя из ее родства с кривой нормального распределения, так как обе кривые отражают распределение частоты признака в изучаемой выборочной совокупности. Обычно количество высокоустойчивых и малоустойчивых животных незначительно и нарастает по мере приближения к моде вариационного ряда. Основываясь на этом принципе, В. М. Карасик считает, «что сигмоидная форма характеристической кривой отвечает резкому переходу от менее частых вариантов к более частым, и наоборот. Чаще, однако, сигмообразные кривые оказываются не симметричными и даже вовсе не S-образными, приближаясь по форме к показательным кривым, или приобретают очень растянутый S-образный вид». Правда, прилогарифмировании концентраций кривые становятся более симметричными, однако А. Кларк [486, 487], анализируя характер связи между концентрацией вещества и его активностью, приходит к выводу, что форма кривых при квантовых реакциях может быть различной для разных веществ. Тем не менее характеристическая кривая приобрела исключительное значение для количественной оценки токсичности испытуемого вещества.
Рис. 6. Соотношения между кривой нормального распределения (а) и соответсвующей ей характеристической кривой (б)
Поскольку при построении характеристической кривой, получаемые эмпирические точки нередко широко разбросаны, что не позволяет провести между ними закономерную кривую, было предложено несколько статистических методов для выравнивания опытных данных. Чаще других используется метод скользящей средней, метод наименьших квадратов Боярского [25] и метод пробитов. Наиболее простым из них, но дающим удовлетворительное согласование, оказался метод скользящей средней, согласно которому ожидаемые величины летальности получают путем вычисления средней арифметической между определяемым, предыдущим и последующим наблюдаемыми значениями. При использовании этого метода можно получить плавную кривую с характерным сигмоидным изгибом. Основными недостатками метода являются значительная погрешность определения величины при малом числе опытов и необходимость соблюдения равных интервалов между концентрациями.
Метод пробитов основан на преобразовании характеристической кривой в прямую путем нанесения на ординату процентов летальности с учетом вероятности их ошибки. Получается вероятностная шкала, характерная особенность которой — сближение делений в области 50% и растянутость в районе 0 и 100%. Проценты летальности, найденные опытным путем, переводятся в пробиты по таблице Блисса [455]. Метод характеризуется относительной точностью, простотой выполнения.
Сейчас уже ни у кого не вызывает сомнений, что в качестве параметра токсичности целесообразно использовать не CL100, а СL50. Однако сама по себе эта характеристика будет неполной, если не указать стандартного отклонения (среднеквадратическая ошибка), характеризующего степень рассеяния или изменчивости CL50. Тем не менее в тех немногих работах по токсикологии рыб, в которых токсичность вещества характеризуется величиной TLM [820, 821, 463, 615], авторы, как правило, не указывают ее ошибки, что значительно снижает ценность полученных данных.
Существуют различные методы определения средней ошибки, и некоторые из них, например метод

Берепса и Шлоссера [440], основываются на определении этой величины непосредственно по данным эксперимента. Однако сложность вычисления средней ошибки по этому методу привела к использованию более простых и быстрых, хотя и менее точных методов ее расчета по пробитной кривой. При этом исходят из положения, что разность между концентрациями, определяющими гибель 16 и 84% взятых в опыт животных, равна удвоенному стандартному отклонению. Если известно число животных, использованных в интервале этих концентраций, то легко установить ошибку CL50. Из многочисленных методов, основанных на этом принципе, чаще других используются два: метод Литчфильда [668] и метод Миллера и Тейнтера [713]. Согласно первому из них ошибка SCL50 рассчитывается по формуле:
где 2δ = (CL-84) — (CL-16), а N — число животных, использованных в опытах между концентрациями CL
— 84 и CL— 16.
Расчетная формула Миллера и Тейнтера сходна с первой:
однако в ней учитывается число животных, использованных в интервале концентраций, вызывающих гибель 6,7 и 93,3% особей. Этот метод, видимо, наиболее предпочтителен, поскольку он учитывает большее количество опытных данных.
Хотя большинство токсикологов для оценки токсичности вещества используют СЬ50, тем не менее следует иметь в виду ее существенный недостаток: CL50 базируется на определении токсичности вещества для наименее устойчивых 50% животных. В связи с этим заслуживает внимания рекомендация В. М. Карасика [109] характеризовать токсичность вещества той концентрацией, которая вызывает гибель наибольшего числа животных испытуемой группы, т. е. летальность, соответствующую моде вариационной кривой. В качестве показателя изменчивости этой концентрации, по мнению В. М. Карасика, может быть использована высота этой моды, т. е. процент гибели. Фактически в некоторых областях частной токсикологии, например при изучении фунгицидов, используют не CL50, a CL95 [609]. И хотя CL50 предпочтительнее с точки зрения ее расчета и незначительного количества используемых животных, однако CL95 больше устраивает практиков в силу большей определенности получаемых результатов. При этом CL95 существенно отличается от CL100, критическую оценку которой мы дали выше, тем, что она имеет не абсолютный, а вероятностный характер (при уровне значимости 0,95). Это делает CL95 и CL05 вполне определенными с точки зрения оценки токсичности вещества в области летальных концентраций и сопоставимости экспериментальных данных различных авторов независимо от количества использованных в опыте животных.
Зона токсического действия. Наряду с использованием летальных и пороговых концентраций, характеризующих степень токсичности вещества для животных, весьма ценным критерием токсичности является зона токсического действия, которая «...для установления предельно допустимых концентраций... дает больше, чем какой-либо отдельно взятый показатель токсичности, как, например летальная концентрация» [289]. Обычно для расчета зоны токсического действия используют три основных параметра токсичности: CL50 или CL100 и пороговые концентрации. Согласно Н. С. Правдину [289] под зоной токсического действия подразумевается диапазон концентраций от пороговых до летальных (CL100). Другие авторы используют отношение СL50 к пороговой величине. Хотя использование авторами различных показателей токсичности и создает определенные трудности в количественной оценке зоны токсичности действия, однако опыт показывает, что допустимые концентрации исследуемого вещества, вычисленные по формуле, учитывающей широту зоны токсического действия, стоят наиболее близко к экспериментальным величинам.
В литературе по ихтиотоксикологии нам не удалось обнаружить каких-либо сведений относительно зоны токсического действия того или иного компонента промышленных сточных вод. Обычно авторы, характеризуя токсичность вещества для рыб и степень устойчивости последних, используют лишь несколько концентраций и указывают одну из двух величии: CL100 или TLМ. Вследствие этого мы не имеем никакой информации относительно того, как нарастает реакция рыб с изменением концентрации яда. А это имеет чрезвычайно большое значение в практическом отношении. Для подтверждения сказанного сошлемся на результаты наших опытов [193], проведенных на 2-летней форели. Использовали следующие концентрации фенола: 5, 7, 5, 10, 12, 5, 15, 20 и 25 мг/л. Действие каждой концентрации фенола испытывалось на 12-20 экземплярах рыб в 300-литровых аквариумах. Опыты проводили при температуре воды 12-14° С, содержании кислорода 9,6-10,2 мг/л, рН 6,8-7,2.
Установлено, что внутри очень маленькой области концентраций токсичность фенола для форели резко возрастает (табл. 9). Увеличение концентрации фенола всего на 2,5 мг/л (от 5 до 7,5 мг/л) приводит к гибели 50% испытуемых рыб, а последующее увеличение ее еще на 2,5 мг/л вызывает уже 100%-ную гибель рыб и при том за весьма короткое время — 129 мин. При дальнейшем повышении концентрации фенола с 10 до 15 мг/л время гибели рыб сокращалось в 3 раза.
Таблица 9
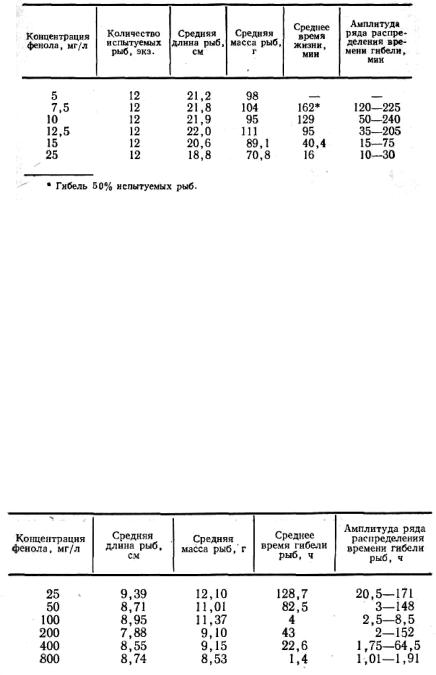
Влияние различных концентраций фенола на скорость гибели 2-летней форели.
Важное значение имеет величина зоны токсичности применительно к определенной амплитуде летальных концентраций, позволяющая проследить за динамикой изменения токсического эффекта у рыб в ответ на равномерное повышение концентрации яда. Решение этого вопроса имеет большое значение для прогнозирования возможности обратимости той или иной интоксикации в случае кратковременного контакта рыб с высокими концентрациями ядов промышленных сточных вод при аварийных сбросах.
Наши данные [187], полученные в опытах на 160 карасях 2 +-летнего возраста, выявили различную степень нарастания токсического эффекта (время гибели) с увеличением концентрации фенола. Так, при увеличении концентрации яда с 25 до 50 мг/л время выживания рыб сокращалось в 1,5 раза, а дальнейшее повышение его концентрации от 50 до 100 мг/л привело к сокращению времени выживания в 20,5 раза. Последующее увеличение концентрации фенола с 200 до 400 мг/л вызвало сокращение времени выживания только в 3,3 раза, а повышение ее от 400 до 800 мг/л — почти в 9 раз (табл. 10). Анализ опытных данных выявляет одно важное обстоятельство: гибель рыб при равномерном возрастании концентрации яда с 25 до 800 мг/л ускоряется крайне неравномерно и осуществляется не по принципу линейной зависимости между концентрацией и максимально достижимым эффектом.
Таблица 10
Зависимость скорости летального эффекта от концентрации яда.
В последующих наших опытах была установлена неравномерность ускорения гибели подопытных рыб с изменением концентрации токсического агента в области нижних и верхних летальных концентраций, о чем свидетельствуют результаты опытов, проведенных на 150 карасях (табл. 11).
Из данных табл. 11 видно, что при четырехкратном увеличении содержания яда в области нижних (25 — 100 мг/л) и верхних (200 — 800 мг/л) летальных концентраций имеет место неравномерное ускорение гибели испытуемых рыб: в 26 и 6 раз соответственно. Мы столкнулись с интересным фактом: скорость развития максимально достижимого эффекта, т. е. время выживания испытуемых рыб, изменяется по-разному при одинаковом увеличении концентрации яда в зависимости от области летальных концентраций, в которой оно имеет место. В области нижних летальных концентраций ускорение гибели испытуемых рыб с увеличением концентрации яда выражено значительно сильнее, чем в области верхних летальных концентраций. Полученные данные еще раз подтверждают необходимость использования для характеристики степени токсичности того или иного вещества широкой амплитуды летальных концентраций с тем, чтобы не только определить CL100 или CL95, но и проследить за динамикой нарастания скорости летального эффекта.
Таблица 11
Зависимость скорости летального эффекта от концентрации яда.

Пороговые концентрации веществ. Подобно тому как амплитуда летальных концентраций ограничена снизу CL0, а сверху CL100 или CL05 и CL95, так и область токсических концентраций имеет свои верхние и нижние границы. Концентрации, ограничивающие зону токсического действия снизу, именуют пороговыми концентрациями и определение их, по мнению Н. В. Лазарева [146], Н. С. Правдина [289], С. И. Черкинского [390] и др., является важнейшей задачей токсикологии. Н. С. Правдин [289] писал, что «токсикологическое значение пороговых концентраций заключается в том, что они являются одним из отправных моментов для установления допустимых концентраций».
Однако токсикологическое содержание пороговой концентрации, т. е. минимальной действующей концентрации токсиканта, менее определенно, чем, скажем, понятие «летальная концентрация». Если летальная концентрация определяется в конечном счете свойствами яда и устойчивостью к нему животного, то пороговая концентрация существенно зависит от метода ее установления. Поскольку разрешающие способности различных методик неодинаковы, выводы авторов о пороговой токсичности испытуемого вещества также различны и подчас трудно сопоставимы. Нередко разные авторы для оценки пороговой концентрации одного и того же вещества используют сдвиги в различных функциональных системах и органах, не сообразуясь при этом с механизмами реализации токсического действия данного вещества. Случается, что даже в одной работе при оценке пороговой концентрации используют разные критерии. Так, X. Денцер [519] в качестве пороговой концентрации различных веществ для рыб приводит то порог повреждения, то критический порог.
Исходя из разрабатываемой нами в ихтиотоксикологии концепции физиологической нормы организма 1163, 177, 176, 161], мы считаем, что «в качестве пороговой концентрации должна быть принята такая
концентрация, которая вызывает какие-либо выраженные патологические сдвиги в любой отдельно взятой функциональной системе организма» [163]. Иными словами, любой биохимический или физиологический показатель, характеризующий нормальный ход жизнедеятельности целостного организма, может быть использован для обнаружения порогового эффекта того или иного токсиканта. Чем более совершенны методы контроля интересующего нас показателя и чем выше их разрешающие способности, тем быстрее и надежнее можно выявить токсический эффект пороговой концентрации исследуемого вещества.
ПДК веществ. Конечная цель ихтиотоксикологических экспериментов — установление ПДК веществ, поступающих в рыбохозяйственные водоемы. По существу, это пока единственный эффективный способ предотвращения загрязнения водоемов и снижения их рыбопродуктивности. Определение ПДК возможно только с учетом данных острого, подострого и хронического опытов, позволяющих выявить зону токсического действия и пороговую концентрацию. «Узкая зона токсического действия требует, чтобы допустимая концентрация находилась возможно ниже порога токсического действия, чтобы она возможно дальше отстояла от пороговой концентрации. Наоборот, чем шире зона токсического действия, тем вещество менее опасно в смысле возможности острого отравления, тем ближе к пороговой концентрации может быть и допустимая концентрация» [289]. Пороговая концентрация токсиканта является отправной точкой экспериментального выявления ПДК, поскольку пороговая концентрация — это минимальная действующая концентрация, а предельно допустимая — максимальная недействующая концентрация исследуемого вещества. Следовательно, методы определения пороговой и предельно допустимой концентраций того или иного вещества должны быть идентичны.
В современной ихтиотоксикологии все еще нет общепринятого представления о ПДК токсикантов. Некоторые считают, что это безвредная концентрация, не вызывающая гибели рыб. Другие [328, 332] полагают, что «критерием токсичности того или иного вещества для гидробионтов в конечном счете могут быть только плодовитость и качество потомства». Следовательно, ПДК — это такая концентрация, которая не оказывает влияния на плодовитость и качество потомства. Критический анализ сущности этих представлений дан нами в гл. I. Будучи верным в общебиологическом плане, этот критерий имеет весьма ограниченное значение в практическом отношении, поскольку может быть использован только в опытах на гидробионтах с коротким биологическим циклом.
К рыбе этот критерий практически неприменим не только из-за значительной длительности биологического цикла. Плодовитость и качество половых продуктов рыб — функция многих переменных, определяемая нормальным течением разнообразных физиологических процессов. Ход последних может быть нарушен лишь массированным токсическим воздействием, поскольку организм располагает определенными
