
- •Содержание
- •Глава I почки: почечные камни
- •Глава II обмен натрия и воды
- •Глава III обмен калия: лечение диуретиками
- •Глава IV гомеостаз ионов водорода:
- •Глава V гипоталамус и гипофиз
- •Глава VI кора надпочечников: актг
- •Глава VII половые железы: гонадотропины, пролактин
- •1. Тестирование в течение ночи (для диагностики синдрома Кушинга)
- •2. Тестирование с применением высокой дозы (для идентификации причины диагностированного синдрома Кушинга)
- •Функции щитовидной железы: ттр
- •Глава IX обмен углеводов и его взаимосвязи
- •Липиды и липопротеиды плазмы крови
- •Глава XI обмен кальция, фосфатов и магния
- •Глава XII всасывание в кишечнике: функции поджелудочной железы и желудка
- •Глава XIII заболевания печени и желчные камни
- •Глава XIV белки мочи и плазмы крови
- •Глава XV ферменты плазмы крови в диагностике
- •Глава XVI врожденные нарушения обмена веществ
- •Глава XVII обмен пуринов и солей мочевой кислоты
- •Глава XVIII обмен железа
- •Глава XIX порфирии
- •Глава XX витамины
- •Глава XXI беременность и терапия пероральными контрацептивами
- •Глава XXII биохимические эффекты новообразовании
- •Глава XXIII спинномозговая жидкость
- •Глава XXIV мониторинг лекарственных средств
- •Глава XXV вклад клинициста в повышение информативности результатов лабораторных исследований
- •Глава XXVI запросы на выполнение анализов и интерпретация полученных результатов
Глава IX обмен углеводов и его взаимосвязи
Для большинства регионов мира углеводы составляют главный источник энергии в потребляемых продуктах питания. При обычных обстоятельствах крахмал — преобладающий углевод пищи, доля дисахаридов значительна, моносахаридов — небольшая.
ХИМИЯ
Наиболее физиологически важные моносахариды гексозы представляют собой редуцирующие сахара и поэтому реагируют с таблетками «Клинитест», содержащими соединение меди, изменяющее окраску при восстановлении. К числу гексоз относятся глюкоза, фруктоза, галактоза.
Распространенными дисахаридами являются сахароза (фруктоза+глюкоза), лактоза (галактоза + глюкоза), мальтоза (глюкоза + глюкоза).
Лактоза и мальтоза (но не сахароза) — редуцирующие сахара.
К природным полисахаридам, молекулы которых состоят из длиннь1х углеводородных цепей, построенных из остатков глюкозы, относятся: 1) крахмал, содержащийся в растениях и представляющий собой смесь амилозы (нитевидные цепи) и амилопектина (разветвленные цепи); и 2) гликоген, встречающийся в тканях животных и представляющий собой полисахарид с сильно разветвленными углеводородными цепями в молекуле.
ФИЗИОЛОГИЯ
Значение внеклеточного уровня глюкозы
При гипогликемии в наибольшей степени повреждаются клетки головного мозга. Они получают энергию в результате аэробного метаболизма глюкозы и не способны: 1) накапливать глюкозу в значительных количествах; 2) синтезировать глюкозу;
3) метаболизировать другие субстраты, кроме глюкозы и кетопов. Обычно последние удовлетворяют энергетические потребности головного мозга в незначительной степени, поскольку в норме содержание кетонов в плазме крови очень низкое; 4) извлекать в достаточных для их нужд количествах глюкозу из внеклеточной жидкости, где она содержится в низкой концентрации; инсулин не способствует поступлению глюкозы из внеклеточной жидкости в клетки головного мозга.
Ясно, таким образом, что головной мозг во многом зависит от внеклеточной концентрации глюкозы как источника энергии, и что при гипогликемии высока вероятность нарушения функций мозга. Гипергликемия, особенно быстро развивающаяся, также может вызывать дисфункцию мозга, воздействуя на внеклеточную осмоляльность. У здорового человека концентрация глюкозы в плазме крови (внеклеточная) обычно остается в пределах от 4,5 до 11 ммоль/л, несмотря на периодические нагрузки глюкозой, поступающей в организм из желудочнокишечного тракта.
Поддержание концентрации глюкозы в плазме крови на уровне, не превышающем приблизительно 11 ммоль/л, сводит к минимуму возможность выведения этого источника энергии из организма. В почечных канальцах реабсорбируется почти вся глюкоза из клубочкового фильтрата до достижения указанной концентрации (почечный порог), так что в норме моча почти не содержит глюкозы, даже после приема пищи, богатой углеводами. Задерживаемая организмом глюкозы может сохраняться в виде резерва до возникновения потребности в ней.
Поддержание постоянства внеклеточной концентрации глюкозы
Концентрация глюкозы в плазме зависит от равновесия между поступлением глюкозы во внеклеточную жидкость и выходом из нее. Поскольку в норме лишь небольшая доля глюкозы выводится из организма в неизмененном виде, сохранение постоянства концентрации в плазме в относительно узком диапазоне от 4,5 до 11 ммоль /л при значительных вариациях поступления из желудочнокишечного тракта по всей вероятности определяется процессами обмена с клетками. Если мы сумеем понять механизмы взаимодействия между тканями, лежащие в основе регуляции этих процессов, мы сможем также объяснить нарушения метаболизма углеводов при патологических состояниях (в том числе при накоплении избытка кетоновых тел и молочнокислом ацидозе) .
Печень — наиболее важный непарный орган, обеспечивающий непрерывное снабжение энергией другие ткани, в том числе головной мозг, при самых разнообразных условиях. Она играет также важную роль в регуляции содержания глюкозы в плазме после приема пищи. По многим причинам печень хорошо приспособлена для осуществления этих функций.
Кровь воротной вены, оттекающая от стенки кишечника, где происходят процессы всасывания, поступает прежде всего в печень. Клетки печени играют ключевую роль при осуществлении буферных эффектов в отношении гипергликемии после приема богатой углеводами пищи (рис. 25).
Клетка печени обладает свойством осуществлять биосинтез гликогена в условиях временного избытка глюкозы. Скорость синтеза гликогена (гликогенез) из глюкозо6фосфата (Г6Ф) может быть повышена под влиянием инсулина (см. рис. 25), который секретируют [3клетки поджелудочной железы в ответ на повышение содержания глюкозы в кровяном русле.
В условиях временного избытка глюкозы печень способна частично превращать ее в жирные кислоты, которые в конечном счете образуют тканевые резервы в виде триглицеридов жировой клетчатки (см. рис. 25).

Поступление глюкозы в клетки печени (и головного мозга) зависит от внеклеточной концентрации глюкозы. Инсулин не оказывает непосредственного воздействия на этот процесс. Превращение глюкозы в Г6Ф (первый этап метаболизма глюкозы во всех клетках) в печени катализирует фермент глюкокиназа, имеющий низкое сродство к глюкозе по сравнению с гексокиназой, обнаруживаемой в большинстве тканей. Активность глюкокиназы индуцирует инсулин, секретируемый в ответ на повышение концентрации глюкозы в циркулирующей крови. По этим причинам в клетки печени поступает пропорционально меньше глюкозы во время голодания, когда уровни глюкозы в крови воротной вены низкие, чем после приема пищи, богатой углеводами. Указанные факторы способствуют в условиях голодания поддержанию постоянства уровня поступления глюкозы в такие легко ранимые объекты как ткани головного мозга.
При аэробных условиях в печени возможен синтез глюкозы путем глюконеогенеза с использованием продуцируемых в других тканях глицерина, лактата или углеводородных цепей, образующихся при дезаминировании большинства аминокислот (главным образом, аланина).
В печени имеется фермент (глюкозо6фосфатаза), который, катализируя гидролиз Г6Ф, продуцируемого при расходе гликогена (гликогенолиз) или при глюконеогенезе, способствует высвобождению глюкозы и поддержанию постоянства ее внеклеточной концентрации в условиях голодания. Гликогенолиз в печени стимулируется гормоном глюкагоном, который секретируют аклетки поджелудочной железы.
Во время голодания в печени возможно превращение высвобождаемых из жировой клетчатки жирных кислот в кетоновые тела, которые могут быть использованы другими тканямп (в том числе и головного мозга) в качестве источника энергии в условиях ограниченного поступления глюкозы.
Это сочетание свойств уникально для печени. Единственной другой тканью, в которой возможен глюконеогенез и превращение Г6Ф в глюкозу, является корковый слой почек. Способность почек к глюконеогенезу, по-видимому, важна преимущественно в связи с гомеостазом ионов водорода.
Другие ткани в большей или меньшей степени могут накапливать гликоген, но они не содержат глюкозо6фосфатазу и способны использовать гликоген лишь локально; в поддержании постоянства уровня глюкозы в плазме крови этот гликоген никакой роли не играет.
Как мы уже видели, печень изменяет потенциальный гыпергликемический эффект богатой углеводами пищи, извлекая из притекающей крови воротной вены относительно больше глюкозы, чем в условиях голодания. Однако некоторая доля глюкозы проходит неизмененной через печень, и повышение концентрации глюкозы в циркулирующей крови стимулирует секрецию (3клетками поджелудочной железы инсулина, который затем может стимулировать гликогенез в печени и мышцах. Еще более важно то обстоятельство, что поступление глюкозы в жировую клетчатку и в клетки мышц (в противоположность ее поступлению в печень и головной мозг) стимулируется инсулином, и содержание глюкозы в плазме быстро снижается до величин, близких к наблюдаемым в условиях голодания. Эти явления не происходят при относительной или абсолютной недостаточности инсулина (сахарный диабет). Превращение внутриклеточной глюкозы в Г6Ф в клетках жировой ткани или мышц катализирует фермент гексокиназа, который, имея более высокое сродство к глюкозе, чем глюкокиназа печени, обеспечивает в указанных клетках участие в реакциях обмена веществ глюкозы при более низких концентрациях, чем в печени.
За счет возникающего после приема пищи избытка глюкозы как в мышцах, так и жировой клетчатке создаются тканевые резервы углеводов, но механизм образования этих резервов и их функции в двух указанных типах клеток совершенно различны. Многие нарушения метаболизма углеводов можно объяснить на основе изучения взаимозависимости реакций обмена углеводов в каждой из этих двух тканей и печени.
Кетоацидоз Жировая клетчатка и печень
Наиболее важным долгосрочным резервом энергии в организме являются триглицериды жировой клетчатки. Резко повышенное использование этих запасов жира сопровождается накоплением кетоновых тел (кетоацидоз).
Жировая клетчатка, взаимодействуя с печенью, превращает избыток глюкозы в триглицериды, создавая тканевые энергетические резервы преимущественно в виде триглицеридов, а не гликогена. Входящие в состав триглицеридов жирные кислоты образуются из глюкозы, поступающей в печень, а глицериновый компонент триглицеридов — из глюкозы, поступающей в клетки жировой ткани.
В печени при синтезе триглицеридов глицерол3фосфат образуется из триозофосфата, а жирные кислоты — из ацетилКоА.
Эти триглицериды транспортируются в составе ЛПОНП в жировую клетчатку, где они подвергаются гидролизу, катализируемому липопротеидлипазой. Высвобождаемые жирные кислоты (печеночного происхождения) конденсируются с глиперол3фосфатом, образующимся из глюкозы, которая поступает в жировую клетчатку под влиянием инсулина, и накапливающиеся триглицериды составляют тканевой резерв. В виде триглицеридов в резервной форме можно хранить значительно больше энергии, чем в виде гликогена.
В условиях голодания, когда экзогенная глюкоза отсутствует, эндогенные триглицериды жировой клетчатки претерпевают обратное превращение путем липолиза в свободные жирные кислоты (СЖК) и глицерин (рис. 26). Эти соединения транспортируются в печень, где глицерин включается в реакции глюконеогенеза на стадии образования триозофосфатов. Синтезируемая при этом глюкоза может поступать в кровоток в то время, когда концентрация глюкозы в плазме имела бы тенденцию к снижению, если бы процесс глюкоцеогеыеза не функционировал. Большинство тканей, за исключением головного мозга, используют СЖК в качестве источника энергии после превращения в ацетилКоА. Кроме того, в печени возможно также образование ацетоуксусной кислоты путем ферментативного превращения двух молей ацетилКоА. Ацетоуксусная кислота может быть восстановлена до роксимасляной кислоты или декарбоксилирована с образованием ацетона.
Эти кетоновые тела могут быть использованы в качестве источника энергии головным мозгом и другими тканями в периоды относительной недостаточности поступления глюкозы.
Кетоацидоз, таким образом, развивается, когда главным источником энергии являются тканевые резервы жиров. Кетоны могут накапливаться л условиях голодания ялц при рвотах (i> результате снижения всасывания компонентов пищевых продуктов из желудочнокишечного тракта). Умеренный кетоацидоз может развиться после голодания в течение всего 12 ч (это явление не следует ошибочно интерпретировать как диабетический кетоацидоз).
После кратковременных периодов голодания признаки ацидоза обычно обнаружить не удается. Но после более длительных периодов продуцирование ионов водорода превышает компенсаторные возможности гомеостатических механизмов, и концентрация биокарбонатов в плазме снижается. В течение многих недель постоянство концентрации глюкозы в плазме поддерживается компенсаторными механизмами печени, но при длительном голодании (как, например, при нейрогенной анорексии) или в раннем детстве может развиться гипогликемия, сопровождающаяся кетоацидозом. Головной мозг может в меньшей степени пострадать при гипогликемии, сопровождающейся кетоацидозом, чем при той же степени гипогликемии, обусловленной действием инсулина. В первом случае ткань мозга адаптируется к метаболизированию кетоновых тел, тогда как во втором случае при низком содержании кетонов, мозг оказывается лишенным единственного (за исключением глюкозы) источника энергии.
Диабетический кетоацидоз — более тяжелое патологическое состояние. Наличие гипергликемии отличает его от кетоацпдоза при голодании, но механизм увеличения содержания кетонов при обоих состояниях идентичен. При кетоацидозе в условиях голодания количество поступающей глюкозы в клетки жировой ткани недостаточно для обеспечения соответствующих норме уровней гликолиза и липогенеза. При недостаточности инсулина дефицит глюкозы внутри клеток обусловлен нарушением поступления в них глюкозы, внеклеточная концентрация которой высока (но не может рассматриваться как показатель высокого внутриклеточного уровня глюкозы). Явление кетоацидоза указывает на то, что липолиз осуществляется на преобладающем пути метаболизма.
После приема пищи глюкоза поступает в мышцы под влиянием инсулина и откладывается в виде гликогена как тканевой резерв. Поскольку глюкозо6фосфатаза отсутствует, этот гликоген не может быть превращен в глюкозу и пригоден лишь для использования в самих мышцах. Количественно тканевые резерBbi гликогена скелетных мышц уступают только таковым печени.
Мышечное сокращение (рис. 27). При функционировании мышц адреналин стимулирует гликогенолиз. Образующийся при этом Г-6-Ф быстро утилизируется в процессе гликолиза и нри окислении в цикле трикарбоновых кислот, поставляя необходимую энергию. В этих условиях высокая скорость гликолиза может не соответствовать поступлению кислорода п продукты гликолиза могут накапливаться быстрее, чем осуществляется их непосредственное окисление при аэробных условиях.
Суммарное уравнение реакции анаэробного гликолиза:
Глюкоза—>2 Лактат--+2Н+
Током крови лактат переносится в печень, где он может быть использован в процессах глюконеогенеза, поставляющих дополни тельные количества глюкозы для функционирования мышц (цикл Кори).

Рис. 27. Метаболизм углеводов при мышечном сокращении.
В процессе глюконеогенеза Н4" также подвергается повторной утилизации. При аэробных условиях потребление печенью лактата значительно превышает его продукцию.
Такое физиологическое накопление молочной кислоты во время мышечного сокращения представляет собой обратимое явление. Молочная кислота быстро исчезает в состоянии покоя, когда снижение скорости глпколиза дает возможность аэробным процессам нормализоваться.
Патологический лактатацидоз
Молочная кислдта, образующаяся при анаэробном гликолнзе. может быть окислена до СОг и воды в ЦТК или превращена обратно в глюкозу путем глюконеогенеза в печени. Как ЦТК, так п глюкопсогсасз требуют наличия кпслорода. Единственным мс таболическим процессом, не требующим кислорода, является анаэробный гликолиз.
Патологическое накопление лактата может быть обусловлено повышенной его продукцией пли сниженной утилизацией. Продукция может быть повышена при нарастании скорости анаэробного гликолиза. Утилизация может быть снижена при нарушении функционирования ЦТК или глюконеогенеза.
Клинические синдромы, связанные с лактатацидозом, обычно вовлекают несколько этих факторов.
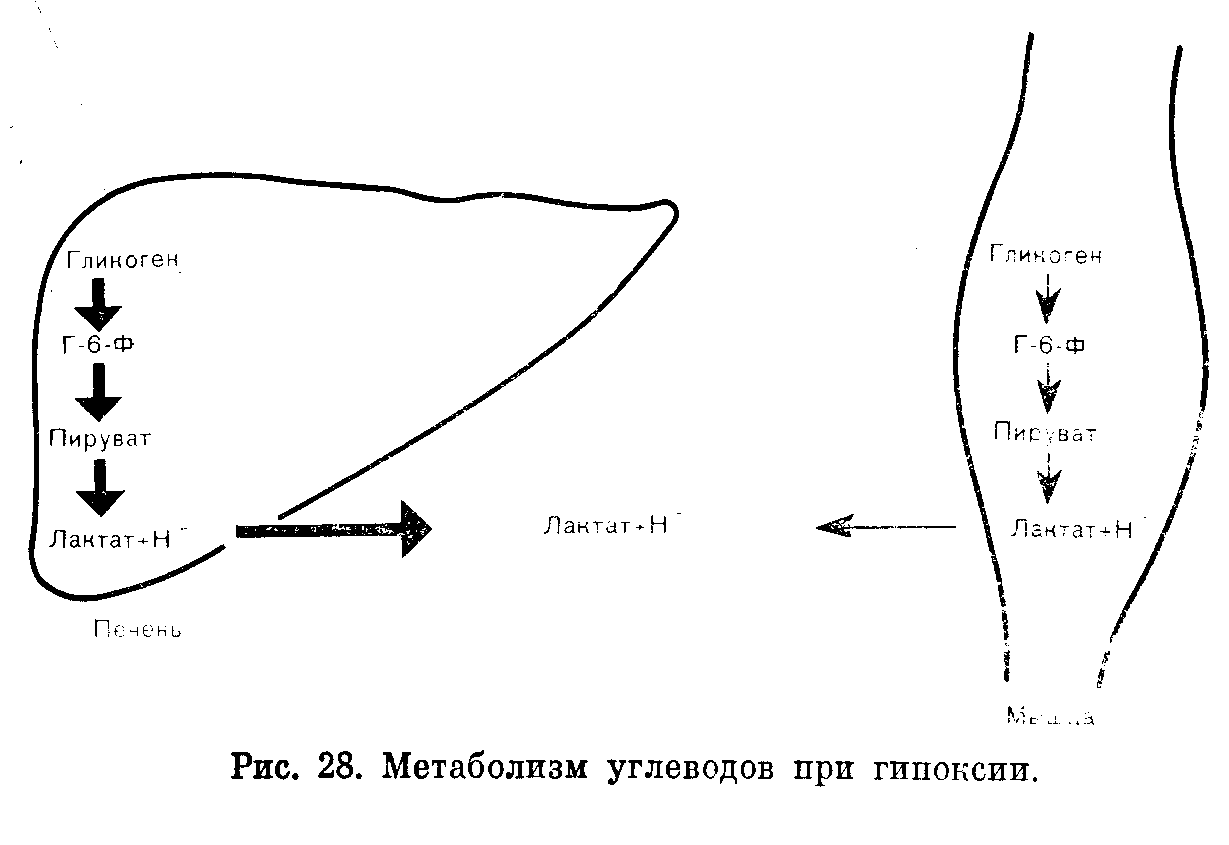
Тканевая гипоксия, обусловленная плохим кровоснабжением тканей в условиях синдрома шока, — наиболее обычная и важнейшая причина лактатацидоза (рис. 28). В этих условиях тканевая гипоксия повышает содержание лактата в плазме потому, что: 1) ЦТК не функционирует в анаэробных условиях и окисление пирувата, а также лактата до СОз и воды нарушено; 2) глюконеогенез из лактата в печени и почках не может происходить в анаэробных условиях; 3) анаэробный гликолиз стимулирован, поскольку пониженный уровень АТФ не может быть нормализован за счет ЦТК, как это происходит при аэробных условиях.
Сочетание нарушенного глюконеогепеза и стимулированного анаэробного гликолиза лишает печень особенностей органа, потребляющего лактат и Н"1', придавая ей свойства органа, генерирующего большие количества молочной кислоты.
При тяжелой гипоксии (как, например, после остановки сердца) отмечают очень тяжелый ацидоз. При истощении объема жидкости в организме этот гипоксический синдром может также осложнять диабетический кетоацидоз.
Ниже указаны некоторые другие причины лактатацидоза. Во всех случаях отмечают нарушение соответствия между образованием и утилизацией пирувата.
Метформин или фенформин, лекарственные средства, применяемые для лечения диабета, могут вызвать тяжелый лактатацидоз. Они ингибируют как ЦТК, так и глюконеогенез. В настоящее время эти препараты используют редко из-за опасности раз вития лактатацидоза; применение фенформина в некоторых странах запрещено.
Тяжелые заболевания (как, например, лейкозы) могут сопровождаться лактатацидозом. В развитии такого ацидоза могут участвовать различные факторы, в частности, плохое кровоснабжение тканей и стимуляция анаэробного гликолиза в тканях злокачественных новообразований.
Внутривенное вливание фруктозы может вызвать лактат ацидоз. В отличие от глюкозы фруктоза, когда ее концентрация в плазме низкая, поступает в клетки печени, где превращается в глюкозу. Скорость анаэробного гликолпза может превзойти потенциальную мощность ЦТК в печени даже в условиях слабой гипоксии. По этой причине в настоящее время фруктозу редко используют в качестве источника энергии при парентеральном питании.
При недостаточности глюкозо6фосфатазы (болезнь Гирке) скорость гликолиза возрастает, если Г6Ф не может быть превращен в глюкозу в печени п почках.
Лечение лактатацидоза направлено па устранение pro причины и на ацидоз как таковой. Определения уровней лактата в крови редко бывают необходимыми, поскольку опасным является именно ацидоз; лактат сам по себе безвреден.
Гормоны, участвующие в гомеостазе глюкозы
Некоторые важные эффекты этих гормонов уже были описаны. Обобщающие сведения об пх действии представлены в табл. 17.

Инсулин — наиболее важный гормон, регулирующий пути метаболизма, описанные выше. В (3клетках островков поджелудоч ной железы образуется проинсулин, в состав молекулы которого входит полипептид инсулин, состоящий из 51 аминокислотного остатка, и соединительный пептид, состоящий из 33 аминокислотных остатков. Последний связывает между собой один конец Апепи с другим концом Вцепи инсулина. Протеолиз проинсулина высвобождает инсулин, две аминокислоты (по одной от каждого конца соединительного пептида) и остающуюся часть соединительного пептида (называемого Спептидом). В клетках островков образуются резервы инсулина и Спептида, из которых они высвобождаются в плазму в эквимолярных количествах, преимущественно в ответ на развитие гипергликемии.
Инсулин связывается со специфическими рецепторами на поверхности чувствительных к инсулину клеток жировой ткани и мышц. Наиболее важным эффектом инсулина является стимуляция поступления глюкозы в эти клетки, что приводит к снижению ее содержания в плазме крови.
Таким образом, физиологический ответ на гипергликемию зависит от адекватной секреции инсулина, функций инсулинорецепторов, внутриклеточных процессов, развивающихся после связывания инсулина рецептором («пострецепторные реакции»).
С-пептид, по-видимому, по играет важной физиологический роли, но результаты определений его концентрации могут быть полезны при дифференциальной диагностике причин гипогликемии.
При низких концентрациях инсулина (например, в условиях голодания) отчетливо выявляются свойства гормона роста, глюкокортикоидов, адреналина и глюкагопа вызывать гппергликемию, даже если скорость секреции этих гормонов не нарастает. Истинное повышение секреции указанных гормонов происходит при стрессе и акромегалии (ГР), синдроме Кушинга (глюкокортикоиды), феохромоцитоме (адреналин и норадреналин).
В молекуле глюкагона имеется одна полипептидная цепь, синтезируемая в аклетках островков поджелудочной железы. Секреция глюкагона стимулируется гипогликемией.
Некоторые принципы, которые мы обсуждали выше, применимы к проблеме парентерального питания. Этот вопрос кратко рассмотрен в гл. IX.
Глюкоза мочи
Глюкозурией считают наличие в моче такой концентрации глюкозы, при которой она может быть обнаружена с помощью относительно малочувствительного, но специфичного скринингового теста (например, Клинистикса), который содержит глюкозооксидазу. Обычно клетки проксимальных отделов почечных канальцев реабсорбируют основную массу глюкозы из клубочкового фильтрата. Очень низкие концентрации глюкозы могут быть обнаружены даже в моче здоровых лиц, если использовать более чувствительные методы. Однако глюкозурия развивается только в тех случаях, когда содержание глюкозы в плазме крови и, следовательно, в клубочковом фильтрате значительно превосходит реабсорбционную мощность почечных канальцев. Такая ситуация может возникать потому, что: 1) уровни глюкозы в плазме крови и в клубочковом фильтрате превышают в среднем 11 ммоль/л и таким образом значительно превосходят реабсорбционную мощность здоровых почечных канальцев; 2) реабсорбционная мощность почечных канальцев снижена, так что глюкозурия имеет место при более низких уровнях глюкозы в фильтрате (почечная глюкозурия). Обычно это состояние безвредно для здоровья.
В некоторых случаях глюкозурия не развивается, хотя содержание глюкозы в плазме крови превышает 11 ммоль/л. Если объем клубочкового фильтрата мал, то общее количество глюкозы, поступающей к клеткам почечных канальцев, может быть ниже нормы, даже при ее высокой концентрации. В этих условиях результаты тестирования, основанного на исследованиях мочи, могут потерять свою информативность как показатель требуемой дозы антиддабетических лекарственных средств для пациентов, у которых нарушены функции почек.
Наиболее чувствительным при скрининге для выявления глюкозурии является тест образца мочи, собранной пряблнзительнч через 1 ч после приема пищи, когда можно ожидать максимальной концентрации глюкозы в плазме крови. При исследовании мочи, собранной после периода голодания, положительные результаты будут получены только в тех случаях, когда концентрация глюкозы в плазме крови натощак превышает 11 ммоль/л (при тяжелых формах сахарного диабета или во время внутривенных вливаний глюкозы), или при значительной почечной глюкозурии.
Содержащиеся в моче восстанавливающие вещества (в том числе, глюкоза) можно обнаружить при помощи таблеток клинитест. При исследовании новорожденных этот тест важен, так как наличие восстанавливающих веществ, отличающихся от глюкозы, может свидетельствовать о наследственной аномалии метаболизма. Указанный тест можно использовать при контроле дозировки лекарственных средств в ходе лечения больных диабетом.
ГИПЕРГЛИКЕМИЯ И САХАРНЫЙ ДИАБЕТ
Гипергликемия может развиться при синдроме сахарного диабета; у пациентов, которым внутривенно вводят жидкости, содержащие глюкозу; как временное явление при тяжелом стрессе; в некоторых случаях при расстройствах мозгового кровообращения.
Сахарный диабет
Сахарный диабет возникает в результате абсолютной или относительной недостаточности инсулина. Согласно определению Всемирной организации здравоохранения (ВОЗ), на основании результатов лабораторных исследований свидетельством недостаточности инсулина считают содержание глюкозы в плазме крови натощак 8 ммоль/л или (даже при нормальном уровне глюкозы в плазме крови натощак) концентрацию 11 ммоль/л и выше через 2 ч после приема внутрь эквивалента 75 г глюкозы. Тяжелые формы диабета всегда сопровождаются гипергликемией.
В качестве предварительной ВОЗ предлагает следующую классификацию случаев диабета:
1) инсулинзависимый сахарный диабет (ИЗСД, тип 1). Этим термином обозначают те случаи, когда инсулинотерапия необходима, поскольку имеется склонность к развитию кетоацидоза. Как правило, заболевание начинается в детстве, наиболее часто поражая детей, подкожная клетчатка которых особенно богата жирами (HLA типов DR3 и DR4). Было выдвинуто предположение о том, что во многих случаях заболевание является следствием вирусной инфекции, приводящей к разрушению рклеток островков поджелудочной железы.
2) инсулиннезависимый сахарный диабет (ИНСД, тип 2). Эта форма заболевания наиболее распространенная. При ней инсулин, хотя и может требоваться для лечения некоторых пациентов, не является жизненно необходимым; развитие кетоацидоза отмечается значительно реже, чем при ИЗСД. Начало заболевания наиболее часто наблюдают у взрослых людей. Различают сопровождающуюся н не сопровождающуюся ожирением формы ИНСД. К развитию спндрома ИНСД могут приводить многие наследственные аномалии, с которыми связано либо снижение секреции инсулина, либо возникновение его относительной недостаточности, несмотря на высокое содержание этого гормона в плазме крови. Относительная недостаточность инсулина может быть следствием резистентности к его действию, дисфункций рецепторов или пострецепторных систем.
3) диабет, связанный с другими патологическими состояниями, к числу которых относятся: а) абсолютная недостаточность инсулина, обусловленная заболеваниями поджелудочной железы (хронический панкреатит, гемохроматоз, кистозный фиброз);
б) относительная недостаточность инсулина, обусловленная либо избыточной секрецией гормона роста (акромегалия) или глюкокортикоидов (синдром Кушинга), либо повышением содержания глюкокортикоидов вследствие введения стероидов; в) относительная недостаточность инсулина, обусловленная действием некоторых других лекарственных средств (например, тиазидные диуретики).
4) диабет беременных. Эту форму диабета, не обнаруживаемого до наступления беременности, рассматривают особо, учитывая его потенциальную опасность для плода. Если после родов диагноз сахарного диабета подтверждается, то такие случаи следует отнести к одной из названных выше классификационных групп.
Другие нарушения метаболизма, обусловленные недостаточностью инсулина
Следствием недостаточности инсулина является также развитие нарушений обмена липидов. Стимулируется липолиз и повышается содержание СЖК в плазме крови . В печени СЖК превращаются в ацетилКоА и кетоны или вновь эстерифицируются с образованием эндогенных триглицеридов и включаются в ЛПОНП. По мере увеличения содержания ЛПНП стимулируется также биосинтез холестерина. В крови при очень большой недостаточности инсулина могут накапливаться хиломикроны.
Стимуляция катаболизма белков может вызвать уменьшение массы скелетных мышц.
Отдаленные последствия
Часто встречаются такие заболевания кровеносных сосудов как недостаточность мозгового или периферического кровообращения. Нарушения микроциркуляции особенно значительно ухудшают функции сетчатой оболочки глаза и почек. При диффузном и (что встречается реже) узелковом склерозировании почечных клубочков (синдром Киммельстила—Уилсона) может развиться нефротический синдром. Обычны инфекционные заболевания, которые могут осложнять патологические состояния, связанные с поражением почек и периферических сосудов. У больных диабетом новорожденные дети часто имеют большую массу тела.
Принципы лечения сахарного диабета
Мы лишь кратко рассмотрим проблему лечения сахарного диабета.
Отдаленные осложнения сахарного диабета могут быть следствием гипергликемии. Целью лечения должно быть поддержание концентрации глюкозы в плазме крови в пределах нормы. Некоторых пациентов учат контролировать содержание глюкозы в их крови на протяжении дня при помощи пропитанных реагентами полосок фильтровальной бумаги: изменение цвета такой полоски можно оценить количественно, используя портативный прибор для измерения отражения света. Эта процедура связана с неудобством, поскольку требует неоднократных пункций кожи. Однако достаточно грамотный и аккуратный пациент может таким путем подобрать нужную для него дозу инсулина более точно, чем на основании результатов исследований мочи. Необходимо, чтобы лаборатория регулярно контролировала надежность результатов, проверяя как реагенты, так и прибор. Пациент должен находиться под постоянным медицинским наблюдением.
У пациентов с ИЗСД потребность в инсулине варьирует. Так, например, во время любого заболевания или беременности может возникать необходимость в повышении дозы инсулина.
У пациентов с ИНСД содержание глюкозы в крови часто удается регулировать путем диетотерапии по мере уменьшения массы тела. У относящихся к этой категории больных секрецию инсулина могут стимулировать такие производные сугьфонилмочевины как бутамид или глибенкламид, применяемые в качестве лекарственных средств. Бигуаниды (метформин или фенформин) применяют для снижения содержания глюкозы в крови. Механизм их действия полностью не выяснен, но они ингибируют глюконеогенез либо непосредственно, либо опосредованно. Выше уже упоминалось об опасности развития лактатацидоза. Пациенты с ИНСД в период стресса могут нуждаться в инсулине.
Острые нарушения обмена веществ при диабете
При диабете возможно развитие одного из нарушений метаболизма, при которых необходима срочная медицинская помощь. Наиболее серьзными из этих нарушений являются: 1) диабетический кетоацидоз; 2) гиперосмоляльная бескетонная кома; 3) гипогликемия, обусловленная введением инсулина в большем количестве, чем это было необходимо.
Диабетический кетоацидоз
Диабетический кетоацидоз является следствием ряда нарушений метаболизма, описанных кратко на с. 216. Развитие диабетического кетоацидоза могут ускорить инфекционные заболевания или желудочнокишечные дисфункции, сопровождаемые рвотами. Пациент может ошибочно воздерживаться от введения инсулина, полагая, что, если он не принимал пищи, не требуется и инсулин. Развивающиеся последствия обусловлены преимущественно тремя факторами; гликозурией, гиперосмолярностью плазмы крови и накоплением кетоновых тел.
Содержание глюкозы в плазме обычно в пределах 20— 40 ммоль/л (400—700 мг/дл), но может быть значительно выше. Это приводит к выраженной гликозурии, вызывающей осмотический диурез, результатом чего является потеря воды, а также истощение резерва электролитов в организме. При кетоацидозе часто бывают рвоты, усугубляющие истощение резервов жидкости и электролитов. Поскольку плазма крови становится гиперосмоляльной, в процесс истощения резервов жидкости вовлекаются как внутриклеточный, так и внеклеточный объемы, что приводит к снижению объема циркулирующей крови, кровоснабжения почек, скорости клубочковой фильтрации, резкой дегидратации клеток. Обычно повышается концентрация мочевины в плазме и часто наблюдают такие признаки концентрирования крови, как нарастание показателей гематокрита и общего содержания белков. Результаты этих исследований указывают, таким образом, на истощение объема жидкости в организме.
Вследствие недостаточности глюкозы в клетках повышается скорость липолиза. При этом образуется СЖК больше, чем может быть утилизировано в периферических тканях. В печени происходит превращение СЖК в кетоновые тела или включение их в молекулы эндогенных триглицеридов. Может развиться тяжелая гиперлипемия. Продуцируемые одновременно с кетоновыми телами (за исключением ацетона) ионы водорода взаимодействуют с бикарбонатной буферной системой плазмы. По мере секреции ионов водорода в соответствии с механизмом, описанным на с. НО, рН мочи" понижается. Хотя, как всегда, секреция Н" связана с иырабиткой эквнмолярпых количеств бикарбонатов, этот последний процесс не может компенсировать утилизацию бикарбонатов при буферных эффектах, в результате чего уровень бикарбонатов в плазме снижается. Развивающийся метаболический ацидоз стимулирует дыхательный центр, дыхание становится глубже, величина Рсог уменьшается. Такая компенсация за счет дыхания может поддерживать величину рН крови в пределах нормы в течение некоторого времени, но это достигается ценой дальнейшего уменьшения содержания бикарбонатов в плазме до очень низкого уровня. Классическим признаком диабетического кетоацидоза является глубокое ритмичное дыхание (дыхание Куссмауля) с запахом ацетона в выдыхаемом воздухе.
До начала лечения уровень калия в плазме может быть повышенным, что. по-видимому, обусловлено ацидозом, уменьшенным поступлением глюкозы в клетки и низкой СКФ. Необходимо учитывать, однако, что с мочой выводится много калия и что в организме возникает общая недостаточность калия. Это обстоятельство становится очевидным в процессе лечения, когда калий вновь поступает в клетки, что приводит к гипокалиемии, которая может быть тяжелой.
При обследовании пациента концентрация натрия в плазме может быть низкой или соответствующей нижней границе нормы, несмотря на то, что клинические признаки дегидратации выражены отчетливо. Такое явление может быть обусловлено осмотическим эффектом высоких внеклеточных концентраций глюкозы. В результате данного эффекта происходит разбавление водой, поступающеп из клеток, плазмы с понижением измеряемой концентрации натрия. Тяжелая гиперлипидемия может сопровождаться ложной гипонатриемией. При введении инсулина в клетки поступает глюкоза, за которой в соответствии с осмотическим градиентом следует и вода. Хотя при этом достигается удовлетворительное уменьшение концентрации глюкозы в плазме, явления спутанности сознания или даже коматозное состояние могут оставаться в связи с сохранением гиперосмоляльности плазмы, если уровень натрия в плазме нарастает быстро. Подобные ситуации особенно характерны при введении изоосмолярных или более концентрированных солевых растворов.
При типичном диабетическом кетоацидозе организм может терять от 6 до 7 л воды и по 300—500 ммоль/натрия и калия (каждого). Таким образом, для диабетического кетоацидоза результатами обследования пациентов обычно являются: 1) при клиническом обследовании: а) спутанность сознания и позже кома (гиперосмоляльность); б) усиленное дыхание (ацидоз); в) истощение объема жидкости (осмотический диурез); 2) при исследовании плазмы: а) гипергликемия; б) ацидоз на фоне низкого общего содержания СОг (бикарбонатов); в) нормальная или повышенная концентрация калия; г) варьирующая концентрация натрия; д) концентрированно крови и умеренная уремия; 3) при исследовании мочи: а) глюкозурия и кетонурия в условиях адекватного мочеотделения; б) пнзкий р11 (если нет признаков почечной недостаточности).
Результаты дополнительных исследований. Параллельно изменениям содержания калия в плазме изменяется и концентрация фосфатов. Их уровень может быть низким в течение нескольких суток после выхода больного из состояния диабетической комы. Как в моче, так и в плазме может быть значительно повышена активность амилазы, что не следует обязательно интерпретировать как указание на наличие острого панкреатита. Эти результаты могут быть получены случайно; они не имеют никакого значения для диагностики, прогноза или лечения. Мы упоминаем о них для того, чтобы предостеречь от ошибочной интерпретации.
Гиперосмоляльная бескетонная кома
При диабетическом кетоацидозе всегда есть некоторая гиперосмоляльность, обусловленная гипергликемией, и многие симптомы, в частности кома, по-видимому, связаны именно с гиперосмоляльностью. Однако термин гиперосмоляльная кома (или прекома) обычно используют для обозначения лишь тех состояний, при которых отмечается значительная гипергликемия, но не выраженные кетонемия или ацидоз. (Причина этой различной степени выраженности неясна). Гиперосмоляльная кома чаще встречается у пожилых пациентов. Уровни глюкозы в плазме очень высокие, часто превышающие 50 ммоль/л (900 мг/дл). Возникающая глюкозурия приводит к осмотическому диурезу, сопровождающемуся резким истощением резервов воды и электролитов. Часто развиваются гипернатриемия и уремия, обусловленные преимущественным истощением резервов воды и усугубляющие признаки внеклеточной гиперосмоляльности. Полагают, что кома является результатом развивающейся затем дегидратации клеток головного мозга, которая может также приводить к гипервентиляции легких. Как следствие гипервентиляции возникает респираторный алкалоз, который может вызвать небольшое понижение концентрации бикарбонатов в плазме. Это последнее явление следует отличать от сходного признака метаболического ацидоза.
На с. 52 описано как вычислить осмолярность с той степенью точности, которая достаточна для клинических исследований.
Другие причины комы у больных, страдающих сахарным диабетом
Помимо нарушений обмена веществ, описанных выше, к состоянию комы или спутанности сознания (прекома) у больных диабетом могут приводить гипогликемия, расстройства мозгового кровообращения или причины, не связанные с ними.
Гипогликемия наиболее часто является результатом случайной передозировки инсулина, но может возникать при нарушениях обычного режима питания или после чрезмерной физической нагрузки на фоне обычной дозы инсулина или антидиабетических пероральных лекарственных средств.
Нарушения мозгового кровообращения часто встречаются у больных диабетом, поскольку среди них высока заболеваемость, связанная с поражениями кровеносных сосудов. Эти нарушения мозгового кровообращения могут сопровождаться гипергликемией и гликозурией. Стимуляция дыхательного центра может вызвать усиленное дыхание и, следовательно, респираторный алкалоз с низким содержанием бикарбонатов в плазме. Последнее явление следует отличать от аналогичного симптома метаболического ацндоза. Диагностика основана на клинических наблюдениях.
Принципы лечения диабетической комы
Этот вопрос обсуждается лишь в самых общих чертах. Более подробные сведения можно найти в работах, указанных в конце этой главы. Лечение гипогликемии рассмотрено в гл. IX.
Кетоацидоз. Следует принять энергичные меры для восполнения резервов жидкости и электролитов. Если концентрация натрия в плазме в пределах нормы или снижена, начинают с введения изотонического солевого раствора. Эту процедуру продолжают, если содержание натрия остается в пределах нормы. Необходимо тщательно следить за уровнем натрия в плазме крови, обращая особое внимание на возможность развития гипернатриемип. Если признаки гипернатриемии отмечены, следует вводить гипотонический солевой раствор. В тех случаях, когда ацидоз выражен очень значительно, можно назначить бикарбонаты, но добиваться полной нормализации содержания в плазме крови бикарбонатов не обязательно, так как их уровень быстро возвращается к норме после адекватной терапии с введением жидкостей и инсулина. Следует помнить, что 8% раствор гидрокарбоната натрия резко гиперосмолярен (см. табл. 3) и что быстрое нарастание рН крови может усугубить гипокалиемию. Как только начинается понижение концентрации калия в плазме, следует назначить препараты калия. Показан мониторинг выведения мочи. Если оно снижается, несмотря на адекватную регидратацию, следует с осторожностью назначить жидкости и калий.
Инсулин назначают немедленно. Вводят инсулин внутривенно либо непрерывно, лпбо небольшими, часто повторяющимися дозами.
Факторы, способствующие развитию комы (например, инфекционные заболевания), следует иметь в виду и проводить соответствующее лечение, если они обнаружены.
Систематические наблюдения за содержанием в плазме крови глюкозы, калия и натрия необходимы для оценки характера течения заболевания и для обнаружения развития гипогликемии, гипокалиемии и гипернатриемии. Последняя может задержать как снижение осмбляльности плазмы крови до нормальных величин, так и устранение явлений спутанности сознания или комы.
Гиперосмоляльная кома. Принципы лечения гпперосмоляльнои комы и кетоацидоза сходны. Внезапное уменьшение внеклеточной осмоляльности может принести больше вреда, чем пользы. Особенно важно назначать небольшие дозы инсулина, чтобы медленно снижать содержание глюкозы в плазме крови. Такие пациенты часто очень чувствительны к действию инсулина. Резервы жидкости в организме следует восполнять, вводя гипотонические растворы, но при резко выраженной гипернатриемии и эти процедуры необходимо выполнять с осторожностью.
ГИПОГЛИКЕМИЯ
Согласно определению, термин гипогликемия применяют в тех случаях, когда содержание глюкозы в плазме крови не превышает 2,5 ммоль/л (45 мг/дг). Этот критерий адекватен только при использовании специфического метода измерения содержания тлю' козы и при условии отбора исследуемого материала в сосуд, содержащий ингибитор гликолиза. Низкие величины, полученные при исследовании неправильно собранного материала, нельзя принимать во внимание. Симптомы гипогликемии могут развиться при более высокой концентрации глюкозы, по сравнению с указанной выше, если произошло быстрое понижение повышенного или даже нормального уровня глюкозы в плазме. У некоторых людей симптомы гипогликемии могут отсутствовать даже при концентрации глюкозы, значительно меньшей 2,5 ммоль/л, особенно если снижение содержания глюкозы в плазме происходило постепенно. Как уже обсуждалось выше, метаболизм головного мозга зависит от адекватного поступления глюкозы из крови, причем симптомы гипогликемии и гипоксии мозга сходны. Обморочное состояние, головокружение или ступор могут развиваться быстро, приводят к коме и (в тех случаях, когда лечение не проводилось) к летальному исходу или необратимым поражениям головного мозга. При быстром снижении содержания глюкозы в плазме может наступить фаза повышенной потливости, тахикардии и возбуждения, связанных с секрецией адреналина. Но эта фаза может отсутствовать при постепенном снижении уровня глюкозы или подавлении реактивности вегетативной нервной системы в связи с тем, что пациент принимает (3адреноблокаторы или страдает тяжелыми заболеваниями периферической нервное системы. Уже существующие заболевания головного мозга и расстройства мозгового кровообращения могут усугубить клинические проявления гипогликемии. Быстрая нормализация концентрации глюкозы в плазме имеет существенное значение.
Причины гипогликемии
Удовлетворительной классификации причин гипогликемии не существует, так как не удается четко разграничить выделяемые группы. Практически случаи гипогликемии классифицируют, учитывая данные анамнеза. Особое внимание при этом обращают на принимаемые пациентом лекарственные средства и на взаимосвязь между симптомами и приемами пищи вообще или определенных пищевых продуктов в частности. Обычно на основании этих сведений удается отнести каждый данный случай к одной из двух главных групп: 1) гипогликемия, связанная с голоданием;
2) гипогликемия, не связанная с голоданием.
Гипогликемия, связанная с голоданием. Характерно развитие симптомов в ночное время или рано утром, усугубление клинических проявлений гипогликемии при длительных перерывах между приемами пищи или интенсивной физической нагрузке. Эти факты свидетельствуют об избыточной утилизации глюкозы или о нарушениях функций механизмов, сберегающих глюкозу, или продуцирующих ее.
К числу наиболее важных причин относят: 1) чрезмерно высокое содержание инсулина, обусловленное опухолью или гиперплазией клеток островков поджелудочной железы; 2) недостаточность глюкокортикоидов; 3) тяжелые заболевания печени; 4) опухоли, локализованные вне поджелудочной железы.
Гипогликемия, не связанная с голоданием. В типичных случаях клинические симптомы гипогликемии развиваются на протяжении 5—6 ч после приемов пищи, причем может быть отмечена зависимость между приемами определенных пищевых продуктов или лекарственных средств и признаками гипогликемии. К числу веществ, которые могут провоцировать гипогликемию, относятся: 1) лекарственные средства (особенно инсулин); 2) алкоголь; 3) глюкоза (реактивная гипогликемия); 4) галактоза (в молоке); 5) фруктоза (в пищевых продуктах, содержащих сахарозу); 6) лейцин (аминокислота, содержащаяся в казеине).
Только на основании данных анамнеза не всегда удается четко отграничить провоцирующую гипогликемию от ранних стадий развития гипогликемии, связанной с голоданием.
На протяжении первых нескольких лет жизни проблемы гипогликемии особенно важны и будут рассмотрены нами специально после обсуждения ряда вопросов более общего характера.
Особенности гипогликемии у взрослых
Наблюдаемые симптомы можно связывать с гипогликемией лишь в тех случаях, когда наличие гипогликемии доказано. Это утверждение может показаться излишним, однако известны случаи, когда пациентов подвергали многочисленным тестам с целью дифференциальной диагностики гипогликемии, которой не было, или, что еще хуже, лечили по поводу несуществующей гипогликемии.
В тех случаях, когда наличие гипогликемии доказано, необходимо рассмотреть следующие наиболее важные причины этого явления.
Гипогликемия, вызванная инсулином или другими лекарственными средствами. Эта причина, по-видимому, является наиболее распространенной. Если пациент не вводит врача в заблуждение сознательно, установить, какое именно лекарственное средство вызвало гипогликемию, легко. У больных диабетом гипогликемия может быть результатом случайной передозировки, изменения потребности в инсулине или того, что за введением инсулина не последовал прием пищи. Известны случаи самовведения инсулина с целью самоубийства или привлечения внимания к себе. Использование инсулина как орудия убийства представляется маловероятной возможностью. Производные сульфонилмочевины также могут вызвать гипогликемию, особенно у пожилых людей. Интоксикация салицилатами может усугубить проявления гипогликемии. В некоторых случаях подозрения падали и на другие лекарственные средства, в частности на антигистаминные препараты. Поэтому важным этапом исследования является ознакомление с перечнем лекарственных средств, которыми пользовался пациент.
Гипогликемия, обусловленная экзогенным инсулином, угнетает по механизму обратной связи секрецию Спептида. Результаты соответствующего анализа могут помочь отличить последствия введения инсулина от явлений, обусловленных секрецией эндогенного инсулина, независимо от того, секретирует ли инсулин инсулинома, происходит ли стимуляция островков поджелудочной железы антидиабетическими лекарственными средствами, или же имеются секретирующие инсулин опухоли, локализованные вне поджелудочной железы.
Инсулинома. Инсулинома представляет собой опухоль, состоящую из клеток островков поджелудочной железы. Как и в случаях других опухолей эндокринной системы, секреция гормона ннсулиномой является неадекватной и обычно чрезмерной. Инсулиномы встречаются у лиц любого возраста. Обычно у пациента появляется единичная опухоль доброкачественного характера, но в редких случаях эта опухоль может быть и злокачественной. Возможно наличие множественных опухолей как проявление синдрома множественного аденоматоза эндокринной системы. Опухоль состоит из рклеток, но и другие клетки островков обычно могут быть обнаружены в ней. Параллельно инсулину опухоль секретирует и С-пептид, содержание которого в плазме поэтому неадекватно высокое.
Клинические симптомы могут носить спорадический характер, перемежаясь с бессимптомными периодами. Типично развитие приступов гипогликемии ночью и перед завтраком или их усугубление при значительной физической нагрузке. Первые симптомы заболевания могут быть связаны с изменениями особенностей личности и поведения пациентов, многих из которых направляют к психиатрам.
Гипогликемия, индуцируемая алкоголем. Гипогликемия может развиться за период между 2 и 10 ч после приема внутрь алкоголя, обычно в значительных количествах. Большинство описанных случаев относится к лицам, страдающим хроническим алкоголизмом и находящимся в состоянии голодания или недостаточности питания, но подобные явления могут развиваться и у молодых людей после первого потребления алкоголя. По-видимому, механизм развития гипогликемии заключается в уменьшении продуцирования глюкозы печенью, связанном с угнетением глюконеогенеза в процессе метаболизма алкоголя. Гипогликемия усугубляется натощак или в состоянии голодания, когда глюконеогенез является главным источником глюкозы плазмы. Не имея результатов определения содержания глюкозы в плазме, только на основании клинических данных отличить гипогликемию, индуцированную алкоголем, от алкогольного ступора не всегда возможно. Для лечения могут потребоваться частые повторные внутривенные вливания глюкозы. Воспроизвести гипогликемию путем внутривенных вливаний алкоголя трудно, если пациент не воздерживается от приемов пищи в течение от 12 до 72ч.
Опухоли, локализованные вне поджелудочной железы. Хотя предполагают, что многие типы злокачественных опухолей — карциномы (особенно гепатоцеллюлярные) и саркомы — приводят к развитию гипогликемии, тем не менее обычно она сопровождает опухоли мезодермального происхождения, напоминающие фибросаркомы и локализованные преимущественно в забрюшинном пространстве. Такие опухоли растут медленно и могут достигать больших размеров. Одним из симптомов при этом может быть гипогликемия, механизм развития которой неясен; возможно, это секреция инсулиноподобного соединения или повышенная утилизация глюкозы.
Функциональная (реактивная) гипогликемия (чувствительность к глюкозе). У некоторых лиц развивается симптоматическая гипогликемия через 2—4 ч после еды и нагрузки глюкозой. В очень редких случаях люди при этом теряют сознание. Аналогичную реактивную гипогликемию иногда наблюдают после гастрэктомии, когда быстрое поступление глюкозы в кишечник и быстрое всасывание может стимулировать чрезмерную секрецию инсулипа (один из типов демпингсиндрома).
Истинная реактивная гипогликемия (за исключением наблюдаемой после гастрэктомии), по-видимому, встречается редко, хотя этот диагноз ставят слишком часто.
Причины, связанные с эндокринной системой. При недостаточности надпочечников или гипофиза может быть гипогликемия. В редких случаях она — единственный симптом таких расстройств (см.гл.УиУ!).
Нарушения функции печени. Функциональные резервы печени так велики, что, хотя этот орган играет ключевую роль в поддержании постоянства уровня глюкозы в плазме крови, гипогликемия при заболеваниях печени встречается редко. Исключение составляют очень тяжелые случаи гепатита или некроза печенп, когда поражена вся ткань печени. У этих больных гипогликемия может быть причиной комы. Понимание этого гораздо важнее, чем дифференциальная диагностика гипогликемии.
Гипогликемия у детей
Гипогликемия у детей встречается нередко и имеет важное значение, так как может приводить к необратимым поражениям головного мозга, особенно в течение первых нескольких месяцев жизни. Рассмотрим кратко лишь основные причины гипогликемии у детей.
Гипогликемия новорожденных
У новорожденных низкие концентрации глюкозы в плазме, такие как 2,2 ммоль/л (приблизительно 40 мг/дл) или в течение первых 72 ч жизни 1,7 ммоль/мл (около 30 мл/дл), можно считать соответствующими норме. Часто в этих случаях клинические симптомы гипогликемии отсутствуют, и она продолжается только 24 ч. У недоношенных детей (при массе тела меньше 2,5 кг) уровень глюкозы в плазме в отсутствие клинических проявлений гипогликемии может быть ниже 1,1 ммоль/л (около 20 мг/дл). В этом возрасте признаками гипогликемии являются судороги, дрожание конечностей, приступы удушья с синюшностью. В подобных случаях требуется срочное лечение. Такая симптоматическая гипогликемия может продолжаться неделю. Гипогликемия новорожденных встречается особенно часто:
1) у детей, матери которых страдают диабетом. Если на протяжении беременности плод претерпевает воздействие гипергликемии, происходит гиперплазия клеток островков, вследствие чего развивается гиперинсулинизм. После родов, когда поступление избытка глюкозы из организма матери прекращается, гиперинсулинизм у новорожденного может привести к гипогликемии. Тяжелую гипогликемию отмечают у новорожденных, матерей которых во время беременности лечили производными сульфонилмочевины по поводу диабета. В некоторых группах пациентов частота гипогликемии у новорожденных, матери которых страдали диабетом, составляет 50% и выше. Клинические симптомы гипогликемии у большинства таких детей отсутствуют и представления о значении обнаруживаемых низких концентраций глюкозы в плазме противоречивы. Аналогичная гиперплазия клеток островков и гипогликемия новорожденных может встречаться в сочетании с тяжелым эритробластом плода;
2) у детей, страдавших от недостаточности питания в период внутриутробного развития (например, дети матерей с токсемией или меньшие из пар близнецов). Обычно такие дети малы для своего возраста. На протяжении первой недели жизни у них может обнаруживаться тенденция к развитию гипогликемии, обусловленная, по-видимому, бедностью запасов гликогена в печени. Поскольку большая часть резерва гликогена в печени формируется после 36 нед, преждевременные роды являются фактором, усугубляющим данное патологическое состояние. Ограниченность жировых запасов также ограничивает доступность кетоновых тел как альтернативного источника эноргнп для головного мозга, и у таких детей обычно отмечают клинические признаки гипогликемии.
Гипогликемия в раннем детстве
Вскоре после рождения или после включения в пищевой рацион ребенка молока или сахарозы гипогликемия может быть обусловлена следующими факторами.
Гликогенозы. Недостаточность одного из нескольких ферментов, участвующих в гликогенезе или гликогенолизе, приводит к накоплению нормального или аномального гликогена. При наиболее распространенной из этих заболеваний болезни Гирке имеет место недостаточность глюкозо6фосфатазы. Так как этот фермент необходим для превращения глюкозо6фосфата в глюкозу, гипогликемия развивается натощак. К числу появляющихся в дальнейшем расстройств обмена веществ относятся накопление кетоновых тел и эндогенная гипертриглицеридемия (усиленный липолнз, обусловленный недостаточностью глюкозы в клетках), лактатацидоз (избыточный гликолиз) и гиперурикемия.
Развитие гепатомегалии обусловлено накоплением гликогена.
Диагноз ставится непосредственно на основании доказательства отсутствия этого фермента в образце ткани печени, полученном путем биопсии, или косвенно на основании вывода о недостаточности фермента в связи с отсутствием повышения в крови концентрации глюкозы после введения в организм глюкагона (стимулирующего гликогенолиз). У таких пациентов после внутривенного вливания галактозы или фруктозы, в норме превращающихся в глюкозу, содержание глюкозы в плазме не нарастает, так как образующийся Г6Ф не превращается в глюкозу.
Лечение заключается в назначении частых приемов пищи для поддержания постоянства уровня глюкозы в плазме и предотвращения развития повреждений головного мозга.
Галактоземия. Галактоза необходима для образования цереброзидов, некоторых гликопротеидов и молока во время лактации. Избыток галактозы быстро превращается в глюкозу.
Наиболее распространенная форма галактоземии обусловлена недостаточностью гексозо1фосфатуридилилтрансферазы (ранее известной под названием галактозо1фосфатуридилтрансфераза).
Патологическое состояние становится явным только после того, как в рацион ребенка включают молоко. К числу наиболее важных признаков относятся: рвота и диарея с нарушением роста и развития; гепатомегалия, приводящая к желтухе и циррозу; образование катаракты; задержка умственного развития; повреждение почечных канальцев (синдром Фанкони); гипогликемия.
Поскольку в моче имеется галактоза, реакция с таблетками клинитест положительная. Это явление связано с поступлением. в организм галактозы; его может не быть, если ребенок не получает молока. Повреждение почечных канальцев может приводить к генерализованной аминоацидурии.
Диагноз ставится путем идентификации с помощью хроматографии имеющегося в моче сахара с галактозой и доказательства недостаточности соответствующего фермента в эритроцитах данного ребенка. Последнее определение следует проводить в пуповинной крови всех новорожденных, родные братья или сестры которых страдают галактоземией.
Лечение. Из рациона следует исключить галактозу (молоко и молочные продукты). Эндогенный синтез галактозы (в виде УДФгалактозы) достаточен для удовлетворения пужд организма.
Наследственная непереносимость фруктозы. Это редкая причина гипогликемии. Развитие симптомов начинается после включения в рацион ребенка сахарозы или фруктовых соков. В течение от получаса до 1 ч после поступления в организм фруктозы развиваются симптомы гипогликемии, сопровождаемые тошнотой или рвотой, а также болями в области живота. Отмечают задержку роста и развития, прогрессирующее поражение печени с гепатомегалией, желтухой и асцитом. Может развиться цирроз. Диагноз ставится на основании наличия фруктозурии и гипогликемии после введения фруктозы внутрь или внутривенно. В основе заболевания лежит недостаточность фермента фруктозобисфосфатальдолазы и накопление фруктозо1фосфата. Гипогликемия, по-видимому, обусловлена угнетением гликогенолиза и глюконеогенеза фруктозо1фосфатом.
Гипогликемия в более позднем детском возрасте
Идиопатическая гипогликемия у детей может иметь множественную этиологию. Обычно симптомы развиваются после периодов голодания или заболеваний, сопровождающихся лихорадочным состоянием. Диагноз ставится методом исключения других причин. Часто поражается головной мозг.
В некоторых случаях секретируется избыток инсулина, и дифференциальный диагноз от инсулиномы невозможен.
Чувствительность к лейцину. В течение первых шести месяцев жизни казеин может привести к развитию тяжелой гипогликемии. Это действие казеина обусловлено содержанием в нем аминокислоты лейцина. Чувствительность к лейцину, по-видимому, обусловлена чрезмерной стимуляцией секреции инсулина и часто является наследуемой особенностью. Это состояние представляется самоизлечивающимся, и обычно у детей старше 6 лет оно уже не встречается. Обнаружение гипогликемии на протяжении получаса после нагрузки внутрь лейцином или казеином подтверждает диагноз. Лечение заключается в назначении диеты с низким содержанием лейцина.
У здоровых лиц после нагрузки лейцином не происходит существенного снижения содержания глюкозы в плазме, но некоторые больные с инсулиномои проявляют чувствительность к лейцину.
Кетонная гипогликемия — наиболее частая причина гипогликемии среди детей на 2м году жизни, развивающаяся после периода голодания плп болезни, сопровождающейся лихорадочным состоянием. Эти дети в периоде новорожденное™, как правило, были «маленькими для своего возраста». Развитию гипогликемии предшествует кетонурия (как, например, при голодании), и диагноз можно поставить при переходе на кетогенную диету (содержащую много жиров при низкой калорийности) на 48 ч, в течение которых появляются клинические признаки гипогликемии.
Следует всегда помнить о причинах гипогликемии у взрослых, в частности об инсулиноме.
Лечение при гипогликемии
Гипогликемию следует лечить путем срочного внутривенного вливания по меньшей мере 10% раствора глюкозы (взрослым— 50%) после взятия пробы крови для диагностических целей. В некоторых случаях может оказаться необходимым повторять вливания глюкозы до тех пор, пока не будет установлена причина гипогликемии и проведено ее лечение.
Для лечения инсулиномы рекомендуется, если возможно, ее удаление хирургическим путем. Если такой возможности нет, введение комбинации диазоксида и хлоротиазида может обеспечить поддержание концентрации глюкозы в плазме в пределах нормы.
ЗАКЛЮЧЕНИЕ
1. Глюкоза является наиболее важным компонентом среди углеводов пищевых продуктов.
2. Головной мозг почти полностью зависит от внеклеточной глюкозы как источника энергии, и поддержание постоянства концентрации глюкозы в плазме имеет важное значение для нормального функционирования мозга.
3. После приема содержащей углеводы пищи, избыток глю
козы в печени и в мышцах сохраняется в виде гликогена, а в жировой ткани превращается в жир и сохраняется в таком виде, Эти процессы стимулирует инсулин.
4. Во время голодания в печени (и в почках) распад гликогена приводит к высвобождению глюкозы в кровь; в жировой ткани распад триглицеридов высвобождает как глицерин, который может быть превращен в глюкозу, так и жирные кислоты, метаболизируемые в большинстве тканей, за исключением головного мозга.
5. В печени избыток жирных кислот превращается в кетокислоты. Кетоновые тела могут быть использованы в качестве источника энергии тканями головного мозга и других органов.
6. В тех случаях, когда кетокислоты образуются в избытке по отношению к мощности механизмов гомеостаза, возможно развитие кетоацпдоза.
7. Молочная кислота образуется: при анаэробном гликолизе;
в сокращающихся мышцах (временно); в тканях при гипоксии. В условиях гипоксии печень становится самым важным образующим (но непотребляющим) молочную кислоту органом, что приводит к развитию лактатацидоза.
Лактатацидоз могут вызывать и другие факторы, стимулирующие гликолиз и снижающие утилизацию молочной кислоты. Некоторые лекарственные средства (в частности, бигуаниды) снижают утилизацию молочной кислоты.
8. Сахарный диабет является результатом относительной или абсолютной недостаточности инсулина. Для него характерна гипергликемия, которая может быть прерывистой. При тяжелых формах сахарного диабета усиленный липолиз может вызывать накопление кетоновых тел, а затем ацидоз. Кома, по-видимому, обусловлена гиперосмоляльностью. Как при кетоацидозе, так и при гиперосмоляльной коме происходит сильное истощение резервов воды и электролитов в организме.
9. Гипогликемия может развиваться при голодании. Некоторые лекарственные средства или продукты питания могут вызывать гипогликемию.
10. У взрослых наиболее важная причина гипогликемии в условиях голодания — инсулинома, для диагностики которой необходимо доказать наличие в плазме высокой концентрации инсулина на фоне гипогликемии. Наиболее частая причина гипогликемии — введение инсулина.
11. Факторы, вызывающие гипогликемию у детей разных возрастов, различны. Причиной гипогликемии могут быть многие наследственные аномалии обмена углеводов.
12. Может оказаться необходимым внутривенное введение богатых энергией субстратов в течение длительного периода времени. Глюкоза сводит к минимуму липолиз и кетоацидоз, но может потребоваться сочетать глюкозу с растворами жиров с тем, чтобы обеспечить достаточный запас энергии в адекватном объеме жидкости.
ИССЛЕДОВАНИЯ НАРУШЕНИЙ ОБМЕНА УГЛЕВОДОВ
Исследования при подозрении на сахарный диабет Первоначальное тестирование
Если у больного имеются симптомы тяжелой формы сахарного диабета или гликозурия, а также в тех случаях, когда желательно исключить диагноз сахарного диабета (например, при наличии этого заболевания и у близких родственников больного), возьмите кровь для определения содержания глюкозы в плазме. Обнаружение (по меньшей мере через 2 ч после приема пищи) в одной произвольно взятой пробе крови концентрации глюкозы, превосходящей 11 ммоль/л, в значительной степени подтверждает предположение о наличии диабета, а обнаружение такой концентрации глюкозы в двух пробах крови позволяет поставить диагноз этого заболевания. Однако предпочтительнее взять кровь после голодания в течение по меньшей мере 10 ч, особенно если уже было отмечено отклонение от нормы в одной произвольно взятой пробе крови.
Интерпретация
|
Глюкоза плазмы крови (ммоль/л) |
|
|
После голода |
Произвольная проба |
Норма |
6 и ниже |
|
Диабет |
8 или выше |
11 или выше |
А. Диагноз сахарного диабета считают подтвержденным, если:
1) концентрация глюкозы в плазме крови, взятой натощак, дважды определена как равная 8 ммоль/л или выше; или 2) концентрация глюкозы в плазме крови, взятой произвольно, дважды определена равной 11 ммоль/л или выше; или 3) установлено, что концентрация глюкозы в плазме крови, взятой натощак, превышает 8 ммоль/л, а в плазме крови, взятой произвольно, превышает 11 ммоль/л.
Б. Результаты исследований крови, взятой произвольно, менее надежны при исключении, чем при подтверждении диагноза сахарного диабета. Этот диагноз считают исключенным, если в плазме крови, взятой после периода голодания, концентрация глюкозы не менее чем дважды была найдена не превышающей 6 ммоль/л.
В. Если (и только при этом условии) в любой из взятых натощак проб крови обнаружены величины концентрации глюкозы в пределах от 6 до 8 ммоль/л или в произвольно взятых пробах найдены концентрации глюкозы от 8 до 11 ммоль/л, приступайте к проведению теста на толерантность к глюкозе, назначая ее внутрь.
Тест на толерантность к глюкозе, принимаемой внутрь
Если через 2 ч после приема внутрь 75 г глюкозы (или эквивалентной дозы содержащих глюкозу продуктов) концентрация глюкозы в плазме крови равна 8 ммоль/л или ниже, то это свидетельствует об отсутствии диабета. В этих же условиях концентрация глюкозы 11 ммоль/л или выше указывает на наличие диабета, тогда как концентрация глюкозы от 8 до 11 ммоль/л свидетельствует о нарушенной толерантности к глюкозе.
Случайное обнаружение гликозурии или гипергликемии может служить основанием для предположения о наличии сахарного диабета у пациента, не имеющего клинических признаков этого заболевания. Если у такого пациента через 2 ч после нагрузки стандартной дозой глюкозы концентрация глюкозьт в плазме превышает 11 ммоль/л, то такой результат следует подтвердить, прежде чем делать окончательный вывод о диагнозе.
Обследование больного диабетом, находящегося в коматозном состоянии
Больной, страдающий диабетом, может быть в коматозном состоянии в связи с гипергликемией, гипогликемией или с другими причинами, указанными в табл. 18.
После тщательного клинического обследования пациента сделайте следующее:
1. Предупредите лабораторию о предстоящем взятии образцов для анализов и организуйте срочную доставку этого материала в лабораторию с тем, чтобы свести к минимуму задержки при выполнении анализов.
2. Прежде всего возьмите кровь для определения содержания в плазме глюкозы, калия и натрия. Затем возьмите кровь для определения Tcog плазмы и/или рН и Рсо» артериальной крови.
Повторная пункция артерии нежелательна и не нужна. Если первоначально измеряют рН артериальной крови, Тсод плазмы можно рассчитать, когда окажется необходимым мониторинг кислотнощелочного равновесия.
3. Исследуйте пробу мочи на содержание глюкозы и кетоновых тел. При диагностике гипергликемии не следует полагаться только на результаты исследования мочи. В течение некоторого времени моча могла находиться в мочевом пузыре, и результаты ее анализа могут соответствовать более ранним по времени и значительно отличающимся по величине уровням исследуемых компонентов в плазме крови.
4. Если необходимо быстро оценить уровень глюкозы в крови с помощью пропитанной соответствующими реагентами полоски фильтровальной бумаги (например, в связи с тем, что лаборатория находится так далеко, что получение точных результатов может быть задержано), то следует обратить особое внимание на соблюдение режима хранения реагентов и точность выполнения инструкции по их использованию с тем, чтобы избежать получения неверных результатов, что может привести к опасным последствиям.
5. Если на основании клинических исследований или теста с использованием пропитанных реагентами полосок фильтровальной бумаги предполагают гипогликемию, больному следует назначить глюкозу, не ожидая получения окончательных результатов из лаборатории. Дать глюкозу больному диабетом менее опасно, чем назначить инсулин пациенту, у которого была ошибочно диагностирована гипогликемия (на основании, например, результатов теста, проведенного с применением негодных реагентных полосок).
Таким образом, назначение терапии при диабетической коме должно быть основано на клиническом диагнозе. Пробы крови должны быть на
Таблица 18. Результаты лабораторных исследований при коме у больных сахарным диабетом
Диагноз |
Клинические симптомы |
Плазма крови |
Моча |
||
глюкоза |
[НСО-3] |
глюкоза |
кетоновые тела |
||
Кетоацидоз
|
Дегидратация Гипервентиляция |
Повышена |
Понижена
|
+++
|
+++
|
Гиперосмоляльная кома
|
Дегидратация Возможна гипервентиляция |
Резко повышена |
Н или несколько понижена
|
+++
|
Отсут.
|
Гипогликемия |
Неспецифичные |
Понижена
|
Н
|
Отсут.
|
Отсут.
|
Нарушение мозгового кровообращения
|
Неврологические Возможна гипервентиляция |
Может быть повышена
|
Может быть повышена
|
Может быть +
|
Обычно отсут.
|
правлены в лабораторию немедленно, но никогда не следует медлить с началом лечения из-за того, что результаты анализов еще не получены. Необходимо с осторожностью интерпретировать результаты предварительных экспрессанализов.
Исследования при гипогликемии
У больного с доказанной гипогликемией наиболее важный тест — определение содержания инсулина в плазме крови, когда концентрация глюкозы в ней низка. На основании результатов этого теста можно отличить от других причин гипогликемии случаи введения экзогенного или продуцирсь вания эндогенного инсулина. Среди последних наиболее серьезны случаи инсулиномы. Если уровни инсулина в плазме крови неадекватно высокие и остаются какието сомнения, то могут помочь результаты количественного анализа Спептида. Высокая концентрация Спептида в плазме указывает на возможность секреции эндогенного инсулина (в частности, секреции, обусловленной стимуляцией поджелудочной железы под влиянием производных сульфонилмочевины). Если в подобной ситуации обнаружить Спептид в плазме не удается, предполагают, что имело место введение экзогенного ивсулина.
1. Если пациент находится в состоянии гипогликемии, то, прежде чем назначить глюкозу, возьмите у него кровь для определения содержания глюкозы, инсулина и Спептида. Плазму, предназначенную для выполнения двух последних анализов, следует сохранять до тех пор, пока наличие гипогликемии не будет доказано (см. ниже). Выполнение этого этапа работы может значительно сократить программу дальнейших исследований.
2. Нередки случаи, когда на обследования направляют пациентов, у которых в прошлом была подтвержденная документально или предполагаемая гипогликемия.
В этих случаях следует провести полное обследование, обращая особое внимание на следующие моменты:
а) соотношение во времени между приступами гипогликемии и приемами пищи (реактивная гипогликемия);
Таблица 19. Результаты определения содержания в плазме инсулина и Спептида во время гипогликемии (спонтанной или вызванной длительным голоданием)

б) прием внутрь лекарственных средств (особенно антидиабетических) и алкоголя. Отсутствие соответствующих указаний в истории болезни не позволяет исключить эти моменты, поскольку пациенты могут скрывать такие сведения;
в) возможность наличия гипофункции коры надпочечников или гипофиза. Если такая возможность представляется реальной, проведите исследование, как описано в гл. VII.;
г) возможность наличия опухоли, локализованной вне поджелудочной железы.
3. В тех случаях, когда ни одну из причин идентифицировать не удается, следует попытаться вызвать гипогликемию путем голодания (до 72 ч, если необходимо), и даже сочетая его с физической нагрузкой, проводимои под тщательным врачебным контролем. Для определения содержания глюкозы и инсулина следует взять кровь утром натощак (после голодания в течение ночи), а затем повторно с интервалами в 1 ч немедленно определить концентрацию глюкозы. Если обнаруживают развитие гипогликемии, проведение теста следует прекратить.
Если в этих условиях вызвать гипогликемию не удается, то предположение о возможном значении эндогенного гиперинсулинизма как причине наблюдаемых симптомов, становится маловероятным.
4. В пробе крови, взятой в то время, когда наличие гипогликемии доказано, следует определить содержание инсулина. Если предполагают, что введение инсулина имело место, следует определить также содержание Спептида.
В табл. 19 обобщены принципы интерпретации получаемых результатов. 5. Если результаты определений содержания глюкозы и инсулина натощак неоднозначны, можно проделать тест на угнетающее действие инсулина. Гипогликемия, вызванная внутривенным введением инсулина, должна угнетать эндогенную секрецию инсулина и Спептида. Отсутствие снижения в этих условиях уровня Спептида подтверждает предположение об автономной секреции инсулина, обусловливаемой обычно наличием инсулиномы.
Определение содержания глюкозы в плазме или в цельной крови
Содержание глюкозы можно оценить с помощью ферментативных методов, специфичных для данного представителя Сахаров, или путем измерения общего уровня восстанавливающих соединений. С помощью методов этого второго типа могут быть получены завышенные (на 0,3—1,1 ммоль/л и более) данные, поскольку в исследуемых объектах, помимо глюкозы, имеются и другие восстанавливающие вещества. В процентном отношении наибольшая ошибка получается при измерении низких концентраций глюкозы. В таких ситуациях эта ошибка может «маскировать» гипогликемию. Важно знать, каким именно методом пользуются в Вашей лаборатории.
Поступление в клетки глюкозы зависит от ее внеклеточной концентрации, о которой можно судить по содержанию глюкозы в плазме. Благодаря процессам обмена веществ внутриклеточная концентрация глюкозы поддерживается на низком уровне; поэтому включение в исследуемый материал эритроцитов разбавляет плазму, приводя к получению результатов, заниженных на 10—15% по сравнению с данными, характерными для плазмы или сыворотки крови (в зависимости от показателей гематокрита). На этом основании считают желательным исследовать именно плазму крови, но иногда используют и цельную кровь.
Как цельную кровь, так и плазму необходимо либо исследовать немедленно, либо смешать с ингибитором гликолиза. Поскольку в результате реакций метаболизма глюкозы, протекающих in vitro в присутствии клеточных элементов крови, анализ даст заниженные величины концентрации глюкозы, в пробы вводят наряду с антикоагулянтом фторид или йодацетат (в качестве ингибиторов гликолыза).
Для мониторинга глюкозы в домашних условиях используют капиллярную кровь, взятую из пальца. При исследовании таких образцов обычно получают результаты, являющиеся промежуточными, по сравнению с величинами, характерными для цельной крови и плазмы венозной крови.
Если нет других указаний, данные о содержании глюкозы, приводимые в этой книге, получены с помощью специфических для определения глюкозы методов в пробах с плазмой венозной крови.
Глюкозурия
Лучший метод обнаружения глюкозурии — использование пропитанных реагентами полосок фильтровальной бумаги, таких как клинистикс. Инструкция по их применению прилагается к реагентным полоскам. Клинистикс позволяет обнаружить приблизительно 5,6 ммоль/л (100 мг/дл) глюкозы в моче, но он не пригоден для проведения относительно точных измерений, которые требуются при наблюдении за ходом лечения диабета. Концентрация глюкозы в моче здоровых лиц варьирует от 0,1 до 0,8 ммоль/л (1—15 мг/дл).
Гликозурия может быть обусловлена сахарным диабетом, внутривенным вливанием глюкозы, почечной гликозурией.
При нормальном содержании в плазме глюкоза может быть в моче. Это явление, обусловленное низким почечным порогом для глюкозы, возможно при беременности или при имеющем обычно доброкачественный характер врожденном (аутосомнодоминантном) состоянии. Оно также может быть при генерализованной недостаточности проксимальных отделов почечных канальцев (синдром Фанкони). Результаты повторных определений содержания глюкозы в ряде проб крови и мочи могут помочь отличить этот синдром от сахарного диабета.
При анализах можно получить ложные отрицательные результаты, если моча содержит большие количества аскорбиновой кислоты, например, после приема терапевтических доз этого витамина или введения тетрациклинов, препараты которых содержат аскорбиновую кислоту в качестве консерванта.
Ложноположительные результаты можно получить, если сосуд, в который собирали мочу, был загрязнен поверхностноактивными веществами (детергентами).
Восстанавливающие вещества
Клинистикс содержит фермепт глюкозооксидазу, он специфичен для глюкозы и применяется с целью обнаружения глюкозурии. Клинитест дает положительный ответ с любым восстанавливающим веществом. Этот полуколичественный тест дает результаты, имеющие важное значение при наблюдении за ходом лечения диабета, тогда как клинистикс для этих целей неудовлетворителен. При скрининге мочи новорожденных и маленьких детей следует пользоваться клинитестом, учитывая важное диагностическое значение отличающихся от глюкозы восстанавливающих веществ (например, галактозы) у детей этого возраста.
Таблетки клинитест следует применять, как указано в инструкции. Они обладают токсическим действием и требуют осторожного обращения. По сравнению с клинистиксом этот тест менее чувствителен, но при количественной оценке дает более точные результаты.
Причины положительной реакции при клинптесте. Наиболее важными причинами положительной реакции при клинитесте является наличие в моче следующих соединений: глюкоды, глюкурпната (часто), лактозы (часто при беременности), фруктозы, галактозы, пентоз, гомогентизиновой кислоты (редко).
При наличии в моче высоких концентраций уратов или креатинина возможен слабый восстанавливающий эффект.
У взрослых положительная реакция при клинитесте в большинстве случаев обусловлена наличием в моче глюкозы. Тест с клинистиксом подтвердит наличие или отсутствие глюкозы. Отличающиеся от глюкозы восстанавливающие вещества далее идентифицируют при помощи хроматографии или специфических тестов.
Значение получаемых результатов может быть различным в зависимости от природы восстанавливающих веществ. Глюкоза (см. с. 234—235).
Глюкуронаты. Многие лекарственные средства (например, салицилаты) и их метаболиты экскретируются с мочой после соединения в печени с глюкуроновой кислотой. Такие глюкуронаты, обладающие свойствами восстановителей, относительно часто встречаются в моче.
Галактоза. Галактозу обнаруживают в моче при галактоземии. Фруктоза. Фруктоза может появиться в моче после приемов внутрь большего количества сахара или фруктов, но обычно фруктозурия бывает при двух редких врожденных аномалиях обмена веществ, наследуемых по аутосомнорецессивному типу.
Идиопатическая фруктозурия, обнаруживаемая почти исключительно у лиц еврейской национальности, не является патологическим состоянием.
Наследственное нарушение толерантности по отношению к фруктозе представляет собой серьезное заболевание, характеризуемое гипогликемией, которая может привести к смерти в раннем детстве.
Лактоза. Лактозурия может развиться в поздние сроки беременности и во время лактации, а также при врожденной недостаточности лактазы.
Пентозы. Пентозурия встречается очень редко. Она может быть при следующих состояниях: 1) алиментарная пентозурия, наблюдаемая после употребления в пищу чрезмерных количеств вишен, винограда, фруктов. Экскретируемые пентозы являются арабинозой и ксилозой; 2) идиопатическая пентозурия — редкая, наследуемая по рецессивному типу аномалия, характеризуемая экскрецией ксилулозы, что обусловлено блокированием метаболизма глюкуроновой кислоты. Эта аномалия обычно обнаруживается у лиц еврейской национальности и не сопровождается развитием какоголибо заболевания.
Гомогентизиновая кислота. Гомогентизиновая кислота появляется в моче при редком врожденном нарушении обмена веществ — алкаптонурии. Обычно о наличии в моче гомогентизиновой кислоты свидетельствует образование темного осадка.
Кетонурия
Простые тесты, применяемые при исследовании мочи па наличие кетоновых тел, позволяют, как правило, обнаружить ацетоацетат, поскольку чувствительность используемых реагентов к ацетону ниже, чем их чувствительность к ацетоацетату, который встречается в моче в более высоких концентрациях, чем ацетон. Содержание (3оксибутирата не определяют.
Тест Ротера. К 5 мл мочи добавляют до получения насыщенного раствора смесь порошкообразных сульфата аммония и нитропруссида натрия. Затем добавляют 1—2 мл концентрированного аммиака и перемешивают. Пурпурнокрасная окраска проб указывает на наличие в них ацетоацетата (или ацетона).
Кетостикс и ацетест представляют собой, соответственно, полоски фильтровальной бумаги и таблетки, содержащие реагенты, используемые для проведения теста Ротера. К реагентам прилагаются инструкции по их применению. Ими более удобно пользоваться.
При помощи теста Ротера обнаруживают приблизительно 0,5 ммоль/л (5 мг/дл) ацетоацетата, тогда как тест, проводимый с применением таблеток, несколько мспсо чувствителен (10—20 мг/лл). С помощью этих методов можно обнаружить кетонурию после голодания в течение нескольких часов. В некоторых случаях цветные реакции, напоминающие реакцию с ацетоацетатом, но неидентичные ей, могут давать такие производные фталеина, как фенолфталеин или бромсульфофталеин (БСФ).
ПРАВИЛА ПРОВЕДЕНИЯ ТЕСТОВ
Прежде чем приступать к проведению этих тестов, следует установить контакт с сотрудниками лаборатории, поскольку в различных лабораториях правила тестирования могут варьировать.
Тесты на толерантность к глюкозе Тест на толерантность к глюкозе, принимаемой внутрь
На с. 232 обсуждаются показания к проведению теста на толерантность к глюкозе и рассмотрена интерпретация получаемых результатов. Ниже мы даем только описание процедуры теста.
1. Пациент голодает в течение ночи (не менее 10, но не более 16 ч), Разрешается пить воду, но не другие напитки.
2. Берут натощак пробу крови для определения содержания глюкозы.
3. Дают принять эквивалент 75 г безводной глюкозы (детям 1,75 г/ю массы тела, максимально 75 г). Раствор 75 г глюкозы в 300 мл воды гиперосмолярен и может не только вызвать тошноту, а иногда рвоту и диарею, но и из-за замедленного всасывания повлиять на результаты тестирования. Поэтому чаще пациентам дают раствор, содержащий смесь глюкозы и олигосахаридов, которые хотя и превращаются в глюкозу в щеточной кайме клеток слизистой оболочки кишечника, но обладают благодаря большей моле. кулярной массе менее выраженным осмотическим эффектом, чем глюкоза, Пациенту следует выпить этот раствор в течение 5 минут.
4. Последующие пробы крови для определения содержания глюкозы берут через 1 и 2 ч. В период проведения теста пациент должен находиться в состоянии покоя. Курение запрещается. Содержание глюкозы определяют в плазме венозной крови с помощью специфичного для глюкозы ферментативного метода.
Факторы, влияющие на результаты ТТГ
Предшествующая диета. Нет необходимости в специальных ограничениях питания, если пациент был на обычной диете в течение 3—4 дней. Однако, если тест проводят после периода, когда содержание углеводов в диете было ограничено (как, например, при разгрузочной диете), толерантность к глюкозе может быть изменена по сравнению с нормой. По-видимому, причиной этого феномена является благоприятствующая глюконеогенезу адаптация обмена веществ к состоянию частичного голодания. Если результаты тестирования указывают на небольшое отклонение от нормы, следует повторить тест после соответствующей нормализации диеты.
Время суток. Как правило, тесты на толерантность к глюкозе проводят в утренние часы, и цитируемые данные относятся именно к этому времени суток. Доказано, что при проведении тестов после полудня отмечают более высокие величины концентрации глюкозы в плазме и что общепринятые нормативы могут оказаться неприменимыми. Это явление может быть обусловлено суточным ритмом вариаций реактивности клеток островков поджелудочной железы.
Состояние здоровья. Тест на толерантность к глюкозе не следует проводить, если пациент был болен или соблюдал постельный режим в течение предшествующих двух недель.
Лекарственные средства. Такие средства, как стероиды, пероральные контрацептивы и некоторые диуротики, могут ухудшить толерантность к глюкозе.
Тесты на гипогликемию
Тест на угнетающий эффект инсулина. 1. Пациент должен голодать 14— 16 ч (с вечера до утра),, чтобы ответ на инсулин был адекватным. Разрешены только небольшие количества воды.
2. Введите пациенту внутривенно постоянную канюлю и проводите непрерывное медленное вливание раствора цитрата натрия или физиологическою раствора, содержащего гепарин.
3. Возьмите пробы крови натощак для определения содержания глюкозы и Спсптида.
4. Введите внутривенно растворимый инсулин (0,15 ЕД/кг массы тела).
5. Возьмите пробы крови для определения содержания глюкозы и Спептида через 30, 60, 90, 120 и 150 мин после введения инсулина.
Примечание. 1) Необходимо соблюдать предосторожности, указанные на стр. 181; 2) При наличии клинических показаний можно также определить содержание кортизола для оценки функций системы гипоталамус—гипофиз— надпочечники.
Интерпретация. У здоровых лиц содержание Спептида в плазме снижается более чем на 50%. Этого не происходит в большинстве случаев инсулиномы.
Принципы парентерального питания
Принципы, которые мы обсуждали в начале этой главы, имеют важное значение при проведении парентерального питания. Более подробные сведения имеются в работе, цитируемой в конце этого раздела.
Распад углеводов, жиров, а также, хотя и в меньшей степени, углеродных цепей некоторых аминокислот обеспечивает организм необходимой энергией путем сопряжения разрыва богатых энергией связей с синтезом АТФ. Некоторые входившие в состав этих соединений элементы (углерод, водород и кислород) выводятся из организма в виде двуокиси углерода и воды. В виде тепла здоровый мужчина теряет за сутки приблизительно 8400 кДж (2000 ккал) энергии. Обычно эти потери сбалансированы поступлением в организм с продуктами питания эквивалентных количеств углеводов, жиров и белков. Если процессы выведения преобладают над процессами поступления, происходит истощение энергетических резервов. Когда эти резервы истощены, такие структурные компоненты, как белки клеток и мышцы, могут быть использованы для извлечения энергии.
У больных энергетические потребности могут быть значительно выше, чем у здоровых. Однако у больного пища, поступающая при еде, не всегда может удовлетворить (полностью или частично) потребности организма в питании.
Кратковременный курс парентерального питания (в течение дней)
В организме человека достаточного питания имеется резерв энергии в виде гликогена печени, которого достаточно по меньшей мере на сутки. Этот резерв будет восполнен, как только он поест. Во время такого краткосрочного голодания источником энергии служат углеводы, а также жиры. кетоацидоз обычно незначительный. Необходимо лишь поддерживать баланс электролитов и жидкости в организме, например, непосредственно после хирургических операций или во время острых нарушений функций желудочнокишечного тракта. Хотя литр 5% глюкозы (декстрозы) содержит 850 кДж (205 ккал), видимо, нет необходимости назначать даже это, и, безусловно, не вся вводимая жидкость должна быть представлена таким раствором.
Если имеются основания считать, что за этой так называемой катаболической фазой последует быстрое выздоровление, то во внутривенных вливаниях аминокислот нет необходимости. Распад белков в значительной степени обусловлен индуцированной стрессом (иногда связанным с повреждением тканей) секрецией кортизола и азотистые соединения, преимущественно в виде мочевины, экскретируется с мочой. При этом организм не имеет возможности эффективно использовать вводимые азотистые соединения, пока причинные факторы, вызывающие возникновение отрицательного азотистого баланса, не устранены. Более того, кратковременные потери азотистых соединений будут восполнены, когда пациент начнет принимать пищу. По аналогичным причинам попытки восполнения потерь других компонентов клетки в течение катаболической фазы неэффективны.
Курс парентерального питания средней продолжительности (в течение недель)
Если планируется продлить голодание, следует сразу же приступить к проведению парентерального питания.
Резервы гликогена в печени относительно невелики, и после того как они исчерпаны, источником энергии служат почти исключительно триглицериды. На этом этапе важной проблемой может стать кетоацидоз, если не обеспечить организм углеводами или субстратами глюконеогенеза. Кроме того, следует обеспечить поступление энергетических субстратов в количе, ствах, необходимых хотя бы для поддержания баланса и восполнения запасов гликогена в печени. Если нет возможности вводить указанное питание в организм через назогастральный зонд, необходимо вливать питательные вещества внутривенно (полное парентеральное питание). Только для того, чтобы обеспечить ежесуточные энергетические потребности на уровне нормы, потребуется 10 л 5% глюкозы. Для поддержания энергетического баланса в организме больного человека необходим еще больший объем раствора глюкозы. Вводить внутривенно такие большие объемы жидкости невозможно, и поэтому нужны более концентрированные растворы энергетических субстратов.
Например, 40% раствор глюкозы содержит 6800 кДж/л. Однако этот раствор очень гиперосмолярен и поэтому оказывает раздражающее действие на вены, что приводит к местному тромбообразованию. Эту проблему можно было бы решить, вводя центральный венозный катетер, через который жид. кость могла бы поступать к месту назначения с большей скоростью. Но процедура введения такого катетера относительно трудна технически и связана с повышенной опасностью инфицирования. Тяжелое заболевание может привести к некоторой резистентности к действию инсулина, и утилизация таких больших количеств глюкозы может быть неэффективной, если не введен экзогенный инсулин; при высокой внеклеточной концентрации глюкозы происходит ее выведение с мочой и может развиться опасная гиперосмолярность. Чтобы обеспечить удовлетворительный контроль за ходом процесса, необходимо часто применять мониторинг содержания глюкозы и плазме крови.
Жиры можно использовать в дополнение к внутривенным вливаниям глюкозы. Так, 10% интралипид (эмульсия масла соевых бобов) содержит 4620 кДж/л и даже в виде 20% раствора настолько мало гиперосмолярен, что его можно вводить в периферическую вену. Имеющиеся в этом препарате частицы жира по размеру и характеру превращений в процессах обмена веществ сходны с хиломикронами. Если на протяжении суток обеспечить поступление в организм с постоянной скоростью некоторого количества угле. водов, то риск развития опасного кетоацидоза сводится к минимуму. При значительной липемии может быть затруднено лабораторное исследование плазмы крови, но этого легко избежать, если перед взятием крови в течение несколько часов вводить растворы, не содержащие липидов. Если, несмотря на принятие таких мер, липемия сохраняется, следует снизить скорость внутривенного вливания, поскольку организм пациента не в состоянии метаболпзировать полностью вводимые жировые компоненты.
Применение углеводов и жиров, сводя к минимуму использование аминокислот в процессах глюконеогенеза, уменьшает экскрецию азотистых соединений с мочой. Однако в течение каждых суток организм всегда теряет некоторое количество азотистых соединений, и если эти потери не восполнять, процесс выздоровления может быть замедленным, восприимчивость к инфекционным заболеваниям повышенной и, наконец, возможны значительная убыль массы мышечной ткани и остеопороз. Каждому пациенту, который в течение длительного времени не в состоянии принимать пищу, необходимо внутривенно вводить смеси, содержащие незаменимые аминокислоты. При такой заместительной терапии можно руководствоваться результатами определений содержания азота мочевины в суточной моче (если почечные клубочки функционируют нормально), поскольку основная масса пяотл выводится из от)гэ.пизм?, с мочой в ЕЕ40 азота мочсвппы. Одна?''0 в тех случаях, когда преобладают процессы регенерации тканей, утилизация аминокислот повышена (анаболическая фаза). При этом может произойти резкое снижение экскреции азотистых соединений с мочой, но необходимое для обеспечения максимальной скорости регенерации количество азотистых соединений может значительно превосходить их количество, задерживаемое в организме. О начале анаболической фазы свидетельствует относительное улучшение общего самочувствия пациента и увеличение массы его тела.
Состав некоторых растворов, применяемых для парентерального питания, приведен на с. 77.
Длительный курс парентерального питания (в течение месяцев)
При длительном парентеральном питании рекомендуются добавки витаминов (наряду с компонентами, указанными выше). При адекватном поступлении в организм витамина D назначать кальций приходится в редких случаях, так как уменьшение содержания кальция в плазме обычно обусловлено понижением уровня связанной с белком фракции (а не ионизированной). Может возникнуть необходимость в добавках магния, тогда его включают в состав некоторых растворов аминокислот.
Во время длительной болезни распад тканей ведет к потере таких внутриклеточных компонентов, как фосфаты и некоторые металлы, встречающиеся в следовых концентрациях (например, цинк и медь). Может оказаться нужным добавление фосфатов к растворам, вводимым внутривенно.
С мочой выводится много встречающихся в следовых концентрациях металлов. Во время катаболической фазы количественно экскретируются все парентерально вводимые металлы, но, когда преобладает анаболизм, их экскреция снижается. При очень длительном парентеральном питании во время анаболической фазы может развиться недостаточность этих металлов, что иногда замедляет увеличение массы тела, если не вводить их дополнительно. В работе, ссылку на которую мы приводим, имеется более подробное обсуждение этого спорного вопроса.
Баланс жидкости и электролитов следует контролировать постоянно, как это описано в гл. II и III. Почти всегда необходимы добавки калия, особенно во время фазы анаболизма.
ГЛАВАХ
