
4 курс / Дерматовенерология / Клиническая_дерматология_и_венерология_2019_03
.pdfВ помощь практическому врачу |
Guidelines for practitioner |
Участие авторов:
Концепция исследования: Пампура А.Н. Сбор и обработка материала: Варламов Е.Е. Написание текста: Варламов Е.Е. Редактирование: Пампура А.Н.
Authors’ contributions:
The concept of the study: Pampura A.N. Collecting and interpreting the data: Varlamov E.E. Drafting the manuscript: Varlamov E.E.
Revising the manuscript: Pampura A.N.
Авторы заявляют об отсутствии конфликта интересов. |
The authors declare no conflict of interest. |
ЛИТЕРАТУРА/REFERENCES
1.Van der Hulst A, Klip H and Brand P. Risk of developing asthma in young children with atopic eczema: A systematic review. J Allergy Clin Immunol. 2007;120(3):565-569.
https://doi.org/10.1016/j.jaci.2007.05.042
2.Katayama I, Aihara M, Ohya Y, Saeki H, Shimojo N, Shoji S, Taniguchi M, Yamada H. Japanese guidelines for atopic dermatitis 2017. Allerg Int. 2017; 66(2):230-247.
https://doi.org/10.1016/j.alit.2016.12.003
3.Hjuler K, Böttcher M, Vestergaard C, Deleuran M, Raaby L, Botker H, Iversen L, Kragballe K. Increased prevalence of coronary artery disease in severe psoriasis and severe atopic dermatitis. Am J Med. 2015;128(12):13251334.e2.
https://doi.org/10.1016/j.amjmed.2015.05.041
4.Silverberg J, Becker L, Kwasny M, Menter A, Cordoro K, Paller A. Central obesity and high blood pressure in pediatric patients with atopic dermatitis. JAMA Dermatol. 2015;151(2):144. https://doi.org/10.1001/jamadermatol.2014.3059
5.Drucker A, Li W, Cho E, Li T, Sun Q, Camargo C, Qureshi A. Atopic dermatitis is not independently associated with nonfatal myocardial infarction or stroke among US women. Allergy. 2016;71(10):1496-1500. https://doi.org/10.1111/all.12957
6.Standl M, Tesch F, Baurecht H, Rodríguez E, Müller-Nurasyid M, Gieger C, Peters A, Wang-Sattler R, Prehn C, Adamski J, Kronenberg F, Schulz H, Koletzko S, Schikowski T, von Berg A, Lehmann I, Berdel D, Heinrich J, Schmitt J, Weidinger S. Association of atopic dermatitis with cardiovascular risk factors and diseases. J Investigat Dermatol. 2017;137(5):1074-1081. https://doi.org/10.1016/j.jid.2016.11.031
7.Su VY, Chen TJ, Yeh CM, Chou KT, Hung MH, Chu SY, Su KC, Chang YS, Lin YH, Liu CJ. Atopic dermatitis and risk of ischemic stroke: A nationwide population-based study. Ann Med. 2014;46(2):84-89. https://doi.org/10.3109/07853890.2013.870018
8.Silverberg J. Association between adult atopic dermatitis, cardiovascular disease, and increased heart attacks in three population-based studies. Allergy. 2015;70(10):1300-1308.
https://doi.org/10.1111/all.12685
9.Strom M, Silverberg J. Associations of physical activity and sedentary behavior with atopic disease in United States children. J Pediat. 2016;174:247253.e3.
https://doi.org/10.1016/j.jpeds.2016.03.063
10.Linos E, Raine T, Alonso A, Michaud D. Atopy and risk of brain tumors: a meta-analysis. J Nation Cancer Institute. 2007;99(20):1544-1550. https://doi.org/10.1093/jnci/djm170
11.Deckert S, Kopkow C, Schmitt J. Nonallergic comorbidities of atopic eczema: an overview of systematic reviews. Allergy. 2013;69(1):37-45. https://doi.org/10.1111/all.12246
12.Linabery A, Jurek A, Duval S, Ross J. The association between atopy and childhood/adolescent leukemia: a meta-analysis. Am J Epidemiol. 2010; 171(7):749-764.
https://doi.org/10.1093/aje/kwq004
13.Wang H, Rothenbacher D, Löw M, Stegmaier C, Brenner H, Diepgen T. Atopic diseases, immunoglobulin E and risk of cancer of the prostate, breast, lung and colorectum. Int J Cancer. 2006;119(3):695-701. https://doi.org/10.1002/ijc.21883
14.Jo S, Kim TJ, Lee H, Min YW, Min BH, Lee JH, Son HJ, Rhee PL, Baek SY, Kim SW, Kim JJ. Associations between atopic dermatitis and risk of gastric cancer: a nationwide population-based study. Korean J Gastroenterol. 2018;71(1):38-44.
https://doi.org/10.4166/kjg.2018.71.1.38
15.Arana A, Wentworth C, Fernández-Vidaurre C, Schlienger R, Conde E, Arellano F. Incidence of cancer in the general population and in patients with
or without atopic dermatitis in the U.K. Br J Dermatol. 2010;163(5):10361043.
https://doi.org/10.1111/j.1365-2133.2010.09887.x
16.Arellano F, Arana A, Wentworth C, Fernández-Vidaurre C, Schlienger R, Conde E. Lymphoma among patients with atopic dermatitis and/or treated with topical immunosuppressants in the United Kingdom. J Allergy Clin Immunol. 2009;123(5):1111-1116.e13. https://doi.org/10.1016/j.jaci.2009.02.028
17.Chockalingam R, Downing C, Tyring S. Cutaneous Squamous Cell Carcinomas in Organ Transplant Recipients. J Clin Med. 2015;4(6):1229-1239. https://doi.org/10.3390/jcm4061229
18.Luger T, Boguniewicz M, Carr W, Cork M, Deleuran M, Eichenfield L, Eigenmann P, Fölster-Holst R, Gelmetti C, Gollnick H, Hamelmann E, Hebert AA, Muraro A, Oranje AP, Paller AS, Paul C, Puig L, Ring J, Siegfried E, Spergel JM, Stingl G, Taieb A, Torrelo A, Werfel T, Wahn U. Pimecrolimus in atopic dermatitis: Consensus on safety and the need to allow use in infants. Pediatr Allerg Immunol. 2015;26(4):306-315. https://doi.org/10.1111/pai.12331
19.Cardwell C, Shields M, Carson D, Patterson C. A meta-analysis of the association between childhood type 1 diabetes and atopic disease. Diabetes Care. 2003;26(9):2568-2574.
https://doi.org/10.2337/diacare.26.9.2568
20.Andersen YMF, Egeberg A, Gislason GH, Skov L, Knop FK, Thyssen JP. Adult atopic dermatitis and the risk of type 2 diabetes. J Allergy Clin Immunol. 2017;139(3):1057-1059.
https://doi.org/10.1016/j.jaci.2016.08.049
21.Zhang A, Silverberg J. Association of atopic dermatitis with being overweight and obese: a systematic review and metaanalysis. J Am Acad Dermatol. 2015;72(4):606-616.e4.
https://doi.org/10.1016/j.jaad.2014.12.013
22.Lim MS, Lee CH, Sim S, Hong SK, Choi HG. Physical activity, sedentary habits, sleep, and obesity are associated with asthma, allergic rhinitis, and atopic dermatitis in korean adolescents. Yonsei Med J. 2017;58(5):1040-1046. https://doi.org/10.3349/ymj.2017.58.5.1040
23.O’Donovan SM, O’B Hourihane J, Murray DM, Kenny LC, Khashan AS, Chaoimh CN, Irvine AD, Kiely M. Neonatal adiposity increases the risk of atopic dermatitis during the first year of life. J Allergy Clin Immunol. 2016; 137(1):108-117.
https://doi.org/10.1016/j.jaci.2015.05.035
24.Silverberg JI, Kleiman E, Lev-Tov H, Silverberg NB, Durkin HG, Joks R, Smith-Norowitz TA. Association between obesity and atopic dermatitis in childhood: A case-control study. J Allergy Clin Immunol. 2011;127(5):11801186.e1.
https://doi.org/10.1016/j.jaci.2011.01.063
25.Nino M, Franzese A, Ruggiero Perrino N, Balato N. The Effect of Obesity on Skin Disease and Epidermal Permeability Barrier Status in Children. Pediatr Dermatol. 2012;29(5):567-570. https://doi.org/10.1111/j.1525-1470.2012.01738.x
26.Gorgievska-Sukarovska B, Lipozencic J, Susac A. Obesity and allergic diseases. Acta Dermatovenerol Croat. 2008;16:231-235.
27.Hsiao YP, Tsai JD, Muo CH, Tsai CH, Sung FC, Liao YT, Chang YJ, Yang JH. Atopic diseases and systemic lupus erythematosus: an epidemiological study of the risks and correlations. Int J Environ Res Publ Health. 2014; 11(8):8112-8122.
https://doi.org/10.3390/ijerph110808112
28.Wu LC, Hwang CY, Chung PI, Hua TC, Chen YD, Chu SY, Lee DD, Chang YT, Wang WJ, Liu HN, Chen CC. Autoimmune disease comorbidities in patients with atopic dermatitis: a nationwide case-control study in Taiwan. Pediatr Allerg Immunol. 2014;25(6):586-92. https://doi.org/10.1111/pai.12274
Russian Journal of Clinical Dermatology and Venereology 2019, vol. 18, no. 3 |
351 |
В помощь практическому врачу |
Guidelines for practitioner |
29.Rahman A, Isenberg DA. Systemic lupus erythematosus. N. Engl. J. Med. 200828;358(9):929-939.
https://doi.org/10.1056/NEJMra071297
30.Lin C, Lin C, Shen T, Wei C. Epidemiology and risk of juvenile idiopathic arthritis among children with allergic diseases: a nationwide populationbased study. Pediatr Rheumatol. 2016;14(1):15. https://doi.org/10.1186/s12969-016-0074-8
31.Lai N, Tsai T, Koo M, Lu M. Association of rheumatoid arthritis with allergic diseases: a nationwide population-based cohort study. Allergy Asthma Proceedings. 2015;36(5):99-103.
https://doi.org/10.2500/aap.2015.36.3871
32.Wei C, Lin C, Shen T, Li T, Chen A. Atopic dermatitis and association of risk for Henoch–Schönlein purpura (IgA vasculitis) and renal involvement among children. Medicine. 2016;95(3):e2586. https://doi.org/10.1097/md.0000000000002586
33.Wei CC1, Lin CL, Shen TC, Tsai JD. Atopic dermatitis and association of risk for primary immune thrombocytopenia and autoimmune diseases among children: A nationwide population-based cohort study. Medicine (Baltimore). 2016;95(29):e4226. https://doi.org/10.1097/MD.0000000000004226
34.Schmitt J, Romanos M, Pfennig A, Leopold K, Meurer M. Psychiatric comorbidity in adult eczema. Br J Dermatol. 2009;161(4):878-883. https://doi.org/10.1111/j.1365-2133.2009.09309.x
35.Lee SA. Association of atopic dermatitis with depressive symptoms and suicidal behaviors among adolescents in Korea: the 2013 Korean Youth Risk Behavior Survey. BMC Psychiatry. 2017;17(1). https://doi.org/10.1186/s12888-016-1160-7
36.Yang Y, Tseng K, Chen Y, Yang J. Associations among eczema, asthma, serum immunoglobulin E and depression in adults: a population-based study. Allergy. 2009;65(6):801-802. https://doi.org/10.1111/j.1398-9995.2009.02249.x
37.Lee SH, Lee SH, Lee SY, Lee B, Lee SH, Park YL. Psychological health status and health-related quality of life in adults with atopic dermatitis: a nationwide cross-sectional study in South Korea. Acta Derm Venereol. 2018; 98(1):89-97.
https://doi.org/10.2340/00015555-2797
38.Lee CY, Chen MH, Jeng MJ, Hsu JW, Tsai SJ, Bai YM, Hung GY, Yen HJ, Chen TJ, Su TP. Longitudinal association between early atopic dermatitis and subsequent attention-deficit or autistic disorder. Medicine. 2016;95(39): e5005.
https://doi.org/10.1097/md.0000000000005005
39.Strom M, Fishbein A, Paller A, Silverberg J. Association between atopic dermatitis and attention deficit hyperactivity disorder in U.S. children and adults. Br J Dermatol. 2016;175(5):920-929. https://doi.org/10.1111/bjd.14697
40.Schmitt J, Buske-Kirschbaum A, Roessner V. Is atopic disease a risk factor for attention-deficit/hyperactivity disorder? A systematic review. Allergy. 2010;65(12):1506-1524.
https://doi.org/10.1111/j.1398-9995.2010.02449.x
41.Romanos M, Gerlach M, Warnke A, Schmitt J. Association of attentiondeficit/hyperactivity disorder and atopic eczema modified by sleep disturbance in a large population-based sample. J Epidemiol Community Health. 2009;64(3):269-273.
https://doi.org/10.1136/jech.2009.093534
42.Carroll C, Balkrishnan R, Feldman S, Fleischer A, Manuel J. The burden of atopic dermatitis: impact on the patient, family, and society. Pediatr Dermatol. 2005;22(3):192-199. https://doi.org/10.1111/j.1525-1470.2005.22303.x
43.Oades R, Dauvermann M, Schimmelmann B, Schwarz M, Myint A. Atten- tion-deficit hyperactivity disorder (ADHD) and glial integrity: S100B, cytokines and kynurenine metabolism - effects of medication. Behavioral Brain Functions. 2010;6(1):29.
https://doi.org/10.1186/1744-9081-6-29
44.Silverberg J, Joks R, Durkin H. Allergic disease is associated with epilepsy in childhood: a US population-based study. Allergy. 2013;69(1):95-103. https://doi.org/10.1111/all.12319
45.Yaghmaie P, Koudelka C, Simpson E. Mental health comorbidity in patients with atopic dermatitis. J Allergy Clin Immunol. 2013;131(2):428-433. https://doi.org/10.1016/j.jaci.2012.10.041
46.Adil H, Siegfried E, Armbrecht E. The impact of severe atopic dermatitis: analysis of comorbidities. J Am Acad Dermatol. 2014;70(5):AB66. https://doi.org/10.1016/j.jaad.2014.01.271
47.Croonenberghs J, Bosmans E, Deboutte D, Kenis G, Maes M. Activation of the inflammatory response system in autism. Neuropsychobiology. 2002; 45(1):1-6.
https://doi.org/10.1159/000048665
48.Yarlagadda A, Alfson E, Clayton AH. The blood brain barrier and the role of cytokines in neuropsychiatry. Psychiatry (Edgmont). 2009;6:18–22.
49.Muñoz-Jareño N1, Fernández-Mayoralas DM, Martínez-Cervell C, Cam- pos-Castelló J. Relationship between migraine and atopy in childhood: a retrospective case-control study. Rev Neurol. 2011;53(12):713-20.
50.Shreberk-Hassidim R, Hassidim A, Gronovich Y, Dalal A, Molho-Pes- sach V, Zlotogorski A. Atopic dermatitis in israeli adolescents from 1998 to 2013: trends in time and association with migraine. Pediatr Dermatol. 2017; 34(3):247-252.
https://doi.org/10.1111/pde.13084
51.Katayama I, Kohno Y, Akiyama K, Aihara M, Kondo N, Saeki H, Shoji S, Yamada H, Nakamura K. Japanese guideline for atopic dermatitis 2014. Allergol Int. 2014;63(3):377-398. https://doi.org/10.2332/allergolint.14-rai-0769
52.Carmi E, Defossez-Tribout C, Ganry O, Cene S, Tramier B, Milazzo S, Lok C. Ocular complications of atopic dermatitis in children. Acta Derma- to-Venereologica. 2006;86(6):515-517. https://doi.org/10.2340/00015555-0163
53.Nagaki Y, Hayasaka S, Kadoi C. Cataract progression in patients with atopic dermatitis. J Cataract Refr Surg. 1999;25(1):96-99. https://doi.org/10.1016/s0886-3350(99)80018-2
54.Rim TH, Kim DW, Kim SE, Kim SS. Factors associated with cataract in Korea: a community health survey 2008-2012. Yonsei Med J. 2015;56(6):1663-1670. https://doi.org/10.3349/ymj.2015.56.6.1663
55.Handa S, Jain A, Kanwar A, Kaujalgi R. Ocular abnormalities in atopic dermatitis in Indian patients. Ind J Dermatol, Venereol and Leprol. 2009; 75(2):148. https://doi.org/10.4103/0378-6323.48659
56.Haeck I, Rouwen T, Timmer-de Mik L, de Bruin-Weller M, BruijnzeelKoomen C. Topical corticosteroids in atopic dermatitis and the risk of glaucoma and cataracts. J Am Acad Dermatol. 2011;64(2):275-281. https://doi.org/10.1016/j.jaad.2010.01.035
57.Yoo T, Kim S, Seo K. Age-related cataract is associated with elevated serum immunoglobulin E levels in the South Korean population: a cross-sectional study. PLOS ONE. 2016;11(11):e0166331. https://doi.org/10.1371/journal.pone.0166331
58.Perugia C, Saraceno R, Ventura A, Lorè B, Chiaramonte C, Docimo R, Chimenti S. Atopic dermatitis and dental manifestations. G Ital Dermatol Venereol. 2017;152(2):122-125. https://doi.org/10.23736/S0392-0488.16.05224-X
59.Kalhan TA, Loo EX, Kalhan AC, Kramer MS, H, Shek LP, Goh A, Chong YS, Lee BW, Gluckman P, Kwek K, Saw SM, Godfrey K, Hsu CY. Atopic dermatitis and early childhood caries: Results of the GUSTO study. J Allergy Clin Immunol. 2017;139(6):2000-2003. https://doi.org/10.1016/j.jaci.2016.10.038
60.Кулакова Е.В., Елизарова В.М., Пампура А.Н., Виноградова Т.В., Варламов Е.Е. Роль эндогенных антимикробных пептидов (кателицидина LL-37) в развитии кариеса у детей с атопическим дерматитом. Леч проф. 2013;1(5):73-76.
Kulakova EV, Elizarova VM, Pampura AN, Vinogradova TV, Varlamov EE. The role of endogenous antimicrobial peptides (catelicidin LL-37) in the development of caries at children with atopic dermatitis. Lech prof. 2013; 1(5):73-76 (In Russ.).
61.Ress K, Annus T, Putnik U, Luts K, Uibo R, Uibo O. Celiac disease in children with atopic dermatitis. Pediatr Dermatol. 2014;31(4):483-488. https://doi.org/10.1111/pde.12372
62.Egeberg A, Andersen Y, Gislason G, Skov L, Thyssen J. Gallstone risk in adult patients with atopic dermatitis and psoriasis: possible effect of overweight and obesity. Acta Dermato Venereologica. 2017;97(5):627-631. https://doi.org/10.2340/00015555-2622
63.Drucker AM, Thompson JM, Li WQ, Cho E, Li T, Guttman-Yassky E, Qureshi AA. Incident alopecia areata and vitiligo in adult women with atopic dermatitis: Nurses’ Health Study 2. Allergy. 2017;72(5):831-834. https://doi.org/10.1111/all.13128
64.Magen E, Chikovani T, Waitman DA, Kahan NR. Association of alopecia areata with atopic dermatitis and chronic spontaneous urticaria. Allergy Asthma Proc. 2018;39(2):96-102. https://doi.org/10.2500/aap.2018.39.4114
65.Ezzedine K, Diallo A, Léauté-Labrèze C, Seneschal J, Boniface K, CarioAndré M, Prey S, Ballanger F, Boralevi F, Jouary T, Mossalayi D, Taieb A. Prevs. post-pubertal onset of vitiligo: multivariate analysis indicates atopic diathesis association in pre-pubertal onset vitiligo. Br J Dermatol. 2012; 167(3):490-495.
https://doi.org/10.1111/j.1365-2133.2012.11002.x
66.Alexopoulos A, Kakourou T, Orfanou I, Xaidara A, Chrousos G. Retrospective analysis of the relationship between infantile seborrheic dermatitis and atopic dermatitis. Pediatr Dermatol. 2013;31(2):125-130. https://doi.org/10.1111/pde.12216
352 |
Клиническая дерматология и венерология 2019, т. 18, № 3 |
В помощь практическому врачу |
Guidelines for practitioner |
67.Chia B, Tan A, Tey H. Primary localized cutaneous amyloidosis: association with atopic dermatitis. J Eur Acad Dermatol Venereol. 2013;28(6):810-813. https://doi.org/10.1111/jdv.12144
68.Thyssen J, McFadden J, Kimber I. The multiple factors affecting the association between atopic dermatitis and contact sensitization. Allergy. 2013; 69(1):28-36.
https://doi.org/10.1111/all.12358
69.Thyssen J, Johansen J, Linneberg A, Menné T. The epidemiology of hand eczema in the general population — prevalence and main findings. Contact Dermatitis. 2010;62(2):75-87. https://doi.org/10.1111/j.1600-0536.2009.01669.x
70.Mailhol C, Lauwers-Cances V, Rancé F, Paul C, Giordano-Labadie F. Prevalence and risk factors for allergic contact dermatitis to topical treatment in atopic dermatitis: a study in 641 children. Allergy. 2009;64(5):801-806. https://doi.org/10.1111/j.1398-9995.2008.01890.x
71.Simpson E. Comorbidity in Atopic Dermatitis. Cur Dermatol Rep. 2012; 1(1):29-38.
https://doi.org/10.1007/s13671-011-0003-5
Поступила в редакцию 14.01.19
Received 14.01.19
Принята к печати 08.04.19
Accepted 08.04.19
Russian Journal of Clinical Dermatology and Venereology 2019, vol. 18, no. 3 |
353 |

В помощь практическому врачу |
Guidelines for practitioner |
Клиническая дерматология и венерология |
Russian Journal of Clinical Dermatology and Venereology = |
2019, т. 18, № 3, с. 354-359 |
Klinicheskaya dermatologiya i venerologiya 2019, vol. 18, no 3, pp. 354-359 |
https://doi.org/10.17116/klinderma201918031354 |
https://doi.org/10.17116/klinderma201918031354 |
Опыт терапии секукинумабом тяжелых форм псориаза
© Ю.В. НЕФЕДЬЕВА1, О.И. ЛЕТЯЕВА1, О.Р. ЗИГАНШИН1, Н.А. КОЗАВЧИНСКАЯ2
1ФГБОУ ВО «Южно-Уральский государственный медицинский университет» Минздрава России, Челябинск, Россия;
²ГБУЗ «Челябинский областной клинический кожно-венерологический диспансер», Челябинск, Россия
РЕЗЮМЕ
Увеличение числа больных псориазом средней и тяжелой степеней, торпидным к традиционным методам терапии, обусловливает не-
обходимость более широкого использования генно-инженерных биологических препаратов. Результаты исследований последних лет
подтверждают важную роль интерлейкина-17 (ИЛ-17) в развитии псориаза. ИЛ-17А является естественным цитокином, который участвует в нормально протекающих реакциях воспаления и иммунного ответа. ИЛ-17А играет ключевую роль в патогенезе бляшечного
псориаза и псориатического артрита. Ингибирование данного цитокина обусловливает значимое улучшение в течении заболевания.
Секукинумаб представляет собой полностью человеческое антитело (иммуноглобулин G1, IgGl), которое селективно связывается и
нейтрализует провоспалительный цитокин ИЛ-17А. Применение секукинумаба у пациентов с бляшечным псориазом в дозе 300 мг
обеспечивает выраженное очищение кожных покровов, с максимальным эффектом на 16-й неделе. Секукинумаб эффективен как у пациентов, ранее не получавших терапию генно-инженерными биологическими препаратами, так и при недостаточном ответе на те-
рапию ингибиторами фактора некроза опухоли альфа. При применении секукинумаба отмечено улучшение клинического течения,
качества жизни, связанного с функциональным статусом и состоянием здоровья, а также замедление прогрессирования поражения
периферических суставов. Целью наблюдательного исследования была оценка эффективности и безопасности применения препара-
та секукинумаб в лечении тяжелых форм псориаза в реальной клинической практике. Приведены результаты клинического наблюдения за 2 пациентами, получавшими лечение препаратом секукинумаб. В результате проведенной терапии индекс PASI достиг у паци-
ента Д. 90%, у пациента П. 94%.
Ключевые слова: псориаз, псориатический артрит, генно-инженерная биологическая терапия, секукинумаб, реальная клиническая
практика.
Нефедьева Ю.В. — https://orcid.org/0000-0002-8264-1068 Летяева О.И. — https://orcid.org/0000-0002-9085-6229 Зиганшин О.Р. — https://orcid.org/ 0000-0002-5857-0319 Козавчинская Н.А. — https://orcid.org/0000-0003-4039-3286
КАК ЦИТИРОВАТЬ:
Нефедьева Ю.В., Летяева О.И., Зиганшин О.Р., Козавчинская Н.А. Опыт терапии секукинумабом тяжелых форм псориаза. Клиническая дерматология и венерология. 2019;18(3):354-359. https://doi.org/10.17116/klinderma201918031354
Experience in therapy of psoriasis` severe forms with secukinumab
© YU.V. NEFED’EVA1, O.I. LETYAEVA1, O.R. ZIGANSHIN1, N.A. KOZAVCHINSKAYA2
1«South-Ural State Medical University» of the Ministry of Healthcare of the Russia, department of dermatovenerology, Chelyabinsk, Russia; 2State budgetary institution of health care «Chelyabinsk regional clinical dermatovenerologic dispensary», Chelyabinsk, Russia
ABSTRACT
The increase in the number of patients with moderate and severe psoriasis, torpid to traditional methods of therapy, necessitates a wider use of genetically engineered biological drugs. The results of recent studies confirm the important role of interleukin-17 (IL-17) in the development of psoriasis. IL-17A is a natural cytokine that is involved in normal inflammation and immune response reactions. IL-17A plays a key role in the pathogenesis of plaque psoriasis and psoriatic arthritis. Inhibition of this cytokine causes a significant improvement in the course of the disease. Secukinumab is an all-human antibody (immunoglobulin G1, IgG1) that selectively binds to and neutralizes the proinflammatory cytokine IL-17A.Secukinumab treatment at a dose of 300 mg for patients with plaque psoriasis provides a more pronounced cleansing of the skin compared with the use of a dose of 150 mg, with a maximum effect at 16 weeks. Secukinumab is effective both in patients who have not previously received therapy with genetically engineered biological drugs and in case of an insufficient response to therapy with inhibitors of tumor necrosis factor alpha. Secukinumab treatment improved the clinical course, quality of life associated with functional status and health status and slowed the progression of disorders of the peripheral joints. The objective of this observational study was to evaluate the efficacy and safety of secukinumab in the treatment of severe forms of psoriasis. The results of clinical observation of two patients treated with secukinumab are presented. As a result of the treatment, the PASI index reached 90% in the patient D., in the patient P. — 94%.
Keywords: psoriasis, psoriatic arthritis, biologic treatment, secukinumab, real clinical experience.
Nefed’eva Yu.V. — https://orcid.org/0000-0002-8264-1068
Letyaeva O.I. — https://orcid.org/0000-0002-9085-6229
Ziganshin O.R. — https://orcid.org/ 0000-0002-5857-0319
Kozavchinskaya N.A. — https://orcid.org/0000-0003-4039-3286
Автор, ответственный за переписку: Нефедьева Ю.В. — |
Corresponding author: Nefed’eva Yu.V. — |
e-mail: women200681@mail.ru |
e-mail: women200681@mail.ru |
354 |
Клиническая дерматология и венерология 2019, т. 18, № 3 |

В помощь практическому врачу |
Guidelines for practitioner |
TO CITE THIS ARTICLE:
Nefed’eva YuV, Letyaeva OI, Ziganshin OR, Kozavchinskaya NA. Experience in therapy of psoriasis` severe forms with secukinumab. Russian Journal of Clinical Dermatology and Venereology = Klinicheskaya dermatologiya i venerologiya. 2019;18(3):354-359. (In Russ.). https://doi.org/10.17116/ klinderma201918031354
Псориаз — системное хроническое воспали- |
болезнь двенадцатиперстной кишки (рубцовые из- |
тельное заболевание, поражающее преимуществен- |
менения), с 2014 г. — псориатический артрит. Аллер- |
но кожу, которым страдают 2—3% населения [1, 2]. |
гологический анамнез не отягощен. Лекарственной |
Примерно у 1/3 пациентов заболевание имеет сред- |
непереносимости нет. Наследственный анамнез не |
нетяжелое, тяжелое течение и/или сопровождает- |
отягощен. |
ся развитием псориатического артрита. Чаще всего |
Объективно: общее состояние удовлетворитель- |
именно эта категория пациентов, а также лица с су- |
ное, органы и системы без особенностей. Темпера- |
щественным снижением качества жизни, нуждают- |
тура тела 36,7 °С. Периферические лимфоузлы не |
ся в системной терапии. Метотрексат, синтетические |
увеличены. Артериальное давление 123/78 мм рт.ст., |
ретиноиды, циклоспорин обладают достаточно се- |
пульс 74 в 1 мин, удовлетворительного наполнения. |
рьезной органной токсичностью, обусловливают раз- |
Физиологические отправления в норме. |
витие побочных эффектов, лечение ими требует тща- |
Локальный статус: дерматологический процесс |
тельного клинико-лабораторного мониторинга [3]. |
носит распространенный, симметричный характер, |
Генно-инженерные биологические препараты — |
локализуется на коже туловища, конечностей, воло- |
это новый класс терапевтических средств, механизм |
систой части головы. Представлен множественны- |
действия которых заключается в таргетном блокирова- |
ми папулами округлой формы диаметром 0,5—2 см, |
нии функции одного или нескольких медиаторов вос- |
бляшками неправильной формы от 3×6 до 30×40 см, |
паления, играющих ключевую роль в развитии патоло- |
ярко-красного цвета, с четкими границами, выра- |
гического процесса [4]. Применение биопрепаратов яв- |
женной инфильтрацией (рис. 1). В центральной части |
ляется новым и наиболее перспективным методом |
на поверхности папул и бляшек серебристо-белые |
фармакотерапии псориаза с таргетным характером, ли- |
чешуйки, периферическая зона свободна от чешу- |
шенным многих потенциальных рисков токсического |
ек, ярко-красного цвета. Триада Ауспитца положи- |
воздействия на организм. Секукинумаб (Козэнтикс) с |
тельная. Дермографизм розовый. Волосы не измене- |
01.01.18 входит в перечни ЖНВЛП и ОНЛС согласно |
ны. Ногтевые пластинки деформированы, положи- |
распоряжению Правительства РФ от 23.10.17 №2323-р |
тельные симптомы «наперстка» и «масляного пятна». |
и включен в клинические рекомендации по лечению |
Область суставов не изменена, подвижность в пле- |
псориаза и псориатического артрита [5]. |
чевых суставах, позвоночнике ограничена из-за бо- |
|
лезненности. |
Клинические случаи |
Данные лабораторных исследований. Общий ана- |
|
лиз крови (от 23.01.18): эр. 4,8×109/л, Hb 143 г/л, цве- |
Больной Д., 42 лет, болен псориазом с 2007 г., |
товой показатель 0,9, тр. 222·103/мкл, л. 6,4·109/л, |
когда впервые появились высыпания на коже туло- |
э. 2%, н.п. 7%, н.с. 55%, лимф. 32%, мон. 4%, СОЭ |
вища и конечностей и умеренный периодический |
15 мм/ч. |
зуд. Появление высыпаний ни с чем не связывает, |
Биохимический анализ крови (от 23.01.18): общий |
обострения 3—4 раза в год, сезонности не отмечает. |
белок 73 г/л, альбумин 43 г/л, креатинин 128 мкмоль/л, |
С 2004 г. 2 раза в год получал комплексное лечение, |
мочевина 5,5 ммоль/л, аспартатаминотрансфера- |
ПУВА-терапию в стационарном отделении кругло- |
за (АСТ) 26 Ед/л, аланинаминотрансфераза (АЛТ) |
суточного пребывания ГБУЗ «Челябинский област- |
7 Ед/л, щелочная фосфатаза 266 Ед/л, общий билиру- |
ной клинический кожно-венерологический диспан- |
бин 11,2 мкмоль/л, глюкоза 5,1 ммоль/л, холестерин |
сер» (СОКП ГБУЗ ЧОККВД) с кратковременным |
3,4 ммоль/л, С-реактивный белок 11 мг/л, ревматоид- |
положительным эффектом. С 2014 г. наблюдается у |
ный фактор 17 МЕ/л. Анализ кала на яйца гельминтов |
ревматолога с диагнозом «псориатический артрит с |
(от 23.01.18) отрицательный. |
поражением позвоночника и плечевых суставов». |
Иммуноферментный анализ на сифилис отрица- |
Жалобы при поступлении в СОКП ГБУЗ |
тельный. Антитела антиген ВИЧ 1, 2, HbsAg, HCVAg |
ЧОККВД (22.01.18): высыпания на коже туловища, |
не обнаружены. При флюорографии (от 15.01.18) |
конечностей, волосистой части головы, умеренный |
структурная патология не визуализируется. |
зуд, болезненность в области плечевых суставов, по- |
Больной П., 49 лет, болен псориазом с 2000 г., |
звоночника. |
когда впервые появились высыпания на коже туло- |
Перенесенные заболевания: острые респиратор- |
вища, конечностей, умеренный периодический зуд. |
ные вирусные инфекции, с 2008 г. — мочекаменная |
Появление высыпаний связывает со стрессом, об- |
болезнь, с 2009 г. — хронический гастрит, язвенная |
острения 2—3 раза в год, сезонности не отмечает. |
Russian Journal of Clinical Dermatology and Venereology 2019, vol. 18, no. 3 |
355 |

В помощь практическому врачу |
Guidelines for practitioner |
|
|
|
|
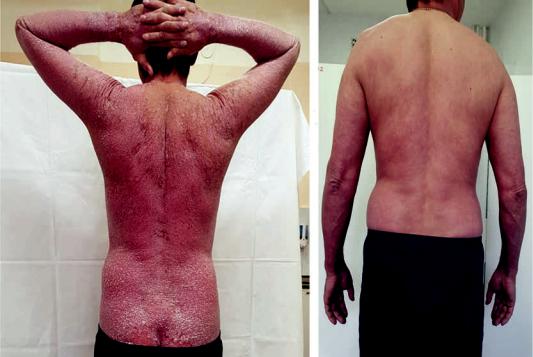
Рис. 1. Пациент Д., 42 лет. Клинические проявления псориаза в начале терапии и через 4 мес терапии секукинумабом (8 инъекций).
Fig. 1. Patient D., 42 years. Clinical manifestations of psoriasis before treatment and after 4 months of therapy with secukinumab (8 injections).
Рис. 2. Тот же пациент. Клинические проявления псориаза в начале терапии и через 4 мес терапии секукинумабом (8 инъекций).
Fig. 2. Same patient. Clinical manifestations of psoriasis before treatment and after 4 months of therapy with secukinumab (8 injections).
С 2009 г. ежегодно получал комплексное лечение, |
блюдается у ревматолога с диагнозом: псориатиче- |
ПУВА-терапию в СОКП ГБУЗ ЧОККВД, с кратко- |
ский артрит с поражением суставов кистей и стоп. |
временным положительным эффектом. Ремиссия |
Жалобы при поступлении в СОКП ГБУЗ ЧОККВД |
после курса терапии длится 1—4 мес. С 2016 г. на- |
(22.01.18): высыпания на коже туловища, конечностей, |
356 |
Клиническая дерматология и венерология 2019, т. 18, № 3 |

В помощь практическому врачу |
Guidelines for practitioner |
|
|
|
|
Рис. 3. Пациент П., 49 лет. Клинические проявления псориаза в начале терапии и через 4 мес терапии секукинумабом (8 инъекций).
Fig. 3. Patient P., 49 years old. Clinical manifestations of psoriasis before treatment and after 4 months of therapy with secukinumab (8 injections).
волосистой части головы, умеренный зуд, болезнен- |
ной показатель 1,0, тр. 327·103/мкл, л. 14,6·109/л, |
ность в области суставов конечностей, усиливающие- |
э. 3%, н.п. 4%, с.п. 68%, лимф. 20%, мон. 5%, СОЭ |
ся при движении. |
14 мм/ч. |
Перенесенные заболевания: острые респиратор- |
Биохимический анализ крови (от 23.01.18): общий |
ные вирусные инфекции, хронический гломеруло- |
белок 71 г/л, альбумин 38 г/л, креатинин 127 мкмоль/л, |
нефрит (латентная форма), хроническая почечная |
мочевина 5,4 ммоль/л, АСТ 25 Ед/л, АЛТ 9 Ед/л, ще- |
недостаточность 0 степени, гипертоническая болезнь |
лочная фосфатаза 257 Ед/л, общий билирубин |
I—II стадии, ангиопатия сетчатки, псориатический |
10,4 мкмоль/л, глюкоза 4,9 ммоль/л, холестерин |
артрит (с 2016 г.). Аллергологический анамнез не |
3,9 ммоль/л, С-реактивный белок 32,7 мг/л, ревмато- |
отягощен. Лекарственной непереносимости нет. На- |
идный фактор 22 МЕ/л. Анализ кала на яйца гельмин- |
следственный анамнез отягощен: у матери вульгар- |
тов (от 23.01.18): яйца гельминтов не обнаружены. |
ный псориаз. |
Иммуноферментный анализ на сифилис отрица- |
Объективно: общее состояние удовлетворитель- |
тельный. Антитела антиген ВИЧ 1, 2, HbsAg, HCVAg |
ное, органы и системы без особенностей. Темпера- |
не обнаружены. Флюорография (от 22.01.18): струк- |
тура тела 36,6 °С. Периферические лимфоузлы не |
турной патологии не визуализируется. |
увеличены. Артериальное давление 132/80 мм рт.ст., |
Учитывая ухудшение течения дерматоза, часто |
пульс 76 в 1 мин, удовлетворительного наполнения. |
рецидивирующий характер заболевания, наличие су- |
Физиологические отправления в норме. |
ставного синдрома, минимальный эффект от прово- |
Локальный статус: дерматологический процесс |
димой ранее ПУВА-терапии, оба пациента были на- |
носит распространенный, симметричный характер, |
правлены на врачебную комиссию, которой было |
локализуется на коже туловища, конечностей, воло- |
принято решение о необходимости лечения генно- |
систой части головы. Представлен множественными |
инженерным препаратом секукинумаб. Пациенты |
папулами округлой формы диаметром 1—2 см, бляш- |
осмотрены ревматологом, эндокринологом, окули- |
ками неправильной формы от 4×6 до 32×40 см, яр- |
стом, фтизиатром, терапевтом по месту жительства. |
ко-красного цвета, с четкими границами, выражен- |
Противопоказаний к терапии секукинумабом нет. |
ной инфильтрацией (рис. 3). В центральной части на |
При обследовании у больных исключены текущие и |
поверхности папул и бляшек cеребристо-белые че- |
рецидивирующие инфекционные заболевания. Дан- |
шуйки, периферическая зона свободна от чешуек, |
ных, свидетельствующих об онкопатологии, не вы- |
ярко-красного цвета. Триада Ауспитца положитель- |
явлено. |
ная. Дермографизм розовый. Волосы не изменены. |
Данные пациенты получали терапию секукину- |
Ногтевые пластинки деформированы, положитель- |
мабом 300 мг (согласно инструкции к препарату): |
ные симптомы «наперстка» и «масляного пятна». Об- |
«нагрузочная» доза в виде подкожных еженедельных |
ласть суставов не изменена, движения в суставах ки- |
инъекций на 0, 1, 2, 3, 4-й неделе, которая в после- |
стей и стоп ограничены из-за выраженной болезнен- |
дующем вводилась ежемесячно в качестве поддер- |
ности. |
живающей дозы. Для стандартизированной оцен- |
Данные лабораторных исследований. Общий ана- |
ки тяжести псориаза и определения эффективности |
лиз крови (от 23.01.18): эр. 3,8·109/л, Hb 137 г/л, цвет- |
лечения использовали индекс PASI, учитывающий |
Russian Journal of Clinical Dermatology and Venereology 2019, vol. 18, no. 3 |
357 |
В помощь практическому врачу |
Guidelines for practitioner |
|
|
|
|
Рис. 4. Пациент П., 49 лет. Клинические проявления псориаза в начале терапии и через 4 мес терапии секукинумабом (8 инъекций).
Fig. 4. Patient P., 49 years old. Clinical manifestations of psoriasis before treatment and after 4 months of therapy with secukinumab (8 injections).
распространенность и выраженность поражения ко- |
ших псориатических бляшек (рис. 2, 4). Индекс PASI |
жи. Проведена оценка индекса PASI до начала лече- |
уменьшился у пациента Д. на 95%, у пациента П. — |
ния, который составил у пациента Д. 52,8, у больно- |
на 94%. У обоих пациентов болевой синдром в об- |
го П. — 57,6. |
ласти суставов после 8 инъекций секукинумаба от- |
На фоне терапии секукинумабом отмечена поло- |
сутствовал. |
жительная динамика дерматологического процесса. |
|
После второй инъекции секукинумаба зафиксирова- |
Заключение |
но уменьшение шелушения, гиперемии, инфильтра- |
|
ции псориатических папул и бляшек. |
Практика применения биологических препара- |
Через 4 мес терапии секукинумабом, после вось- |
тов свидетельствует о высоком потенциале в реше- |
мой инъекции, у пациентов был зафиксирован поч- |
нии проблемы терапии псориаза и псориатического |
ти полный регресс высыпаний на коже туловища, |
артрита. Наш опыт показывает, что козэнтикс (секу- |
конечностей, волосистой части головы, дерматоло- |
кинумаб) является высокоэффективным препаратом |
гический процесс был представлен пятнами после- |
для терапии тяжелых форм псориаза различных ло- |
воспалительной гиперпигментации на месте быв- |
кализаций. |
Участие авторов: |
Authors’ contributions |
Концепция и дизайн исследования — Н.А. Козавчин- |
The concept and design of the study — N.A. Kozavchins- |
ская, О.Р. Зиганшин |
kaya, O.R. Ziganshin |
Сбор и обработка материала — О.И. Летяева, Ю.В. Не- |
Collecting and interpreting the data — O.I. Letyaeva, |
федьева |
Yu.V. Nefed’eva |
Написание текста — О.И. Летяева, Ю.В. Нефедьева |
Drafting the manuscript — O.I. Letyaeva, Yu.V. Nefed’eva |
Редактирование — О.Р. Зиганшин |
Revising the manuscript — O.R. Ziganshin |
Авторы заявляют об отсутствии конфликта интересов. |
The authors declare no conflict of interest. |
358 |
Клиническая дерматология и венерология 2019, т. 18, № 3 |
В помощь практическому врачу |
Guidelines for practitioner |
ЛИТЕРАТУРА/REFERENCES
1.Kurd SK, Gelfand JM. The prevalence of previously diagnosed and undiagnosed psoriasis in US adults: results from NHANES 2003—2004. J Am Acad Dermatol. 2009;60:218-224.
2.Augustin M, Reich K, Glaeske G, et al. M. Co-morbidity and agerelated prevalence of psoriasis: analysis of health insurance data in Germany. Acta Derm Venereol. 2010;90:147-151.
3.Menter A, Korman NJ, Elmets CA, et al. Guidelines of care for the management of psoriasis and psoriatic arthritis: section 4. Guidelines of care for the management and treatment of psoriasis with traditional systemic agents.
J Am Acad Dermatol. 2009;61:451-485.
4.Thaci D, Blauvelt A, Reich K, et al. Secukinumab is superior to ustekinumab in clearing skin of subjects with moderate to severe plaque psoriasis: CLEAR, a randomized controlled trial. Am Acad Dermatol. 2015;73(3):400409.
5.Федеральные клинические рекомендации. Дерматовенерология 2015: Болезни кожи. Инфекции, передаваемые половым путем. 5-е изд., перераб.
и доп. М. 2016;228-234.
Federalnyie klinicheskie rekomendatsii. Dermatovenerologiya 2015: Bolezni kozhi. Infektsii, peredavaemyie polovyim putem. 5-e izd., pererab. i dop. M. 2016;228-234. (In Russ.).
Поступила в редакцию 12.03.19
Received 12.03.19
Принята к печати 22.04.19
Accepted 22.04.19
Russian Journal of Clinical Dermatology and Venereology 2019, vol. 18, no. 3 |
359 |

В помощь практическому врачу |
Guidelines for practitioner |
Клиническая дерматология и венерология |
Russian Journal of Clinical Dermatology and Venereology = |
2019, т. 18, № 3, с. 360-365 |
Klinicheskaya dermatologiya i venerologiya 2019, vol. 18, no 3, pp. 360-365 |
https://doi.org/10.17116/klinderma201918031360 |
https://doi.org/10.17116/klinderma201918031360 |
Роль липидов в барьерных свойствах кожи
© Е.В. СВИРЩЕВСКАЯ1, Е.В. МАТУШЕВСКАЯ2
1ФГБУН «Институт биоорганической химии им. акад. М.М. Шемякина и Ю.А. Овчинникова» РАН, Москва, Россия;
2Академия постдипломного образования ФГБУ ФНКЦ ФМБА, Москва, Россия
РЕЗЮМЕ
Кожа обеспечивает защиту от механических, тепловых, химических повреждений; имеет собственную иммунную систему; регулирует
количество воды в организме; помогает вырабатывать витамин D и ряд гормонов. Все эти функции обеспечиваются различными
механизмами, ключевым из которых является целостность барьера, в значительной степени опосредованная структурой рогового слоя эпидермиса. Кожа состоит из слоев эпидермиса, дермы и подкожной жировой клетчатки и пронизана потовыми и жировыми
железами и порами, сосудами, нервными волокнами и волосяными мешочками. Верхний слой формируют мертвые клетки (корнеоциты),
что обеспечивается дифференцировкой и гибелью кератиноцитов зернистого слоя. В процессе ороговения в кератиноцитах
включается синтез ряда белков, уплотняется мембрана клеток, агрегируют промежуточные кератиновые филаменты, высвобождаются
во внеклеточное пространство липиды и белки в составе ламеллярных телец (тельца Одланда), выбрасываются органеллы, что обусловливает уплощение клеток, связанных между собой прослойкой липидов, как клеем, и обеспечивает дополнительный
непроницаемый для воды барьер. В норме липидная прослойка состоит на 50% из церамидов, на 30% — из холестерина, 20%
составляют свободные жирные кислоты (в том числе омега-3, -6 и -9), а также ферменты и белки. При различных заболеваниях нару-
шается баланс липидов ламеллярных телец, что сопровождается повышенной потерей воды, нарушением процесса ороговения, вос-
палением. Топические препараты, содержащие аналоги природных липидов, такие как сенсодерм, не только восстанавливают гомеостаз кожи, но и снижают побочные эффекты, вызванные терапевтическими кортикостероидными препаратами.
Ключевые слова: церамиды кожи, дифференцировка эпидермиса, увлажняющие кремы, атопический дерматит, псориаз, эмоленты.
Свирщевская Е.В. — https://orcid.org/0000-0002-5647-9298 Матушевская Е.В. — https://orcid.org/0000-0003-4583-0617
КАК ЦИТИРОВАТЬ:
Свирщевская Е.В., Матушевская Е.В. Роль липидов в барьерных свойствах кожи. Клиническая дерматология и венерология. 2019;18(3):360365. https://doi.org/10.17116/klinderma201918031360
Role of lipids in skin barrier properties
© Е.V. SVIRSHCHEVSKAYA1, Е.V. MATUSHEVSKAYA2
1Immunology Department, Shemyakin-Ovchinnikov Institute of bioorganic chemistry RAS, Moscow, Russia;
2Department of Dermatovenereology and Cosmetology, Academy of postgraduate education under FSBU FSCC of FMBA of Russia, Moscow, Russia
ABSTRACT
The skin provides protection from mechanical, thermal, chemical damage; has its own immune system; regulates the amount of water in the body; helps to produce vitamin D and a number of hormones. All these functions are provided by various mechanisms, the key of which is the integrity of the barrier, largely mediated by the structure of the stratum corneum of the epidermis. The skin consists of the layers of epidermis, dermis and subcutaneous fat and is permeated with sweat and fat glands and pores, vessels, nerve fibers and hair follicles. The upper layer of the skin is formed by dead cells (corneocytes) originated from the differentiated keratinocytes of the granular layer. In the process of cornification in keratinocytes, the synthesis of a number of proteins is activated, the cell membrane is compacted, intermediate keratin filaments are aggregated, lipids and proteins are released into the extracellular space as lamellar bodies (Odland’s body), organelles are ejected, which as a result leads to the flattening of cells interconnected by a layer of lipids as glue, providing an additional water-impermeable barrier. Normally, the lipid layer consists on 50% of ceramides, 30% of cholesterol, 20% of free fatty acids (including omega –3, –6 and –9), as well as of enzymes and proteins. In case of various diseases, the lipid balance of lamellar bodies is disturbed, which leads to an increased water loss, disruption of the cornification process, inflammation. Topical drugs containing analogues of natural lipids, such as Sensoderm, not only restore the homeostasis of the skin, but also reduce the side effects caused by therapeutic corticosteroids.
Keywords: skin ceramides, epidermis differentiation, moisturizing creams, atopic dermatitis, psoriasis, emolents.
Svirshchevskaya E.V. — https://orcid.org/0000-0002-5647-9298
Matushevskaya E.V. — https://orcid.org/0000-0003-4583-0617
TO CITE THIS ARTICLE:
Svirshchevskaya ЕV, Matushevskaya ЕV. Role of lipids in skin barrier properties. Russian Journal of Clinical Dermatology and Venereology = Klinicheskaya dermatologiya i venerologiya. 2019;18(3):360-365. (In Russ.). https://doi.org/10.17116/klinderma201918031360
Автор, ответственный за переписку: Матушевская Е.В. — e-mail: matushevskaya@mail.ru
Corresponding author: Matushevskaya E.V. — e-mail: matushevskaya@mail.ru
360 |
Клиническая дерматология и венерология 2019, т. 18, № 3 |
