
2 курс / Гистология / КОЛИЧЕСТВЕННАЯ_ОЦЕНКА_ИЗМЕНЕНИЙ_В_МИКРОСТРУКТУРЕ_ПЕРИНЕЙРОНАЛЬНЫХ
.pdfБыли рассчитаны коэффициенты корреляции между различными измеряемыми параметрами. Этот выявило ряд достаточно высоких корреляций между 2D и 3D параметрами, а также некоторые другие.
Например, наблюдалась сильная корреляция между периметром и площадью отверстий в 2D-пространстве (коэффициент корреляции Спирмена ρ = 0.977, p < 0.0001), а также между площадью отверстий в пределах отдельных ячеек
PNN, измеренных в 2D и 3D (ρ = 0.827, p < 0.0001). Также наблюдалась очень сильная корреляция между интенсивностью ВКМ в 2D и 3D пространстве (ρ
= 0.954, p < 0.0001). Эти наблюдения ожидаемы и, следовательно,
предполагают надежность разработанного для этого исследования метода.
Более того, была обнаружена умеренная, но очень значимая отрицательная корреляцию между средней интенсивностью ВКМ и периметром (ρ = -0.474, p < 0.0001), а также площадью отверстий PNN (ρ = -0.493, p < 0.0001).
Важно отметить, что площадь ячеек PNN была значительно меньше в экспериментальной группе под действием кетамина по сравнению с контрольной, что согласуется с результатами ручного анализа меньшей части клеток.
3.2.3. Анализ ячеек PNN в комплексе с синапсами
В работе [169А] мы проанализировали микроструктуру комплекса ГАМКергических синапсов с PNN в соматосенсорной коре мышей и сравнили его формирование при наличии и отсутствии сенсорной информации в критический период раннего постнатального развития.
Подготовка тканей проводилась на базе Института Фундаментальной Медицины и Биологии Казанского Федерального Университета. Съемка проводилась на базе Междисциплинарного Центра «Аналитическая Микроскопия» Казанского Федерального Университета.
Животные.
Мышей BalbC использовали в соответствии с регламентом этического комитета Казанского федерального университета. Для экспериментов по
71
https://t.me/medicina_free
сенсорной депривации вибриссы на голове мышей сбривали один раз в день в течение первых тридцати постнатальных дней (P0-P30). В качестве контроля использовали небритых мышей того же помета.
Подготовка ткани
Образцы головного мозга мышей отбирали согласно регламенту этического комитета Казанского федерального университета. Животных терминально анестезировали внутрибрюшинной передозировкой уретана
(Sigma-Aldrich) и немедленно перфузировали через сердце 40 мл холодного фосфатно-солевого буфера (PBS, pH 7,4) с последующим введением такого же объема холодного 4% параформальдегида. Мозг удаляли и фиксировали в течение ночи в 4% параформальдегиде. После этого мозг подвергали криопротекции 30% сахарозой в PBS, pH 7,4 в течение 48 часов, а затем замораживали в среде для заливки (Tissue-Tek, Sakura, Japan) при -80 ° C. На криостате нарезали корональные срезы ткани головного мозга толщиной 18-
20 мкм. Области бочонковой коры определяли при помощи сравнительного цитоархитектонического атласа мозга мыши (Patrick R. Hof, Elsevier).
Процедура окрашивания
PNN окрашивали биотинилированным WFA (VectorLab, США) [170].
Окрашивание проводили на свободно плавающих срезах. Все инкубации проводили в 24-луночных планшетах по 500 мл на лунку. После разделения образцы трижды промывали фосфатно-солевым буфером (PBS; pH 7.4), а
затем обрабатывали в течение 1 часа блокирующим раствором, содержащим
5% бычий сывороточный альбумин (Sigma) в 0,1 M PBS с 0.5% Triton X-100 (PBST). Набор для блокировки стрептавидина / биотина (VectorLab, США)
использовали в соответствии с протоколом производителя для блокирования эндогенного биотина. После этого эти срезы быстро промывали PBS и
инкубировали в течение ночи при 4°C с использованием биотинилированного агглютинина Wisteria floribunda с конечной концентрацией 2 мг / мл (разведение 1:1000) в 10 мМ HEPES и 0.15 М
хлориде натрия, pH 7.4. Образцы промывали трижды по 10 мин PBS и
72
https://t.me/medicina_free
инкубировали в течение 30 мин со стрептавидином, конъюгированным с
Alexa 633 (Invitrogen) (разведение 1:500). После этого срезы промывали 3
раза PBS, предварительно обработав 0.3% Triton X-100, в течение 1 часа.
Затем срезы инкубировали в блокирующем растворе (5% нормальная сыворотка, 1% BSA, 0.3% Triton X-100 в фосфатном буфере) в течение 1 часа и инкубировали с анти-VGAT IgG (Synaptic Systems) (разведение 1:1000) в
PB. + 0.5% Нормальная сыворотка + 0.3% Triton X-100 на 48 часов при +4 °
C. Образцы промывали 3 раза по 10 мин в фосфатном буфере. Козьи антикроличьи антитела, конъюгированные с Alexa 488 (Thermo-Fisher Scientific), использовали в качестве вторичных антител (разведение 1:200) в
фосфатном буфере. Срезы помещали на предметные стекла, сушили на воздухе и заключали под покровное стекло в заливочной среде ImmunoMount (ThermoScientific).
Конфокальная микроскопия и анализ изображений.
Изображения срезов головного мозга получали с помощью лазерного конфокального микроскопа LSM780 (Carl Zeiss, Йена, Германия), линзы объектива Plan-Apochromat 63 / 1.40 Oil DIC M27. Размер вокселя
100x100x200 нм. Для анализа изображений использовались программные пакеты FIJI [143] и Imaris (Bitplane). Все макросы написаны автором настоящей диссертации для FIJI. Процедура трассировки 2D-ячеек использовалась, как описано нами в статье [142А]. Процедура автопорога была разработана на основе подхода, описанного нами в работе [145A].
Квадратная область, содержащая одну ячейку PNN, была подвергнута обработке с использованием 17 алгоритмов автоопределения порога,
доступных в FIJI. В результате были получены 17 пороговых значений интенсивности, далее диапазон интенсивности был разделен на интервалы, и
окончательное пороговое значение интенсивности было рассчитано как среднее арифметическое значений, попадающих в наиболее заполненный интервал. Сначала процедура была применена к сигналу VGAT тех ячеек,
которые ориентированы параллельно фокальной плоскости. После этого та
73
https://t.me/medicina_free
же процедура была применена к анализу конфокальных изображений WFA и VGAT синапсов, ориентированных перпендикулярно фокальной плоскости
(поперечный разрез). Для трехмерного анализа VGAT-положительных объектов в ячейках, ориентированных параллельно фокальной плоскости, а
также WFA-положительных и VGAT-положительных объектов в поперечных конфокальных сечениях PNN алгоритм был расширен для адекватного описания изменений размера и формы, а также ветвления объектов между отдельными конфокальными плоскостями внутри стака.
Локальные максимумы интенсивности для карт интенсивности ХС вдоль периметра ячеек были рассчитаны с помощью соответствующей команды в
FIJI.
Статистический анализ представлен как минимум для 3 независимых экспериментов с использованием однофакторного дисперсионного анализа
(Excel, Microsoft). Планки погрешностей представляют стандартную ошибку среднего (SEM), символы *, ** и *** представляют P < 0.05, 0.01, 0.001. Для анализа морфологии VGAT-положительных синаптических бутонов был разработан автоматический алгоритм сегментации флуоресценции VGAT
внутри ячеек PNN на основе функции автопорога в программе FIJI [143].
Алгоритм позволяет выбирать порог сегментации для VGAT-положительных объектов в синапсе внутри ячеек PNN без участия человека.
Преимущества разработанного метода количественного анализа микроструктуры комплекса PNN с синапсом по сравнению с альтернативными методами.
1)Трехмерный анализ объектов, принадлежащих синаптической терминали (в нашем случае, VGAT-положительных объектов), в том числе ветвящихся в пространстве объектов, является cущественным преимуществом по сравнению с двумерным анализом в [164].
2)Количественный анализ распределения локальных максимумов интенсивности флуоресценции ХС вдоль оси Z в пределах периметра
74
https://t.me/medicina_free
ячейки является таким компонентом разработанного нами метода,
который отсутствует в альтернативных методах [15, 163].
Результаты.
Были проанализированы 1797 ячеек PNN в 38 нейронах от 3 мышей и наблюдались 3 типа распределения VGAT-положительных объектов в ячейках PNN на поверхности нейронов. Отдельная популяция синапсов имела характерную морфологию с одним большим кластером флуоресценции VGAT, средняя площадь кластера 0.87 мкм2 (STD 0.37 мкм2),
занимающая > 60% площади ячейки (рис. 26А, Б). Другая популяция синапсов имела 2-4 меньших кластера VGAT внутри каждой отдельной ячейки PNN (рис. 26В, Г). Средняя площадь кластера VGAT составляла 0.22
мкм2 (STD 0.12 мкм2) для одного кластера и 0.7 мкм2 (STD 0.17 мкм2) для общей площади кластера VGAT по одной ячейке PNN для этой популяции. У
третьей значительной популяции был только один небольшой кластер VGAT
на одну ячейку со средней площадью кластера 0.29 мкм2 (STD 0.22 мкм2)
(рис. 26Д, Е). Соотношение доли числа 3 типов распределения VGAT в
изученных синапсах показано на рис. 1I. Никакой корреляции между типом распределения VGAT и площадью ячейки PNN не наблюдалось. Всего 23%
всех ячеек содержали объекты VGAT.
75
https://t.me/medicina_free

Рисунок 26. 3 типа VGAT-положительных объектов в ячейках PNN. Б – один большой объект, Г – несколько малых объектов, Е – один мелый объект, [169А]
Затем мы проверили, зависит ли это распределение флуоресценции
VGAT в комплексе PNN-синапс от сенсорного входа в развивающуюся синаптическую сеть коры головного мозга. У новорожденных мышей
76
https://t.me/medicina_free
сбривали вибриссы каждый день в течение P0-P30 и сравнивали геометрию ГАМКергических синапсов, окруженных PNN, в слое IV бочонковой коры у бритых и контрольных мышей. Мы проанализировали 3446 ячеек PNN в 76
нейронах в 3 независимых экспериментах.
Чтобы рассмотреть влияние сенсорной депривации на геометрию PNN,
мы сначала проанализировали площадь ячейки в PNN животных с выбритыми усами по сравнению с контрольной группой. Мы не смогли увидеть значительной разницы в форме, площади и распределении окрашивания хондроитин сульфатом между двумя группами (данные не показаны).
Затем мы проанализировали трехмерное распределение интенсивности окрашивания ХС по периметру ячейки (рис. 27). Мы вычисляли среднюю интенсивность ХС по периметру ячейки для каждой конфокальной плоскости и использовали 10% от наивысшего значения в качестве порога сегментации по оси Z для определения верхней и нижней границы ячейки (показаны зеленым цветом на рис. 27). Оказалось, что средняя Z-ширина (или
«толщина») ячеек PNN уменьшается при соматосенсорной депривации (1.18
мкм, SEM 0.07) по сравнению с контролем (1.58 мкм, SEM 0.12, P < 0.05,односторонний ANOVA).
Далее мы обнаружили, что RMSD между положением Z максимальной средней интенсивности и положением z локальных максимумов интенсивности (рис. 28) значительно уменьшилось при соматосенсорной депривации, то есть ячейки становятся более плоскими, если развивающаяся кора головного мозга не получает сенсорной информации.
77
https://t.me/medicina_free

Рисунок 27. Карта распределения интенсивностей флуоресценции ячейки PNN на слоях конфокального стака среза головного мозга мыши. По оси абсцисс – порядковый номер пикселя в периметре. По оси ординат – номер слоя в конфокальном стаке. Спектр внизу изображения показывает кодировку интенсивности флуоресценции цветом, [169А]
Рисунок 28. Карта распределения интенсивностей флуоресценции ячейки PNN на слоях конфокального стака среза головного мозга мыши с указанием локальных максимумов,
[169A]
В 2D-анализе наблюдалось достоверное снижение встречаемости варианта морфологии с одним большим кластером VGAT при сенсорной депривации (29.6%, SEM 3.2) по сравнению с контролем (44.8%, SEM 4.5, P <
78
https://t.me/medicina_free

0.05, односторонний ANOVA) (рис. 29А). Соответственно, средняя площадь
VGAT-положительных объектов была меньше у мышей, подвергшихся сенсорной депривации (P < 0.05, односторонний ANOVA) (рис. 29Б).
Примерно одинаковый процент ячеек содержал VGAT-положительные объекты при сенсорной депривации и в контрольной группе.
А |
Б |
|
|
|
|
Рисунок 29. А – Распределение типов VGAT-положительных объектов после сенсорной депривации и в контрольной группе. Б – Средняя площадь VGAT-положительных объектов, [169А]
Затем мы расширили двумерный анализ, представленный на рис. 26, до аналогичной трехмерной процедуры на конфокальных стаках (рис. 30). Этот тип анализа позволяет измерять трехмерную геометрию VGAT-
положительных объектов внутри ячеек PNN.
79
https://t.me/medicina_free
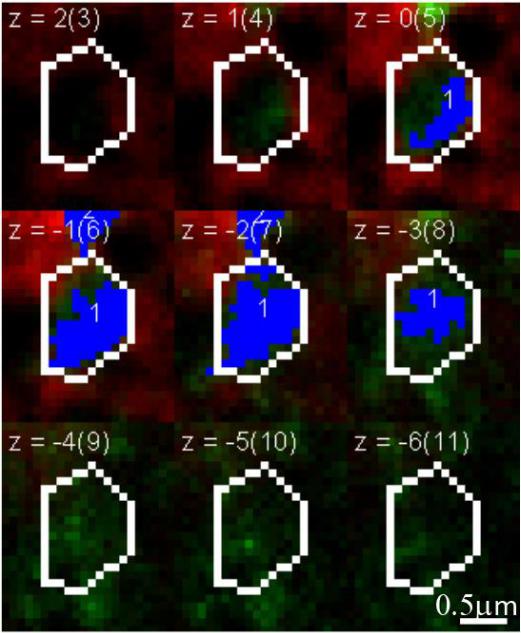
Мы наблюдали достоверное снижение встречаемости варианта морфологии с одним большим кластером VGAT при сенсорной депривации
(38.0%, SEM 3.2) по сравнению с контролем (54.6%, SEM 4.2, P < 0.05,
односторонний ANOVA), что подтверждает результаты 2D-анализа. Кроме того, средний объем VGAT-положительных 3D-объектов был уменьшен у мышей, подвергшихся сенсорной депривации (0.39 мкм3, SEM 0.02) по сравнению с контролем (0.54 мкм3, SEM 0.047, P < 0.05, односторонний
ANOVA).
Рисунок 30. Пример VGAT-позитивного объекта внутри обведённой ячейки на
нескольких слоях конфокального стака, [169А]
80
https://t.me/medicina_free
