
2 курс / Гистология / КОЛИЧЕСТВЕННАЯ_ОЦЕНКА_ИЗМЕНЕНИЙ_В_МИКРОСТРУКТУРЕ_ПЕРИНЕЙРОНАЛЬНЫХ
.pdf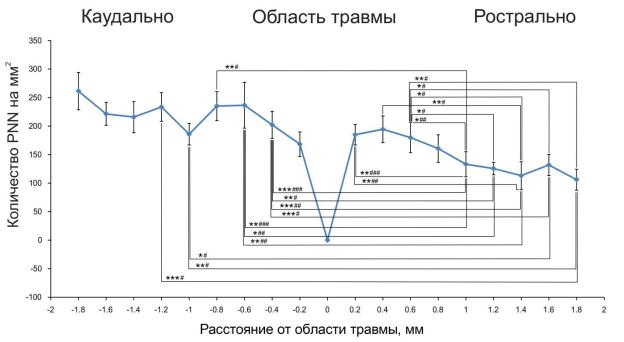
Рисунок 21. Распределение количества PNN в спинном мозге мыши после травмы, [145А]
3.1.3. Обсуждение результатов эпифлуоресцентной микроскопии.
Подход на основе автоматического определения порога, разработанный в этом исследовании, позволяет объективно оценить основные микроструктурные параметры PNN. Представленный здесь метод работает на оборудовании для обычной эпифлуоресцентной микроскопии. Вместе с полуавтоматической процедурой сегментации маски PNN отдельных клеток этот метод может быть эффективным для количественного анализа микроструктуры PNN в большом количестве нейронов - тысячи отдельных клеток. Ограничением является то, что этот метод не полностью автоматический с точки зрения выбора позиций и размера области сегментации.
PNN наблюдаются в соматосенсорной коре мыши уже в P10 [150] и их число растет в различных областях коры между P14 и P30 [151]. В спинном мозге крыс PNN в основном развиваются между P7 и P21 [50]. Мы обнаружили постепенное увеличение присутствия хондроитинсульфатов в
PNN соматосенсорной коры головного мозга мыши в период P14 - P28 (рис. 17А, Б). Наблюдаемое увеличение хондроитинсульфатов также подтверждает
61
https://t.me/medicina_free
роль ХСПГ в ингибировании синаптической пластичности во время закрытия критического периода в мозге млекопитающих [2, 9]. Расширение гистограммы распределения интенсивности отдельных клеток между P14 и
P28, представленное в настоящем исследовании (рис. 17Б), отражает изменения содержания хондроитинсульфата в популяции нейронов, несущих
PNN, и может быть характерной особенностью созревания PNN во время закрытия критического периода.
Ямада и соавт. ранее сравнивали интенсивности покраски хондроитинсульфата в PNN парвальбумин-позитивных нейронов в гиппокампе и зубчатой извилине мышей в возрасте P14, P60 и 12 месяцев
[152]. Авторы сообщают о значительном увеличении интенсивности окрашивания WFA между P14 и P60 в гиппокампе и на протяжении всего изученного периода жизни в зубчатой извилине, что хорошо согласуется с нашими данными. Мы обнаружили, что размер PNN существенно не изменяется между P14 и P28 (рис. 17В, Г). Это говорит о том, что внеклеточный объем, занимаемый PNN, устанавливается на раннем этапе постнатального развития и сохраняется во время созревания PNN
соматосенсорной коры. Этот результат может отражать важность ХСПГ-
обогащенного ВКМ для ионного гомеостаза [10], метаболизма активных форм кислорода [14] и для распределения лигандов межклеточной сигнализации в тканях [67, 70, 71, 72] во время развития мозга и синаптических сетей.
ХСПГ PNN могут вносить значительный вклад в ингибирование посттравматической регенерации в поврежденном головном и спинном мозге, поскольку расщепление ХСПГ хондроитиназой ABC улучшает регенерацию аксонов в поврежденном спинном мозге [59, 63, 103].
Вызванное травмой увеличение экспрессии ассоциированных с PNN ХСПГ было продемонстрировано в деафферентированных ядрах ствола мозга и вокруг двигательных нейронов спинного мозга вдали от места повреждения
62
https://t.me/medicina_free
[159, 65]. Кроме того, рост аксонов был ограничен областями с дефицитом
PNN и ХСПГ в посттравматической коре головного мозга [153].
Активация экспрессии ХСПГ интенсивно изучалась в модели посттравматического глиального рубца как основной компонент посттравматической патологии, вызывающей ингибирование посттравматической регенерации синаптической сети [86, 154]. Повышенная экспрессия специфических ХСПГ, включая нейрокан, бревикан и версикан, а
также изменения в характере сульфатирования хондроитинсульфата были обнаружены в непосредственной близости от места повреждения [56, 57, 87].
Также есть исследование, демонстрирующее подавление экспресии аггрекана, нейрокана и фосфакана вокруг места повреждения [155].
Посттравматическим изменениям экспрессии ХСПГ, удаленным от места повреждения, до сих пор уделялось меньше внимания [156, 64]. Эти изменения PNN наблюдались через 1-2 недели после травмы. Механизм посттравматической активации экспрессии ХСПГ PNN может быть связан с воспалительными стимулами в деафферентированных ядрах [156].
В данной работе мы рассмотрели длительные посттравматические изменения размера и интенсивности PNN через 9 недель после травмы (рис. 5). Мы обнаружили увеличение содержания хондроитинсульфата на расстоянии 1.6–1.8 мм от места повреждения в 6 и 7 ламинах серого вещества вокруг центрального канала (рис. 20А). Кроме того, плотность PNN-несущих клеток значительно увеличивается на расстояниии 0.4–1.2 мм каудально от места повреждения (рис. 21). Как показано в предыдущих исследованиях
[57], эта активация хондроитинсульфата в PNN может способствовать посттравматическому ингибированию регенерации синаптической сети в поврежденном спинном мозге. Кроме того, мы обнаружили уменьшение площади PNN на расстоянии 200 мкм каудально от места повреждения (рис. 20А), что, вероятно, отражает комплексные посттравматические изменения в нервной ткани, прилегающей к месту повреждения [156, 157]. Уменьшение площади PNN, показанное в настоящем исследовании, может быть вызвано
63
https://t.me/medicina_free
продукцией супероксида и окислительным стрессом в поврежденной паренхиме ЦНС [158]. Действительно, сульфат хондроитина, а также другой основной компонент PNN, гиалуронан, могут разлагаться под действием активных форм кислорода [159].
В настоящем исследовании мы наблюдали изменения площади PNN,
обогащения ХСПГ и увеличение плотности нейронов, несущих PNN, в
пределах 1.8 мм рострально и 1.2 мм каудально от гемисекции, спинного мозга на уровне C5. Анализируемая здесь часть шейного отдела спинного мозга (C3–C6) соответствует расположению диафрагмального двигательного ядра и зоне входа дорсального корешка для диафрагмальных афферентов
[149, 156]. В то время как диафрагмальные моторные нейроны расположены в вентральном роге, диафрагмальные афференты образуют множество синаптических контактов в промежуточном сером веществе на уровне C3-C6 [156], то есть в области, анализируемой в настоящем исследовании (рис. 19,
20, 21). Таким образом, изученные здесь PNN-несущие нейроны могут принадлежать к синаптической сети центра регуляции дыхания спинного мозга. Наши результаты показывают, что большинство из этих нейронов являются парвальбумин-позитивными интернейронами. Респираторная дисфункция является серьезным следствием повреждения спинного мозга
[160], что подчеркивает важность посттравматической нейрональной пластичности в исследуемой области. Повышение содержания PNN-
хондроитинсульфата на расстоянии от места повреждения в 1.6–1.8 мм и увеличение плотности PNN-позитивных клеток на расстоянии 0.4–1.2 мм от места повреждения в каудальном направлении могут служить ограничивающими факторами для посттравматической регенерации синаптической сети, управляющей движениями диафрагмы.
Наши результаты показали, что изменения обогащения ХСПГ в PNN
представляют общую черту раннего постнатального развития ЦНС и посттравматической регенерации - двух состояний, характеризующихся повышенной пластичностью нейронов [161, 162]. Представляется
64
https://t.me/medicina_free

целесообразным продолжение оличественных исследований микроструктуры
PNN головного и спинного мозга для изучения изменений во внеклеточном матриксе, связанных с созреванием синаптических сетей и травмами ЦНС.
3.2. Анализ изображений, полученных методом конфокальной
микроскопии высокого разрешения
3.2.1. Ручная трассировка ячеек PNN.
В работе [142А] мы анализировали конфокальные стаки высокого разрешения PNN коры мозга мыши и крысы. Мы провели этот анализ на клеточных телах 34 нейронов из коры головного мозга мышей (всего 1274
ячейки, 3 мыши) и 36 нейронов из коры крыс (всего 1139 ячеек, 3 крысы).
1 мкм
Рисунок 22. Пример ручного выбора ячеек PNN. А – Выбранные вершины ячеек.
Б – Обведённые ячейки, [142А].
Количественный анализ изображений отдельных конфокальных плоскостей был выполнен с помощью FIJI [160]. Для анализа вручную помечали каждую ячейку PNN на телах нейрональных клеток из соматосенсорной коры у взрослых крыс и мышей как многоугольник (рис. 22А), затем измерили площадь, периметр и количество вершин. Для этого был использован плагин (подпрограмма) PointPicker для FIJI. Оператору требовалось последовательно отметить вершины ячейки PNN на изображении (рис. 22), после чего экспортировать их координаты в отдельный файл, из которого их считывают скрипты для анализа параметров
65
https://t.me/medicina_free
микроструктуры ячеек (площади, периметра, распределения интенсивности).
Данный метод является первым в мире методом для количественного анализа микроструктуры ячеек PNN, что также отражено в публикациях других авторов по данной теме (см. ссылка 43 в [15]). Во всех экспериментах статистическая значимость рассчитывалась для данных 3 независимых экспериментов с использованием одностороннего теста ANOVA (Excel,
Microsoft). Столбики ошибок представляют стандартную ошибку среднего,
символы *, ** и *** представляют P < 0.05, 0.01 и 0.001 соответственно.
Подготовка тканей проводилась на базе Института Фундаментальной Медицины и Биологии Казанского Федерального Университета. Съемка проводилась на базе Междисциплинарного Центра «Аналитическая Микроскопия» Казанского Федерального Университета.
Результаты.
Число вершин наблюдаемых ячеек варьировалось от 3 до 9.
Подавляющее большинство имели форму четырехугольника, пятиугольника или шестиугольника. Пятиугольник был наиболее часто наблюдаемой формой, которая наблюдается в 44% ячеек PNN мыши и в 40% ячеек PNN
крысы. Четырехугольные, пятиугольные и шестиугольные формы вместе представляют 93% ячеек в нейронах мыши и 87% в нейронах крысы.
Площадь ячеек широко варьировалась в пределах отдельных нейронов.
Средний размер ячейки составлял 1.29 (70.67) мкм2 для нейронов мыши и
1.44 (70.26) мкм2 для нейронов крысы. Крайние значения площадей широко варьировались с минимальным значением 0.24 мкм2 и максимальным значением 5.48 мкм2для нейронов мыши. Соответствующие значения для
PNN крысы составляли 0.29 мкм2 и 10.18 мкм2. Гистограмма площади ячейки демонстрирует аналогичное распределение для PNN мыши и крысы (рис. 23).
66
https://t.me/medicina_free

Рисунок 23. Распределение площадей ячеек у мышей и крыс, [142А].
Площадь проекции ячейки в конфокальной плоскости может существенно отличаться от реальной площади контура ячейки в зависимости от ориентации ячейки в трёхмерном пространстве. Для проверки высокой изменчивости размера ячейки, наблюдаемой в двумерном анализе (рис. 23),
мы выбрали 20 самых больших и 20 самых маленьких ячеек от каждой мыши и провели трехмерную реконструкцию для этих ячеек из конфокальных стаков (9 плоскостей, 1.8 мкм) для каждой ячейки с помощью инструмента
Imaris Filament Auto-Depth. Поскольку количественное определение площади ячейки в 3D усложняется, мы измерили периметр трехмерного контура ячейки (общая длина контура, построенного инструментом Филамент в программе Имарис для одиночной ячейки) и сравнили его с 2D-периметром тех же ячеек. Как и ожидалось, изменение периметра ячейки было меньше по сравнению с изменением площади ячейки, что отражает разницу между линейным и квадратным размером/измерением. Периметр трехмерной ячейки и периметр двухмерной проекции тех же ячеек демонстрировали
67
https://t.me/medicina_free

сходные изменения, что указывает на то, что изменение размера ячейки,
наблюдаемое в 2D-анализе, подтверждается результатами 3D-анализа.
3.2.2. Автоматизированная трассировка ячеек PNN
В работе [163А] мы представили усовершенствованную методику анализа, сделав её более автоматизированной. В качестве модели патологии использовалась кетаминовая модель шизофрении.
Чтобы измерить параметры ячеек PNN, нами был разработан скрипт
«Analysis of Perineuronal Net Units» (APNU v1.1). В нем пользователю предлагается выбрать центральный пиксель внутри площади ячейки, а затем автоматически определяется контур PNN. Скрипт вычисляет профили интенсивности в исходящих из центра направлениях отслеживания (20 в этом исследовании) для заданного количества конфокальных слоев (3 в этом исследовании), в которых ожидается наличие ячейки PNN. Отверстия определяются как области, в которых интенсивность ВКМ остается ниже средней интенсивности в центре отверстия + заданный порог. Координаты барьера ВКМ определяются локальными максимумами интенсивности ВКМ в плоскости расположения центральной точки (2D ВКМ) или трехмерными координатами, соответствующими максимальным интенсивностям для каждого из направлений трекинга (3D ВКМ).
А |
Б |
|
1 мкм
Рисунок 24. А – ячейка PNN с отмеченным центром (синий). Б - распределение интенсивности флуоресценции вдоль двух противоположных направлений. Профильная желтая линия на А соответствует красному пунктиру на Б, [163А].
68
https://t.me/medicina_free

Если для определенного направления не обнаружено локального максимума, используется линейная экстраполяция для расчета координат барьера ВКМ по координатам однозначно определенных соседних точек барьера ВКМ. Если имеется слишком много направлений, для которых не могут быть найдены локальные максимумы (> 50%), ячейка считается нечетко определенной и исключается из анализа. Методом триангуляции были рассчитаны площади отверстий и барьеров ВКМ в 3D.
Подготовка тканей и съемка проводилась на базе Магдебургского филиала Германского Центра Изучения Нейрозаболеваний.
1 мкм
Рисунок 25. Пример результатов работы скрипта на трех соседних конфокальных слоях.
Центральный левый столб – ячейки до анализа, правый столб – 20 направлений отслеживания, левый столб – полученные контуры ячеек PNN, центральный правый столб
– итоговый контур после поиска максимумов на всех слоях стака, [163А].
69
https://t.me/medicina_free
Преимущества полуавтоматического метода опеределения контура ячейки PNN по сравнению с другими методами.
Метод позволяет автоматически, исключая человеческий фактор,
определять контур ячейки PNN и отличается комбинацией двух важных преимуществ: 1) описывает контур ячейки по принципу, не требующему определения вершин ячейки-многоугольника, что является преимуществом по сравнению с методами, описанными в [5] и в нашей статье [145А]; 2)
описание контура ячейки не требует непрерывности распределения флуоресцентного сигнала вдоль контура, что является преимуществом по сравнению с методом, описанным в [164].
Результаты.
Количественные параметры геометрии ячеек PNN у контрольных и обработанных кетамином животных сначала измерялись по описанной ранее методике [142A]. Средняя площадь ячеек PNN была значительно меньше после обработки кетамином (0.88 ± 0.11 мкм2) по сравнению с контрольными образцами (1.24 ± 0.05 мкм2, p = 0.024). Кроме того, среднее количество вершин, приходящихся на одну ячейку, было меньше у животных,
обработанных кетамином (5.7 ± 0.13), по сравнению с контрольными образцами (6.11 ± 0,06, p = 0.032). Каких-либо различий ни в распределении средней интенсивности окрашивания ВКМ по периметру ячейки, ни в стандартном отклонении интенсивности между контрольной и экспериментальной группами не наблюдалось.
Далее был использован скрипт APNU для анализа параметров ячеек
PNN в двух и трёх измерениях. Всего было проанализировано 5495 ячеек
PNN/64 клеток у 5 контрольных крыс и 7365 ячеек PNN/64 клеток у 6
животных, обработанных кетамином. Анализ был ограничен перисоматическими ячейками PNN нейронов, экпрессирующих парвальбумин, поскольку в некоторых исследованиях сообщалось о том, что их плотность уменьшается при шизофрении [165, 166, 167, 168].
70
https://t.me/medicina_free
