
6 курс / Гастроэнтерология / Российский_журнал_гастроэнтерологии,_гепатологии,_колопроктологии (34)
.pdf
|
|
|
Лекции и обзоры |
Повреждение печени |
|
|
|
|
Активация |
|
|
|
купферовских клеток |
|
|
Гепатоциты |
|
|
|
|
TGF-β1 |
Эндотелиальные клетки |
|
|
|
||
|
TGF-β1 |
PDGF, IGF-1 |
|
|
PDGF, IGF-1 |
|
|
Коллаген IV типа |
Паракринная регуляция |
|
Коллаген IV типа |
|
|
||
|
Активация и пролиферация |
|
|
|
звездчатых клеток печени |
|
|
|
|
Аутокринная |
|
|
|
регуляция |
TGF-β1 |
|
|
Миофибробласты |
|
Звездчатые клетки |
Коллаген I, III типов |
|
|
печени |
|
|
|
|
|
Синтез>расщепление |
|
|
|
экстрацеллюлярного матрикса |
|
|
|
Фиброз печени |
|
Рис. 1. Патогенез фиброза печени |
|
|
|
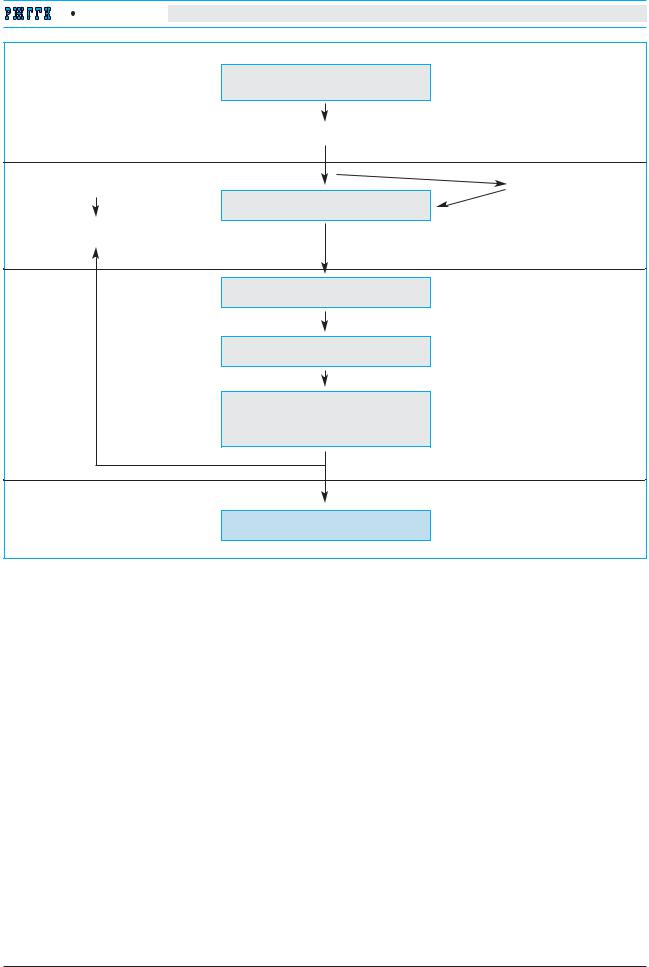
ми Купфера). В основе развития фиброза лежит активация клеток Ито [3, 4].
Вследствие повреждения гепатоцитов при различных патологических воздействиях из разрушенных гепатоцитов выделяются различные биологически активные вещества, включающие перекиси, протеазы и др. Эти вещества активируют макрофаги печени, а также эндотелий синусоидов. Активированные клетки, в свою очередь, начинают секретировать биологически активные вещества, вызывающие активацию звездчатых клеток. К разряду подобных веществ относятся провоспалительные цитокины – интерлейкин-1 (IL-1), фактор некроза опухоли альфа (TNF-α), перекиси, оксид азота, эндотелин, но главная роль в активации звездчатых клеток принадлежит тромбоцитактивирующему фактору (PDGF), активатору плазминогена, трансформирующему фактору роста бета 1 (TGF-β1) и инсулинподобному фактору роста (IGF-1). Под их воздействием звездчатые клетки выходят из состояния покоя и претерпевают ряд превращений.
На первом этапе (этапе инициации) покоящаяся звездчатая клетка под действием перечисленных выше продуктов макрофагов и эндотелия утрачивает депо ретиноидов и начинает секретировать TGF-β1 – фактор, который играет ключе-
вую роль в развитии последующей аутоактивации звездчатых клеток. Под его влиянием звездчатые клетки не только продолжают «активировать сами себя», но и начинают мигрировать в участки воспаления.
Следующий этап, этап закрепления, сопровождается превращением звездчатых клеток в миофибробласты – клетки вытянутой формы, содержащие фибриллы альфа-актина (что придает им некоторую способность к сокращению). Эти клетки продолжают секретировать TGF-β1, а также проявляют свойство выработки внеклеточного матрикса печени. Миофибробласты приобретают способность к активному делению в участках воспаления [4].
По современным представлениям, развитие фиброза нельзя объяснить только избыточной продукцией компонентов внеклеточного матрикса, скорее оно связано с нарушением равновесия процессов образования и деградации компонентов внеклеточного матрикса [3] (рис. 1).
Морфологическая оценка. Выявление морфологических критериев цирроза печени (узкие и широкие фиброзные прослойки, нарушение гистоархитектоники органа, наличие регенераторных узлов) всегда считалось основным этапом диагностики данного заболевания. Названные
21

Лекции и обзоры
признаки являются конечным итогом уменьшения размеров и количества функциональных пространств между эндотелиоцитами во внутридольковых синусоидах, а также образования в них коллагеновой мембраны, в результате чего прогрессирует процесс «капилляризации синусоидов». Эти изменения обусловливают нарушение обмена между кровью, поступающей через систему воротной вены, печеночной артерии и гепатоцитами, что приводит к вовлечению последних в процесс фиброгенеза. В результате активного сокращения миофибробластов и расширения пространств Диссе, заполненных коллагеновыми волокнами, возникает блок тока крови в синусоидах и, как следствие, повышается давление в системе воротной вены, что в дальнейшем ведет к портальной гипертензии, открытию коллатералей и образованию варикозно-расширенных вен пищевода. Необходимо отметить, что у пациентов с циррозом печени по наличию морфологических признаков невозможно судить о риске развития осложнений болезни. Обусловлено это тем, что морфологические признаки цирроза, выявленные путем биопсии печени, могут значительно отличаться в зависимости от структуры участка взятия биоптата (фиброзное поле, регенераторный узел, сохранный портальный тракт). Также отсутствуют четкие критерии распространенности фиброза и оценки начальных признаков цирроза печени по данным современных методов визуализации (УЗИ, КТ, ЯМРТ). Как правило, результаты инструментальных методов исследования подтверждают развитие осложнений цирроза на развернутой стадии заболевания, когда уже имеются их клинические проявления.
Наличие определенного набора признаков фиброза и последовательность их появления диктуют необходимость тщательного подбора метода, позволяющего проводить дальнейшую трактовку полученных данных. Нет единого мнения о том, каким методом следует пользоваться при оценке динамики развития фиброза на фоне хронических заболеваний печени.
Методы окраски фиброзной ткани. Количественные оценки степени фиброза печени можно проводить с использованием окрасок на разные типы волокон фиброзной ткани. Коллагеновые волокна окрашиваются пикрофуксином по Ван-Гизону, а также трехцветным методом Маллори. Эластические волокна – фуксилином или орсеином. Ретикулярные волокна – путем импрегнации серебром по Футу. Морфологи используют несколько систем комплексной оценки распространенности фиброза при хронических гепатитах различной этиологии. Последовательное развитие фиброза от ранней стадии (в пределах портального тракта), через нарушение гистоархитектоники печеночной дольки, до обнаружения всех признаков цирроза можно рассматривать как процесс, состоящий из нескольких
стадий: F0 – фиброз отсутствует; F1 – фиброз
впределах портального тракта; F2 – фиброзная септа; F3 – фиброзная септа с деформацией печеночной дольки; F4 – ложные дольки [9]. Всегда важно помнить, что морфологическая оценка зависит от опыта и квалификации морфолога, что определяет необходимость дальнейшего поиска стандартизации оценочных критериев.
Результаты большого количества клинических исследований, когда применялся слепой метод определения распространенности фиброза разными специалистами-морфологами, показали, что различия в оценке касаются в основном признаков некро-воспалительной реакции и индекса гистологической активности, в то время как степень фиброза менее подвержена расхождениям в трактовке [16]. Широко используется в клинической практике балльная система оценки индекса гистологической активности и степени фиброза печени при хронических вирусных гепатитах по Knodell и соавт. (1981).
I. Слабый фиброз (вовлечение только портальных трактов).
II. Умеренный фиброз (мостовидный, портопортальные и порто-центральные септы).
III. Выраженный фиброз (нарушение долькового строения печени).
IV. Цирроз.
Однако многие исследователи, изучавшие течение фиброза печени на фоне различных схем лечения, считают, что система Knodell мало информативна в качестве теста оценки развития процесса
вдинамике [16]. Количественная морфометрия с применением специфических окрасок препаратов ткани печени на волокна, входящие в состав фиброзной ткани, имеет более высокую чувствительность и лучше отражает происходящие изменения до и после лечения [17]. Широко используется фотоколориметрический метод, дающий возможность количественно оценивать фиброзные поля после морфологической окраски азаном [13]. Описанные методы оценки послужили основой для создания автоматизированных компьютерных моделей, позволяющих судить о прогрессировании/регрессии фиброза при обобщении данных, полученных после повторных биопсий печени через небольшие (1 год) промежутки времени [18]. Так, например, при окраске сириус красным и использовании компьютерного анализатора у больных хроническим гепатитом С можно оценить динамику отложения коллагеновых волокон в пределах портального тракта до и после проведения интерферонотерапии. Можно также определять распространенность фиброза в перицентральной зоне (зона 3) печеночной дольки путем вычисления коллагенового индекса и количественной оценки депозитов коллагена в пространствах Диссе [17].
Маркеры фиброза печени в сыворотке крови. С тех пор когда в 1974 г. впервые в сыво-
22

Лекции и обзоры
ротке крови были |
найдены |
белки, входящие |
в состав коллагена I типа, оценка компонентов |
||
экстрацеллюлярного |
матрикса |
с применением |
радиоиммунного метода получила широкое распространение. Сегодня в перечень определяемых компонентов входят различные типы коллагена, ламинин, фибронектин, гиалуроновая кислота, растворимые рецепторы фибронектина (интегринβ1), элементы систем, регулирующих синтез и деградацию экстрацеллюлярного матрикса (матрикс металлопротеиназы – ММП, ее тканевые ингибиторы – ТИММП), цитокины (TGF-β) и т. д. Динамика этих показателей широко используется для определения эффективности противовирусной терапии у больных хроническими вирусными гепатитами и оценки развития фиброза печени на фоне лечения α-интерфероном. В частности, показано, что у больных хроническим вирусным гепатитом С, у которых наблюдается ранний положительный вирусологический ответ, достоверно снижается в сыворотке крови концентрация проколлагена III, коллагена IV, ламинина и гиалуроновой кислоты [19].
Биохимические показатели фиброза в ткани печени. Метод определения общего количества коллагена в образцах биоптатов ткани печени с применением гидроксипролина известен давно. К высокочувствительным методам относят спектрофотоколориметрическое исследование с использованием окраски Fast green – Sirius red [11].
Исследование количества пиридинолина в моче. Пиридинолин является одним из продуктов синтеза коллагена в печени. Его уровень
вткани органа отражает распространенность фиброза и указывает также на возможность обратного развития последнего (зрелость фиброзной ткани). Пиридинолин выделяется с мочой как продукт деградации печеночного коллагена, а его концентрация в моче исследуется хроматографическим или иммунологическим методами [8].
Сегодня гепатологи активно изучают клинические и морфологические признаки, а также временны'е диапазоны трансформации хронического гепатита в цирроз печени. Детальное исследование указанной проблемы позволит значительно приблизиться к ответу на вопрос – является ли цирроз обратимой стадией хронического заболевания печени. Ответ на данный вопрос связан,
впервую очередь, с расшифровкой механизмов прогрессирования болезни и закономерностей регуляции процессов фиброгенеза на прецирротической (ранней цирротической) стадии хронического заболевания печени. На упомянутой стадии как компенсаторные возможности самой печени, так и небольшая давность и нестойкость фиброзных изменений позволяют использовать широкий спектр фармацевтических препаратов с целью затормозить и повернуть вспять дальнейшее прогрессирование болезни. На стадии клинических
проявлений цирроза, когда имеются устоявшиеся структурные изменения ткани печени, которые клинически подтверждаются наличием осложнений, потенциальные возможности для воздействия на фиброгенез значительно ниже. Учитывая временные интервалы и стадийность процесса, абсолютно необходимой является выработка диагностических критериев, позволяющих распознавать цирроз на ранней стадии его развития. Одна из систем, объединивших клинические и лабораторные критерии «раннего цирроза», предложена K. Ikeda и соавт. в 2000 г. [10]. Она учитывает такие показатели, как уровень γ-глобулина, гиалуроновой кислоты, тромбоцитов и пол пациента, которые путем перемножения дают индекс Z, коррелирующий с выраженностью фиброза печени: Z = 0,12 × (γ-глобулин, %) + 0,001 × (гиалуроновая кислота, μg/l) – 0,075 × (тромбоциты, × 10 000 μ/l) – 0,413 × пол (муж. 1/жен. 2) – 2,005. Положительные значения индекса соответствуют степени F3–F4 фиброза печени.
Клинико морфологическая характеристика трансформации хронического гепатита в цирроз печени
Существенный прогресс гепатологии за последние годы позволил идентифицировать множество этиологических факторов хронических заболеваний печени. С внедрением в киническую практику методик биопсии печени появилась возможность четко определять стадию заболевания и оценивать эффективность медикаментозной терапии. Проведение повторных биопсий у больных с прогрессирующим хроническим гепатитом позволило накопить большое количество морфологических данных, характеризующих период трансформации хронического гепатита в цирроз. Сегодня известно, что это растянутый во времени процесс перехода количественных структурных изменений в качественные. Вместе с тем собранных сведений недостаточно, чтобы четко провести грани между последовательными стадиями такого перехода.
Первые морфологические признаки цирроза появляются на фоне характерной для хронического гепатита гистологической картины. При наличии сохраняющейся активности хронического гепатита над проявлениями некроза и воспаления начинают преобладать процессы фиброгенеза, что в результате ведет к развитию цирроза печени. На данной стадии очень трудно отдифференцировать процесс регенерации гепатоцитов и восстановления структуры печени от дальнейшей перестройки гистоархитектоники органа в результате процессов фиброгенеза. На этой, ранней, стадии трансформации хронического гепатита в цирроз печени можно провести грань между порто-пор-
23

Лекции и обзоры
тальными и порто-центральными септами. Эти септы оказывают неодинаковое влияние на нарушение кровоснабжения ткани печени (по сосудам порто-центральных септ идет сброс крови в обход долек), однако и порто-портальные, и порто-цен- тральные фиброзные септы вызывают изменения гистоархитектоники печеночной ткани. Для корректного описания ранней стадии цирроза необходима очень четкая трактовка результатов биопсии: определение количественного соотношения порто-портальных и порто-центральных септ. Объективная оценка морфологической картины зависит от нескольких факторов: размера столбика ткани печени, полученного путем биопсии (оценивается 1/500 от всей ткани печени), пространственного расположения фиброзных изменений (в глубине паренхимы фиброзные изменения менее выражены, чем на периферии органа, в непосредственной близости к капсуле). Это особенно важно в случаях сравнительного изучения терапевтической активности препаратов, имеющих антифиброзный эффект, поскольку необходимо учитывать распространенность и локализацию фиброза до и после курса лечения [1–3].
Возможность обратного развития фиброза печени на ранней стадии цирроза
В литературе представлены результаты большого количества исследований, в которых изучалось влияние на динамику фиброза печени интерферонотерапии, назначенной по поводу хронического гепатита С, в частности, у пациентов со стойким вирусологическим ответом [2]. У этих больных по данным биопсии печени, проведенной сразу после лечения, наблюдалось уменьшение размеров портальных трактов и количества расположенных в них фиброзных волокон. В течение последующих 3–5 лет происходило постепенное уменьшение, а в некоторых случаях и исчезновение коллагеновых и ретикулярных волокон из пространств Диссе. Уменьшались размеры фиброзных полей, характерных для цирротической трансформации ткани печени. Подобная положительная динамика отмечалась у 67% больных циррозом на ранней стадии развития в течение 4–6 лет после окончания терапии [26]. Имеются также сведения о переходе со стадии фиброза F3 в стадию F2 в течение 3 лет после окончания курса лечения, значительном уменьшении количества коллагеновых волокон на стадии F4 (цирроз печени) [24]. Исследованиями американских авторов, которые изучали отсроченное влияние интерферонотерапии (через 10 лет после ее окончания), показано уменьшение фиброза со стадии F3 до F0 [14]. Результаты, подтверждающие динамику обратного развития фиброза, были получены как биохимическими, так и морфологическими
методами, которыми оценивалось количество коллагена непосредственно в ткани печени. Параллельно, судя по динамике уровней сывороточных маркеров – проколлагена III и коллагена IV, у пациентов со стойким вирусологическим ответом значительно уменьшалась выраженность некровоспалительной реакции и степени фиброза [23].
Несколько клинических исследований было посвящено изучению динамики морфологической картины ткани печени у больных вирусным циррозом печени класса А по Child–Pugh. Пациенты, включенные в исследование, были разделены на две группы: первая получала терапию в стандартные сроки (вирусологический ответ достигнут у 16% больных), во второй группе интерферон не назначался. Через 5–6 лет после окончания курса лечения проведено повторное морфологическое исследование ткани печени у всех пациентов. В группе получавших интерферон определялось значительное снижение уровня коллагена IV в сыворотке крови, при этом сравнительная оценка морфологических изменений ткани печени по системе Knodell существенной динамики фиброза не выявила [20].
У больных алкогольным циррозом печени на фоне длительного периода абстиненции отмечено улучшение морфологической картины печеночной ткани, уменьшение признаков портальной гипертензии и размеров варикозно-расширенных вен пищевода. Одновременно наблюдалось улучшение показателей синтетической функции печени [22].
Таким образом, полученные клинические данные подтвердили предположение о возможности обратного развития фиброза печени на стадии цирроза класса А по Child–Pugh. Необходимое условие для начала данного процесса – длительная элиминация этиологического фактора, вызвавшего повреждение печени (в случае вирусного поражения – интерферонотерапия, алкогольного – длительный период абстиненции). При выполнении данного условия наблюдаются ремоделирование цирротически измененной печени, торможение процесса «капилляризации синусоидов», уменьшение клинических признаков портальной гипертензии и улучшение синтетической функции органа (рис. 2).
Стратегия антифиброзной терапии и пути воздействия на процесс фиброгенеза
Механизмы обратного развития фиброза печени активно изучаются на клеточном и молекулярном уровнях. Последовательность и временные интервалы возникновения клинических признаков уменьшения степени фиброза тесно связаны с этапами нормализации морфологической картины ткани печени. Актуально дальнейшее изучение лечебных средств, показавших в условиях in vitro
24
Лекции и обзоры
Некро воспалительные и фиброзные изменения в печени
Перестройка дольковой структуры печени (обратное развитие в течение 5 лет)
Хронический гепатит
«Капилляризация синусоидов» |
Регенерация |
Формирование регенераторного узла
Обратное развитие в течение 10 лет
Структурно-функциональные нарушения гепатоцитов
Развитие цирроза печени
Сужение синусоидов
Обратное развитие в течение 20 лет
Портальная гипертензия
Образование коллатералей
(варикозно-расширенные вены пищевода,сплено-ренальные анастомозы и т. д.)
Обратимый цирроз печени
Необратимый цирроз печени
Печеночная недостаточность
Рис. 2. Прогрессирование хронического гепатита и возможность его обратного развития при устранении этиологического фактора
антифиброзное действие. Создание идеального антифиброзного препарата предопределяется ответом на вопрос о возможности специфического влияния на звездчатые клетки печени, регулирующие баланс между процессами синтеза и деградации экстрацеллюлярного матрикса. Сегодня можно говорить о нескольких группах препаратов, воздействующих на процесс фиброгенеза, например, антицитокиновых средствах, блокирующих профибротические цитокины, такие как TGF-β. Их применение требует очень тщательной оценки возможных побочных эффектов, вызванных системным действием цитокинов. Разработка препаратов, способных избирательно блокировать процесс фиброгенеза в печени, лимитируется необходимостью их пригодности для длительного применения, так как процесс обратного развития фиброза сильно растянут во времени. Аналогичные требования предъявляются и к препаратам, оказывающим влияние на этиологические факторы, повреждающие печень. Обсуждается вопрос о создании лекарств, воздействующих на фиброз-
ные изменения в печени после элиминации этиологического фактора (по достижении вирусологического ответа на интерферонотерапию или после длительного периода абстиненции).
У больных алкогольной болезнью печени этиологический фактор, вызывающий повреждение печени, может быть элиминирован путем длительного воздержания от приема алкоголя. Данная болезнь представляет хорошую модель для изучения процессов регрессии фиброза. При алкогольном циррозе после прекращения употребления алкоголя через определенные временные интервалы наблюдается уменьшение количества миофибрилл актина в стенках синусоидов, что свидетельствует о падении активности звездчатых клеток. Спустя 4–10 нед после прекращения приема алкоголя уменьшается количество коллагена IV типа, а также ламинина и гиалуроновой кислоты в стенках синусоидов. То есть можно говорить о регрессии процесса «капилляризации синусоидов» [25]. Через короткий период абстиненции отмечается изменение в соединительнотканных прослойках,
25

Лекции и обзоры
окружающих регенераторные узлы. В них начинают доминировать эластические волокна, которые относятся к наиболее сложно поддающимся обратному развитию соединительнотканным элементам [22]. По данным биохимических анализов крови у больных алкогольным циррозом печени определяется тенденция к нормализации показателей коллагена IV, ламинина и гиалуроновой кислоты. Повышается уровень ММП-2 и снижается уровень ее ингибитора (ТИММП-2) [25]. Таким образом, после начала абстиненции функциональная активность звездчатых клеток переключается от процессов синтеза компонентов экстрацеллюлярного матрикса и блокирования процессов деградации к значительному увеличению активности деградации последнего. Это служит свидетельством инициации процесса деструкции компонентов коллагеновых мембран.
На мышиных моделях изучен процесс фиброгенеза, вызванный введением четыреххлористого углерода. После прекращения его введения отмечено быстрое уменьшение и исчезновение фиброзных изменений в мышиной печени. Механизм этих изменений, вероятнее всего, связан с повышенной экспрессией генов матриксметаллопротеиназ и блокированием экспрессии генов, ответственных за синтез их ингибиторов. Результатом этого является преобладание активности систем деградации экстрацеллюлярного матрикса. В эксперименте с использованием метода гибридизации in situ были получены высокие концентрации мРНК ММП-13, подтвердившие данное предположение [21].
Можно ли говорить об уменьшении портальной гипертензии у больных циррозом печени на фоне регрессии фиброза? Хотя положительный ответ на данный вопрос прямо не указывает на возможность обратного развития фиброза на стадии цирроза печени, все же уменьшение портальной гипертензии косвенно свидетельствует о том, что цирроз
– потенциально обратимая стадия. Это предположение может быть подтверждено и наличием положительной динамики показателей синтетической функции печени. У больных декомпенсированным циррозом радикальное снижение уровня портальной гипертензии достигается путем наложения TIPS и других порто-кавальных шунтов. Работы по изучению изменения портального давления у данной группы больных на фоне положительной динамики фиброза в печени (по данным морфологического исследования) сегодня не проводятся.
Препараты с антифиброзным действием
Как было сказано выше, прогрессирование фиброза – это результат дисбаланса между процессами его синтеза и деградации, т. е. количество фиброзных волокон увеличивается, если про-
цессы их синтеза преобладают над процессами деградации.
Интерферон-γ воздействует непосредственно на звездчатые клетки печени, блокируя их синтетическую активность. В результате такого воздействия уменьшается синтез РНК проколлагена I типа [5]. Аналогичным, но менее выраженным по активности эффектом обладает интерферон-α. Он также блокирует синтез РНК проколлагена I, III, IV типов посредством угнетения синтеза РНК TGF-β в купферовских клетках печени [7].
На фиброгенез активно влияют препараты, блокирующие синтез пуриновых оснований – HGF. Данная группа препаратов получила свое название от фермента, катализирующего одну из основных реакций синтеза пуриновых оснований, – гипо- ксантин-гуанин-фосфорибозил трансферазы. Ведущий механизм действия HGF связан с блокированием синтеза РНК проколлагена, TGF-β и десмина. В то же время HGF потенцируют активность ММП и таким образом стимулируют деградацию экстрацеллюлярного матрикса.
Активно изучаемым направлением является создание препаратов, блокирующих синтез и усиливающих деградацию экстрацеллюлярного матрикса или моделирующих активность регуляторных цитокинов. Представители этой группы – ингибиторы пролил-4-гидроксилазы (ключевой фермент в синтезе коллагена) метаболизируются в печени и обладают антифиброзными свойствами, что было продемонстрировано в экспериментальных условиях [6].
Нео-минофаген С, в состав которого входят глицирризин и глицин, ингибирует синтез коллагена звездчатыми клетками печени [26].
Основной механизм действия препаратов, в состав которых входят протеогликаны, взаимодействующие с TGF-β, состоит в блокировании рецепторов TGF-β2, что приводит к уменьшению синтеза коллагена [24].
Рецепторы ангиотензина-2 расположены на мембранах звездчатых клеток. Указанные рецепторы регулируют уровень портального давления. Их блокада приводит к падению уровня TGF-β, вследствие чего уменьшается активность процесса синтеза коллагена [13].
Применение лектинсодержащих средств растительного происхождения рассматривается как одно из перспективных направлений антифиброзной терапии. Механизм действия лектинов связан с конкурентным блокированием взаимодействия гепатотропных вирусов с олигомерными лектинами на клеточной мембране гепатоцитов [15]. Результаты клинических испытаний показали, что длительный (не менее года) прием больными хроническими вирусными гепатитами препаратов (в частности искадора), содержащих лектины, сопровождается уменьшением продукции коллагена IV типа, провоспалительных (TNF-α)
26

Лекции и обзоры
и просклерогенных (TGF-β, FGF-β, фибронектин) цитокинов [3].
Внутрипеченочные коллатерали и восстановление кровотока в печени
Изучение морфологических изменений в ткани печени у больных алкогольным циррозом показало, что у части из них на фоне абстиненции быстро наступают изменения в сторону уменьшения признаков цирроза. В то же время у некоторых пациентов морфологические изменения имеют более стойкий характер и мало зависят от воздержания от приема алкоголя. Это обусловлено тем, что обратимость цирроза печени во многом зависит от распространенности и степени развития коллатерального кровообращения. После отказа от приема алкоголя у отдельных больных наблюдаются уменьшение количества коллагеновых волокон в интерстициальных пространствах и постепенное исчезновение псевдодолек, в результате чего падает давление во внутрипеченочных сосудах, которые постепенно расширяются. Конечным итогом данного процесса служит снижение портальной гипертензии и, как следствие, уменьшение размеров варикозно-расширенных вен пищевода [22]. Такие изменения не обнаруживаются в группе больных, у которых, несмотря на длительный период абстиненции (до 9 лет), не наблюдается регенерации сосудов с восстановлением венозного русла печени и, как результат, сохраняется высокий уровень портального давления. Сосудистая недостаточность печени у этих больных способствует дальнейшему прогрессированию цирроза и развитию печеночной недостаточности. Таким образом, становится актуальной проблема диагностики стадии развития коллатеральных сосудов, на которой сохраняется способность вновь образованных сосудов к пролиферации и восстановлению нормального кровообращения в печени. Это обеспечило бы в дальнейшем возможность обратного развития структурных признаков цирроза. Сегодня известно, что процесс пролиферации сосудов регулируется факторами роста эндотелия – ангиопоэтином I, II, а в самих сосудах имеются рецепторы для этих факторов – ТИК I, II (чем тяжелее гипоксия в ткани, тем выше уровень эндотелиопоэтина). Проблема состоит в том, что вновь образованные сосуды в печени функционально незрелые и количество рецепторов для эндотелиопоэтина в их стенках меньше, чем в полноценных сосудах.
Фибро и канцерогенез в печени
Существует достоверная связь между прогрессирующим процессом фиброза печени и частотой развития гепатоцеллюлярной карциномы [13]. Из этого следует, что профилактика развития ге-
патоцеллюлярной карциномы должна включать меры, направленные на предупреждение прогрессирования фиброза печени. Например, при вирусном циррозе очень важно знать, когда можно добиться элиминации вируса на фоне противовирусной терапии и когда ожидать рецидива инфекции. Длительные сроки наблюдения за 5 пациентами с вирусным циррозом печени показали, что в результате успешной элиминации вируса в течение более 10 лет после окончания курса лечения наблюдалось улучшение гистологической картины ткани печени (в том числе уменьшение степени фиброза). Биопсия проводилась в динамике через 5 и 10 лет после завершения терапии. У всех обследованных данной группы сохранился положительный результат полимеразной цепной реакции (ПЦР) на вирус гепатита B в ткани печени, а индекс гистологической активности оценивался как минимальный [12].
Входе длительного наблюдения за больными
сHCV циррозом печени (19 лет и более), у которых после успешно завершенного курса противовирусной терапии все же оставались положительные антитела к вирусу и результат ПЦР в сыворотке крови был отрицательным, установлено, что в ткани печени у них сохраняются маркеры репликации вируса гепатита С. Однако при повторных биопсиях печени отмечено улучшение гистологической картины с одновременной нормализацией печеночных функциональных тестов и уменьшением признаков портальной гипертензии. Таким образам, несмотря на персистенцию вируса в ткани печени, курс комбинированной терапии позволил предупредить дальнейшее прогрессирование цирроза [14]. Согласно отдаленным результатам другого клинического исследования, в котором оценивалась эффективность курса противовирусной терапии у 15 больных вирусным циррозом печени, наблюдалась нормали-
зация печеночных функциональных тестов в среднем через 7 лет после документированного при повторных биопсиях улучшения морфологической структуры ткани печени [14].
Заключение
Сегодня нет единого мнения, определяющего подходы к лечению фиброза и цирроза печени. Основное условие успешной антифиброзной терапии – значительная ее продолжительность, которая позволила бы печеночным клеткам восстановить свою функциональную активность. Эффективный курс лечения способствует восстановлению архитектоники печеночной дольки, устранению капилляризации синусоидов, уменьшению количества регенераторных узлов (ложных долек) и приводит если не к морфологическому, то к функциональному исчезновению коллатеральных сосудов. При далеко зашедшем циррозе печени, когда имеется полная пере-
27

Лекции и обзоры
стройка печеночной ткани с образованием коллатеральных сосудов (одно из классических проявлений цирроза печени), назначение препаратов с действием, направленным на элиминацию этиологического фактора болезни, также приводит к улучшению функционального состояния и частичной нормализации морфологической картины печени. Необходимо помнить, что назначение лечения данной группе больных не исключает возможности дальнейшего прогрессирования заболевания с развитием печеночной недостаточности. Наличие у мелких коллатеральных сосудов потенциала регенерации и возмож-
Список литературы
1.Галимова С.Ф., Маевская М.В., Ивашкин В.Т. и др. Динамика биохимических, вирусологических и гистологических характеристик хронического гепатита В на фоне лечения ламивудином и интерфероном-α // Рос. журн. гастроэнтерол., гепатол., колопроктол. – 2003. –
Т.13, № 1 (прил. 18). – С. 7.
2.Ивашкин В.Т., Павлов Ч.С., Левина А.А. и др. Сравнительный анализ сывороточных показателей обмена железа у больных хроническими вирусными гепатитами с различным индексом гистологической активности гепатита // Рос. журн. гастроэнтерол., гепатол., колопроктол. – 2001. – Т. 11, № 5 (прил. 15). – С. 84.
3.Павлов Ч.С., Ивашкин В.Т., Шульпекова Ю.О., Золотаревский В.Б. Современные представления о патогенезе, диагностике и лечении фиброза печени // Рос. журн. гастроэнтерол., гепатол., колопроктол. – 2005. –
Т.15, № 2. – С. 13–20.
4.Шульпекова Ю.О., Ивашкин В.Т., Мамаев С.Н. и др. Уровень трансформирующего фактора роста-1β (TGF1β) в сыворотке крови и показатели клеточного иммунитета у больных хроническим гепатитом С (ХГС) // Рос. журн. гастроэнтерол., гепатол., колопроктол. – 2001. – Т. 11, № 1 (прил. 12). – С. 14.
5.Baroni G.S., D’Ambrosio L., Curto P. et al. Interferon gamma decreases hepatic stellate cell activation and extracellular matrix deposition in rat liver fibrosis // Hepatology. – 1996. – Vol. 23. – P. 1189–1199.
6.Bickel M., Baringhaus K.-H., Gerl M. et al. Selective inhibition of hepatic collagen accumulation in experimental liver fibrosis in rats by a new prolyl 4-hydroxy- lase inhibitor // Hepatology. – 1998. – Vol. 28. – P. 404–411.
7.Granstein R.D., Flotte T.J., Amento F.P. Interferon and collagen production // J. Invest. Dermatol. – 1990. – Vol. 95. – P. 75–80.
8.Grenard P., Blanquier B., Richard-Blum S.R. Urinary excretion of the collagen cross-link pyridinoline increases during liver fibrogenesis // J. Hepatol. – 1997. – Vol. 26. – P. 1356–1362.
9.Ichida F., Omata M., Tsuji T. et al. Histological classification of chronic hepatitis – New Inuyama classification. The proceedings of the 19th Inuyama symposium. – Tokyo: Chugai-Igakusya, 1996. – P. 183–188 (in Japanese).
10.Ikeda K., Saitoh S. Kobayashi M. et al. Distinction between chronic hepatitis and liver cirrhosis in patients with hepatitis C virus infection. Practical discriminant function using common laboratory data // Hepatol. Res. – 2000. – Vol. 18. – P. 252–266.
11.Jimenez W., Pares A., Caballeria J. et al. Measurement of fibrosis in needle liver biopsies: evaluation of a colorimetric method // Hepatology. – 1985. – Vol. 5. – P. 815–818.
12.Kobayashi M. Kumada H. Effect in the course of type C chronic hepatitis // Acta Hepatol. Jpn. – 1998. – Vol. 39 (suppl. 1). – P. 96 (in Japanese).
ности образования новых сосудов является залогом обратимости цирроза печени, отсутствие – показателем ограниченной эффективности антифиброзной терапии.
В настоящее время цирроз печени рассматривается как терминальная потенциально необратимая стадия заболевания печени. Однако накопленные за последние годы данные говорят в пользу предположения об обратимости цирроза и возможности появления в недалеком будущем препаратов, позволяющих активно воздействовать на процесс фиброгенеза.
13.Kobayashi T., Sakamoto T., Katayama K. et al. Estimation of liver fibrogenesis in type C chronic hepatitis patients with hepatocellular carcinoma // Acta Hepatol. Jpn. – 2000. – Vol. 41 (suppl. 2). – P. 453 (in Japanese).
14.Lau D.T.-Y., Kleiner D.E., Ghany M.G. et al. 10-year follow-up after interferon-α therapy for chronic hepatitis C // Hematology. – 1998. – Vol. 28. – P. 1121–1127.
15.Losach P.G., Lortat-Jacob H., De Lacroix A. et al. DCSING and L-SING are high affinity binding receptors for hepatitis C virus glycoprotein E2 // J. Biol. Chem. – 2003. – Vol. 278, N 22. – P. 20358–20366.
16.Maeyama S., Koike A., Sohda F. et al. Evaluation of liver morphology in management and etiology in chronic hepatitis // Minophagen Med. Rev. – 1998. – Vol. 43. – P. 27–35 (in Japanese).
17.Manabe N., Chevallier M., Chossegros P. et al. Interferon-α 2b therapy reduce liver fibrosis in chronic Non-A, Non-B hepatitis. A quantitative histological eval-
uation // Hepatology. – 1993. – Vol. 18. –
P.1334–1349.
18.Moriyama M. Shimizu T., Arakawa Y. Is liver cirrhosis reversible? – From the scoring of liver fibrosis // Acta Hepatol. Jpn. – 2000. – Vol. 41 (suppl. 2). –
P.347 (in Japanese).
19.Murakami Y., Ikuta Y., Koda M., Kawasaki H. Serum type III procollagen peptide, type IV collagen 7S domain, central triple-helix of type IV collagen and tissue inhibitor of metalloproteinase in patients with chronic viral liver disease: relationship to liver histology // Hepatology. – 1994. – Vol. 20. – P. 780–787.
20.Nishiguchi S. Nakatani S., Kuroki T. Preventive effect of hepatocellular carcinoma by treatment of IFN in type C liver cirrhosis // Frontier of Hepatology / Eds. M. Yamanaka, H. Takikawa. – Tokyo: Chugai-Igakusha, 1997. – P. 116–120 (in Japanese).
21.Okazaki I., Hozawa S., Ishikawa A., Watanabe T.
Final purpose of liver fibrosis research: Development of treatment for liver cirrhosis // Saishin Igaku. – 2000. – Vol. 55. – P. 1725–1734 (in Japanese).
22.Otake H. Diagnostic problems of clinical criteria for liver cirrhosis – from a view point of laparoscopy // Gastroenterology. – 2000. – Vol. 31. – P. 165–174 (in Japanese).
23.Reichard O., Glaumann H. Norkrans G. et al. Histological outcome in patients with chronic hepatitis C given a 60-week interferon alfa-2b treatment course // Liver. – 1994. – Vol. 14. – P. 169–174.
24.Sato A., Suzuki H. Long-term prognosis of patients with type C chronic hepatitis treated by interferon // Acta Hepatol. Jpn. – 1998. – Vol. 39. – P. 789–791 (in Japanese).
25.Tutsumi M. Takase S. Reversibility of liver fibrosis in alcoholic liver injury // Acta Hepatol. Jpn. – 2000. – Vol. 41. – P. 621–622 (in Japanese).
26.Yokosuka O., Fujiwara K. Improvement of liver fibrosis 3–5 years after effective treatment of chronic hepati-
28

Лекции и обзоры
tis by interferon // Is interferon therapy effective for liver fibrosis in type C chronic hepatitis? / Eds. G.
Toda, M. Omata, I. Okazakj et al. – Tokyo: ChugaiIgakusha, 1996. – P. 88–91 (in Japanese).
An option of reversible development of liver cirrhosis (clinical and pathogenetic prerequisites)
Ch.S. Pavlov, V.B. Zolotarevsky, M.S. Tomkevich, Ye.A. Kogan, V.T. Ivashkin
Article presents basic pathogenetic mechanisms, morphofunctional features and diagnostic criteria of fibrosis at the stage of chronic hepatitis to liver cirrhosis transition. Modern approaches and options of therapeutic impact on fibrogenesis process, including the cirrhotic (viral, alcoholic) stage are listed. Basic groups of up-to-day drugs with antifibrotic effect and their mechanisms of action are presented. Effect of cirrhotic liver revascularization on the progression of fibrosis is discussed.
Key words: fibrosis, viral, alcoholic liver cirrhosis, revascularization, interferon, abstinence, drugs with antifibrotic effect.
29

Лекции и обзоры
УДК [616.348+616.35] 006.6 07
Хемопрофилактика колоректального рака. Возможности урсодезоксихолевой кислоты
М.И. Секачева
(Научная группа при кафедре пропедевтики внутренних болезней Московской медицинской академии им. И.М. Сеченова)
В статье рассмотрено действие различных препаратов, применяемых с целью профилактики колоректального рака, в том числе урсодезоксихолевой кислоты. В экспериментах на различных моделях животных и в клинических исследованиях с участием больных, страдающих неспецифическим язвенным колитом, и пациентов, перенесших резекцию аденоматозных полипов, урсодезоксихолевая кислота зарекомендовала себя как эффективный препарат для предотвращения развития дисплазии, аденом и колоректального рака.
Ключевые слова: урсодезоксихолевая кислота, профилактика колоректального рака.
Колоректальный рак занимает по частоте четвертое место в мире среди злокачественных новообразований. Ежегодно им забо-
левает 950 000 человек, из них 500 000 умирают. Высокий уровень заболеваемости отмечается в странах Северной Америки, Европы, в Австралии. В России ежегодно регистрируется 46 тыс. впервые выявленных больных колоректальным раком, причем от 20 до 50% уже на стадии отдаленных метастазов.
В настоящее время профилактические мероприятия сконцентрированы преимущественно на раннем выявлении рака толстой кишки и предраковых изменений, в частности аденоматозных полипов. Разработанные профилактические программы включают анализ кала на скрытую кровь ежегодно или эндоскопический скрининг. В то же время продолжается поиск мер первичной профилактики, т. е. способов изменения стиля жизни, диеты, влияний окружающей среды, с тем чтобы предотвратить возникновение нарушений на клеточном уровне. Одним из таких методов является хемопрофилактика.
Обсуждая вопрос хемопрофилактики колоректального рака, в первую очередь, следует рассмотреть возможности получения доказательной базы, исходя из правил медицины, основанной на доказательствах. Хотя собран достаточно большой экспериментальный и клинический материал по различным вариантам хемопрофилактики, в том числе по применению урсодезоксихолевой кислоты (УДХК), говорить о возможности исследований предназначаемых для этого препаратов в общей
популяции с точки зрения доказательной медицины нельзя. Более того, частота колоректального рака в общей популяции в год настолько мала, что делает проведение рандомизированного исследования среди населения нецелесообразным. Новые случаи рака в группе старше 55 лет встречаются приблизительно в пропорции 50 случаев на 100 000 в год. Если эффективность гипотетического хемопрофилактического препарата в отношении снижения риска достигает 30% и в исследовании примет участие 200 000 человек, в группе принимающих препарат через 5 лет будет зафиксировано 180 случаев рака, а в группе контроля – 250 случаев. Эта разница, вероятно, может быть еще меньше за счет выбывания участников из исследования в связи с несоблюдением назначенного режима или по другим причинам. Кроме того, вряд ли какой-либо профилактический препарат способен снизить на 30% риск заболевания [13].
Более привлекательны для проведения исследования группы высокого риска развития колоректального рака, а именно пациенты с диагностированными аденомами, воспалительными заболеваниями кишечника, наследственными синдромами рака данной локализации. Хорошо известно, что при наличии аденомы в толстой кишке, особенно крупной, вероятность обнаружения второй аденомы или рецидива после удаления новообразования достаточно высока. Проведение исследований хемопрофилактических препаратов
вуказанной группе лиц становится соответственно более реальным. Кроме того, эти пациенты
влюбом случае должны находиться под наблюде-
30
