
6 курс / Гастроэнтерология / Российский_журнал_гастроэнтерологии,_гепатологии,_колопроктологии (1)
.pdf
Таблица 2. Лечение острого панкреатита
в ранние сроки (панкреато генный шок, токсемия)
•Нивелирование волемических и гемодинамиче ских расстройств (инфузионная терапия, далар гин)
•Подавление ферментативной функции железы (цитостатики – 5 фторурацил, сандостатин)
•Ингибирование циркулирующих в крови фер ментов введением ингибиторов протеаз: гордокса, контрикала
•Выведение ферментов и цитотоксинов из тка ней и жидкостей организма (форсированный диу рез, гемосорбция, плазмаферез, лимфосорбция, лапароскопический диализ)
•Восстановление водно электролитных расст ройств (инфузионная терапия – введение раство ров, содержащих калий и магний, свежезаморо женной плазмы, альбумина)
•Адекватное обезболивание, включая использо вание эпидурального катетера
•Профилактика гнойных осложнений путем ан тибиотикотерапии (тиенам, цефалоспорины III по коления, метрагил)
•Коррекция иммунных нарушений (тимические препараты, пентаглобин)
•Энтеральное зондовое питание с использовани ем сбалансированных смесей
операции определяются в зависимости от тяжести клинического течения и характера полиорганных осложнений. Принципы патогенетически направленного лечения представлены в табл. 2.
Одно из неотложных мероприятий при панкреонекрозе – борьба с болью. Купирование болевого синдрома у многих больных достигается применением анальгетиков и спазмолитических препаратов. При отсутствии обезболивающего эффекта необходимо выполнить новокаиновую блокаду ретропанкреатической клетчатки.
Не менее важным лечебным мероприятием при ОП является создание функционального покоя ПЖ. С этой целью проводится аспирация не только желудочного, но и дуоденального содержимого. Постоянная аспирация желудочного и дуоденального содержимого через назогастральный зонд устраняет нейрогуморальные влияния соляной кислоты желудочного сока и дуоденального химуса на секрецию ПЖ. Удалением желудочного содержимого и дуоденального химуса достигается разрыв ферментосубстратных и парасубстратных взаимоотношений в двенадцатиперстной кишке.
Постоянная аспирация желудочного и дуоденального содержимого у больных ОП применяется в течение первых суток от начала заболевания. После прекращения постоянной аспирации проводится коррекция гомеостаза с помощью внутрикишечного введения мономерноэлектролитных растворов. Для этой цели с помощью гастродуоденоскопа в тощую кишку на 25–30 см за связку
Российский журнал
Трейтца мы вводим полихлорвиниловый зонд d = 0,5 см. С помощью аппарата “Инфузомат” осуществляем интестинальное введение растворов и питательных смесей.
При появлении самостоятельных кишечных шумов в качестве лечебного питания назначаем легкоусвояемые препараты для энтерального питания (инпитан, нутрихим). Целесообразность назначения раннего энтерального лечебного питания больным ОП обосновывается тем, что голодание усиливает темп липолиза, вызывает развитие гипо- и диспротеинемии, метаболитического ацидоза, снижение объема циркулирующей крови, углубление дегенеративных изменений в ПЖ.
Вкомплексных лечебных мероприятиях при ОП особенно важно применение медикаментозных средств, угнетающих процессы липолиза и протеолиза. В связи с этим отметим, что липолиз стимулируется катехоламинами, глюкагоном, кортизолом, стрессом, голоданием и может быть заторможен глюкозой, инсулином, никотиновой кислотой, β-адренергическими блокаторами.
Вкомплексное консервативное лечение больных ОП обязательно включают инфузии эуфиллина, глюкозо-новокаиновой смеси, белковых препаратов, электролитных растворов и др. Концентрированные растворы глюкозы, применяемые при ОП для обеспечения энергетических потребностей, стимулируют секрецию инсулина и тем самым подавляют липолиз.
Винфузионной терапии особое внимание уделяется парентеральному введению альбумина, свежезамороженной плазмы, реополиглюкина. Альбумин является носителем жирных кислот плазмы крови. При оптимальной концентрации альбумина в крови снижается уровень циркулирующих свободных жирных кислот. Внутривенное введение альбумина способствует нейтрализации токсических продуктов липолиза вследствие связывания их в неактивные комплексы, нормализации онкотического давления плазмы, уменьшению отека ПЖ и прилежащих к ней тканей. Оптимальным является переливание до 200 мл альбумина ежедневно в течение первых 4–5 дней от начала заболевания.
При внутривенном введении реополиглюкина уменьшается агрегация форменных элементов крови, улучшаются ее реологические свойства и микроциркуляция. При прогрессирующем течении ОП считаем показанным проведение форсированного диуреза.
Учитывая, что при ОП наблюдается тенденция к гиперкоагуляции крови, всем больным назначаем гепарин по 40 000 ЕД в сутки. Применение гепарина в первые дни от начала заболевания предупреждает развитие коагулопатического синдрома, стабилизирует активность липопротеидной липазы. Гепарин улучшает процессы микроциркуляции за счет уменьшения проницаемости капилляров и воздействия на процессы коагуляции.
гастроэнтерологии, гепатологии, |
2/2000 |
71 |
В предупреждении развития синдрома диссеминированного внутрисосудистого свертывания мы придерживаемся рекомендаций В.С. Савельева и соавт., которые при ОП применяют внутривенные инфузии никотиновой кислоты из расчета 3 мг/кг, эуфиллина – 10 мг/кг, реополиглюкина – 15 мг/кг, контрикала – 100 ЕД/кг, гепарина – 50 000 ЕД/кг в сутки. Применение этой смеси способствует стабилизации липопротеидной липазы – “фактора просветления”, снижению транзиторной гипертриглицеридемии.
Гиперлипемия при ОП является одним из факторов повышения коагулирующих свойств крови. Поэтому внутривенное введение гепарина, эуфиллина, никотиновой кислоты, глюкозо-новока- иновой смеси с инсулином (средств, угнетающих внутриклеточный липолиз) благоприятно сказывается на течении заболевания.
Для коррекции электролитных нарушений используем гипертонические растворы солей соответствующих ионов К, Na и Са. В зависимости от степени выраженности кислотно-щелочного равновесия назначаем внутривенное введение рассчитанного количества 7,4% раствора хлористого калия (при алкалозе) и 5% раствора соды (при ацидозе). Для усиления анаболического эффекта считаем целесообразным назначение ретаболила, витаминов С, В1 и В6. Кроме анаболического эффекта, витамины оказывают антибактериальное действие и уменьшают проницаемость капилляров.
Форма острого панкреатита
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Отечная |
|
|
|
|
Некротическая |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Консервативное |
|
|
|
|
|
Спиральная КТ, |
|
||||||
|
лечение |
|
|
|
КТ с контрастированием |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Интенсивная |
|
|||
|
|
|
|
|
|
|
и антибактериальная терапия |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
Терапия неэффективна: |
|
|
|
|
|
|
|||||||
|
инфицирование, острый |
|
|
Ответ на терапию |
|
|||||||||
|
живот, некрозы более 50% |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Хирургическое |
|
|
Консервативное |
|
|||||||
|
|
|
лечение |
|
|
лечение |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 4. Патогенез полиорганной недостаточности при деструктивном панкреатите (по У. Виндмайеру, Б. Рау, Г. Бегеру, 1997)
В комплексную терапию при тяжелой степени течения панкреонекроза, кроме общепринятой дезинтоксикационной и заместительной, включаем эндолимфатическое введение даларгина и антибактериальных средств. Для коррекции эндотоксикоза, а также микроциркуляторных и реологических нарушений используем экстракорпоральные методы – гемосорбцию, плазмаферез и плазмосорбцию.
Лечебная тактика зависит не только от формы ОП, но и от эффективности лечебных мероприятий (рис. 4). Во многом ею определяются результаты видеолапароскопического исследования.
При выявлении во время диагностической видеолапароскопии бактериального перитонита, секвестров ПЖ в сальниковой сумке, деструктивных изменений в парапанкреатичекой клетчатке, то есть гнойно-некротических процессов, выполняются срединная лапаротомия, санация брюшной полости и сальниковой сумки, назоинтестинальная и гастральная интубация с последующим наложением устройства для сближения краев раны (лапаростомия) типа “молния” или магнитного запирательного устройства. Этим больным проводятся программированная санация сальниковой сумки и брюшной полости, некр- и/или секвестрэктомия.
Консервативное лечение проводят по указанной методике.
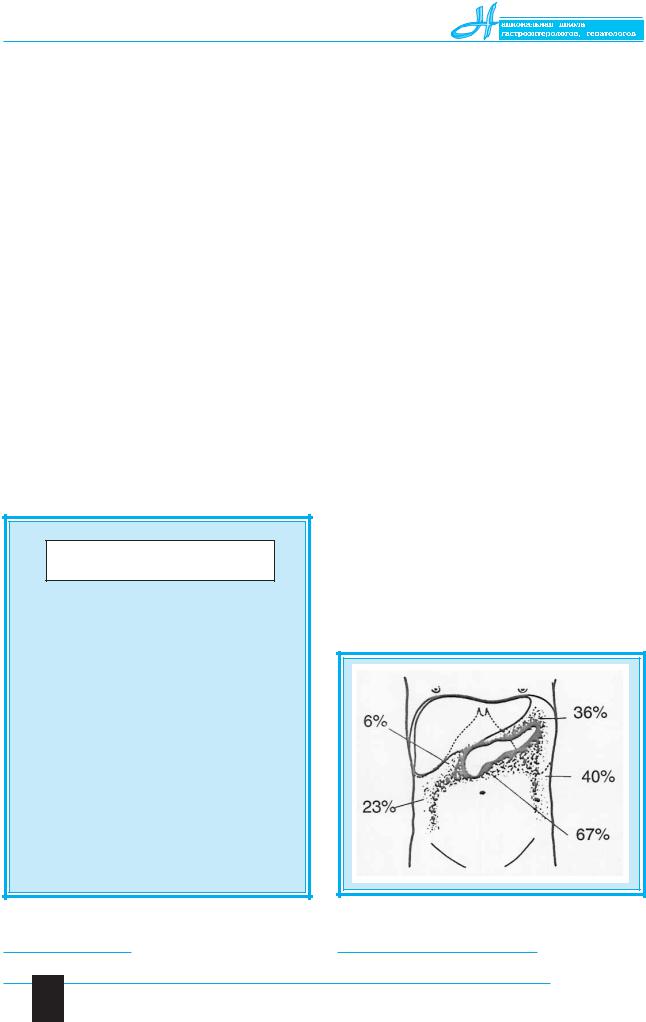
Под влиянием комплексного лечения более чем у половины больных уменьшаются клинические проявления и улучшаются лабораторные показатели, несмотря на прогрессирование патоморфологических изменений и даже развитие гнойнонекротических изменений. Особенно опасно развитие парапанкреатита, когда деструктивный процесс распространяется на забрюшинную клетчатку (рис. 5).
Существует немало классификаций гнойно-не- кротических осложнений ОП. Представляем одну из них.
Рис. 5. Частота развития забрюшинных некрозов при деструктивном панкреатите
Российский журнал
72 |
2/2000 |
гастроэнтерологии, гепатологии, колопроктологии |

Классификация гнойно-некротических осложнений деструктивного панкреатита (Ю.А. Нестеренко и соавт., 1992)
1.По характеру гнойно-некротического процесса
1.1.Стерильный некроз
•в поджелудочной железе
•в забрюшинной клетчатке
1.2.Стерильное жидкостное образование (псевдокиста)
•в поджелудочной железе
•в забрюшинной клетчатке
•в сальниковой сумке
1.3.Инфицированный некроз
•в поджелудочной железе
•в забрюшинной клетчатке
1.4.Гной в виде жидкостного образования (“абсцесс”)
•в поджелудочной железе
•в забрюшинной клетчатке
•в сальниковой сумке
1.5.Смешанные формы, то есть сочетание омертвевших тканей с жидкостными образованиями (стерильные или инфицированные)
2.По локализации
2.1.Внебрюшинные (в некрозе позади задней париетальной брюшины, в том числе в брыжейках кишки)
2.2.Внутрибрюшинные (в жидкостных образованиях между листками брюшины)
3.Отделы в забрюшинной клетчатке (по частоте обнаружения жировых некрозов и гнойных осложнений)
3.1.Мезоколон
3.2.Ретропанкреатический
3.3.Корень брыжейки тонкой кишки
3.4.Параколический
3.5.Паранефральный
Хирургическое лечение ОП включает широкий набор оперативных вмешательств [9]:
1)лапароскопический лаваж брюшной полости;
2)лапаротомия без вмешательств на ПЖ;
3)абдоминизация ПЖ;
4)оментопанкреатопексия;
5)корпорокаудальная резекция ПЖ;
6)панкреатонекрэктомия и панкреатосеквестрэктомия;
7)криодеструкция ПЖ;
8)дренирование гнойного очага;
9)резекция ПЖ или некрэктомия.
На 5-м Всероссийском съезде хирургов (Свердловск, 1978) было рекомендовано выполнять оперативное вмешательство у больных ОП при возникновении панкреатогенного перитонита, гнойного панкреатита и гнойных осложнений, сочетании ОП с заболеванием желчевыводящих путей. В резолюции VI конференции хирурговгепатологов России и других стран СНГ (Тула, 1996) эти рекомендации уточнены: “На фоне вы-
Российский журнал
раженных гемодинамических расстройств ранние оперативные вмешательства обычно ухудшают состояние больных.
В ранние сроки заболевания предпочтительны чрескожные способы билиарной декомпрессии и лапароскопическое дренирование брюшной полости при наличии перитонита.
Среди методов оперативного лечения наиболее эффективными и обоснованными следует рассматривать многократные некрозосеквестрэктомии, а также дренирование зон некроза и активное удаление гнойно-некротического секрета под контролем лапароскопа и УЗ визуализации”.
Целиком разделяя эти рекомендации, можно добавить важную роль динамического компью- терно-томографического исследования, которое позволяет выявлять очаги деструкции в самой железе и забрюшинной клетчатке и дренировать их из небольших по размеру доступов, как указано на рис. 6.
Подводя итоги, необходимо отметить, что наиболее высокие летальность и частота гнойно-не- кротических осложнений наблюдались у больных, оперированных на высоте ферментной токсемии. У многих из них допущены тактические и технические ошибки в связи с неправильным выбором оперативного доступа, неполноценной ревизией ПЖ и неэффективным дренированием. Это позволяет считать, что расширение объема оперативного пособия и показаний к нему в ранние сроки у больных с высоким риском летально-
Рис. 6. Дренирование при деструктивном панкреатите и его осложнениях
гастроэнтерологии, гепатологии, |
2/2000 |
73 |

Таблица 3. Летальность при остром панкреатите в 1991–1997 гг.
|
|
Из них умерли, |
|
|
Послеоперационная |
|
|
|
Не оперирова |
Оперированы, |
Из них умерли, |
летальность, % |
|
||
Год |
ны, абс. число |
абс. число |
абс. число |
абс. число |
|
|
|
|
(%) |
в клинике |
в Москве |
|
|||
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
1991 |
294 |
6 (2,04) |
13 |
7 |
53,8 |
33,1 |
|
1992 |
287 |
6 (2,09) |
15 |
8 |
53,3 |
33,1 |
|
1993 |
315 |
11 (3,49) |
27 |
13 |
48,1 |
32,2 |
|
1994 |
392 |
7 (1,79) |
25 |
7 |
28,0 |
31,9 |
|
1995 |
429 |
10 (2,33) |
37 |
6 |
16,2 |
29,8 |
|
1996 |
444 |
13 (2,93) |
45 |
8 |
17,8 |
28,2 |
|
1997 |
381 |
12 (3,15) |
62 |
10 |
16,1 |
26,0 |
|
|
|
|
|
|
|
|
|
го исхода и развития гнойно-некротических осложнений необоснованно и имеет худшие результаты по сравнению с нашей тактикой.
Использованная нами программа комплексного диагностического обследования больных с ОП, создание экспертно-статистической модели определения тяжести течения заболевания и правильно определенная тактика лечения этой группы больных позволили добиться снижения послеоперационной летальности до 16,1% при достаточно низкой летальности у неоперированных больных (табл. 3).
Анализ летальности, приведенной в табл. 3, показывает, что выполнение операций преимущественно в поздние сроки после адекватной комплексной терапии, направленной на борьбу с токсемией, и отказ от обширных оперативных вмешательств в пользу повторной некрсеквестрэктомии при динамическом наблюдении с использованием УЗИ и КТ-диагностики позволяют увеличить число оперированных больных при неуклонном снижении послеоперационной летальности.
Список литературы
1. Видмайер У., Рау Б., Бегер Г. Хирургическое |
5. Рыбаков Г.С. Панкреонекроз. Диагностика и ле- |
||
лечение панкреонекроза // Анналы хир. гепа- |
|
чение: Дис. ... д-ра мед. наук. – М., 1994. |
|
тол. – 1997. – Т. 2, № 2. – С. 47–57. |
6. Савельев В.С., Буянов В.М., Огнев Ю.В. Ост- |
||
2. Нестеренко Ю.А., Лищенко А.И., Михайлу- |
|
рый панкреатит. – М.: Медицина, 1983. |
|
сов С.В. Гнойно-некротические осложнения ост- |
7. Савельев В.С., Кубышкин В.А. Хирургическая |
||
рого панкреатита. – М., 1997. – С. 168. |
|
тактика при панкреонекрозе // Клин. хир. – |
|
3. Пермяков Н.К., Титов Г.П., Магомедов М.К. |
|
1984. – № 11. – С. 43–44. |
|
Патогенез, классификация, осложнения и теоре- |
8. Филимонов М.И., Гельфанд Б.Р., Бурне- |
||
тические основы патогенетической терапии пан- |
|
вич С.З. Деструктивный панкреатит-комплекс- |
|
креонекроза // Диагностика и лечение ослож- |
|
ная диагностика и лечение // Новый мед. журн. |
|
ненных форм острого холецистита и панкреати- |
|
– 1997. – № 3. – С. 10–13. |
|
та. – М., 1985. – С. 107–118. |
9. |
Шалимов А.А., Шалимов С.А., Нечитай- |
|
4. Резолюция IV конференции хирургов-гепатоло- |
|||
|
ло М.Е., Радзиховский А.П. Хирургия подже- |
||
гов России и стран СНГ, г. Тула, 1996 г. // Ан- |
|
лудочной железы. – Симферополь: Таврида, |
|
налы хир. гепатол. – 1997. – Т. 2, № 2. – |
|
1997. – С. 560. |
|
С. 145–148. |
10. Morgenroth K., Kozuschek W. Pankreatitis. – |
||
|
|||
|
|
Berlin; N.Y., 1991. – 120 p. |
|
* |
* |
* |
|
Российский журнал
74 |
2/2000 |
гастроэнтерологии, гепатологии, колопроктологии |

УДК 616.37-002.2-089
ХИРУРГИЧЕСКАЯ ТАКТИКА ПРИ ХРОНИЧЕСКОМ ПАНКРЕАТИТЕ
М.В. Данилов
(Институт хирургии им. А.В. Вишневского РАМН, Москва)
Хирургическое лечение хронического панкреатита (ХП), как указывают M. Buchler и H. Beger (1989), направлено на достижение следующих целей:
1)устранение болевого синдрома;
2)лечение осложнений панкреатита;
3)по возможности сохранение функции
поджелудочной железы (ПЖ) и ее островкового аппарата.
У больных ХП после хирургического лечения частота осложнений оказывается достаточно высокой (см. таблицу).
Если полное восстановление структуры и функции ПЖ под влиянием хирургического лечения представляется весьма проблематичным, то, по мнению этих авторов, благодаря подбору адекватных оперативных методов может быть по крайней мере приостановлено дальнейшее прогрессирование заболевания.
Одна из важнейших целей хирургического лечения вторичного ХП, в первую очередь холангиогенного – устранение его первоначальной причины. При первичном (автономном) ХП этиотропное хирургическое лечение оказывается практически невозможным.
В арсенале оперативных вмешательств, выполняемых по поводу вторичного и первичного хронического панкреатита, имеется множество методов операций как на самой ПЖ, так и на смежных с нею органах, которые могут быть классифицированы следующим образом.
I. Операции на смежных с ПЖ органах.
1. Операции на желчных путях и большом со-
Виды и частота осложнений, потребовав
ших выполнения у больных хроническим панкреатитом прямых операций на под желудочной железе, n=922
Осложнение |
Абс. число |
%, (p±mp) |
|
|
|
|
|
Псевдокисты |
492 |
53,4±1,6 |
|
Свищи |
162 |
17,6±1,3 |
|
Панкреатические |
83 |
9,0±0,9 |
|
абсцессы |
|||
|
|
||
Механическая |
67 |
7,3±0,9 |
|
желтуха |
|||
|
|
||
Дуоденальная |
23 |
2,5±0,5 |
|
непроходимость |
|||
|
|
||
|
|
|
сочке двенадцатиперстной кишки (БСДПК). 2. Операции на желудочно-кишечном тракте. II. Прямые оперативные вмешательства на
ПЖ.
1.Резекции ПЖ различного объема, вплоть до
ееэкстирпации:
а) дистальная резекция железы, вплоть до субтотальной;
б) панкреатодуоденальная резекция; в) секторальная резекция (удаление большей
части головки ПЖ с сохранением двенадцатиперстной кишки и дистального отдела железы;
г) изолированное удаление панкреатических кист;
д) тотальная дуоденопанкреатэктомия.
2.Внутреннее дренирование протоков и кист
ПЖ.
3.Окклюзия протоковой системы ПЖ.
4.Наружное дренирование панкреатических протоков и кист.
III. Паллиативные операции.
1.Операции на нервной системе.
2.Криовоздействие на ПЖ.
IV. Эндоскопические вмешательства на ПЖ и
еепротоках.
V. Закрытые хирургические вмешательства,
выполняемые под контролем ультразвукового исследования и компьютерной томографии.
Показания к операциям на желчных путях возникают:
1)при холангиогенном панкреатите, когда поражение желчного пузыря, протоков и БСДПК является причиной развития вторичных патологических изменений ПЖ;
2)при первичном (алкогольном) панкреатите, для которого характерно развитие тубулярного стеноза дистального отдела общего желчного протока.
При холангиогенном панкреатите операция на билиарном тракте выполняется, во-первых, в целях коррекции калькулезного холецистита (холецистэктомия – лапаротомная или лапароскопическая), холедохолитиаза, папиллостеноза, во-вто- рых, для устранения патогенетических механизмов вторичного поражения ПЖ. У больных алкогольным панкреатитом с панкреатогенным стенозом холедоха основная задача хирургического вмешательства на желчных путях состоит в их декомпрессии.
У больных вторичным панкреатитом, обусловленным холедохолитиазом, папиллостенозом и
Российский журнал
гастроэнтерологии, гепатологии, |
2/2000 |
75 |

их сочетанием, операция может быть проведена как традиционным лапаротомным доступом (холедохолитотомия) и закончена наружной холангиостомией, наложением желчеотводящего анастомоза или трансдуоденальной папиллосфинктеротомией, так и путем использования способов “малоинвазивной хирургии” – эндоскопической папиллосфинктеротомии (ЭПСТ) с экстракцией камней из желчных протоков, их назобилиарным дренированием либо лапароскопической холедохолитотомии. У больных панкреатитом показания к открытым и эндоскопическим манипуляциям на БСДПК должны быть строго обоснованы с учетом опасности развития тяжелых осложнений.
При ХП, обусловленном заболеваниями желу- дочно-кишечного тракта, в частности гастродуоденальными язвами, операции проводятся по обычным принципам лечения язвенной болезни с использованием наиболее щадящих оперативных приемов, в том числе органосохраняющих операций с ваготомией и дренирующими желудок вмешательствами.
При панкреатите, вызванном нарушением мо- торно-эвакуаторной деятельности двенадцатиперстной кишки, выбор метода лечения зависит от причин и формы дуоденального стаза. При вторичном дуоденостазе, возникшем после резекции желудка по методу Бильрот-II, задача операции состоит в обеспечении декомпрессии двенадцатиперстной кишки путем реконструкции желудоч- но-кишечного соустья по Ру или с помощью редуоденизации.
При панкреатите, обусловленном парафатеральными дуоденальными дивертикулами, попытки их удаления представляют значительный риск. Поэтому при наиболее тяжелых формах ХП, сочетающегося с трудноудалимым дуоденальным дивертикулом, допустима резекция желудка с гастроеюноанастомозом по Ру, а в ряде случаев – оперативное выключение двенадцатиперстной кишки из пищеварения с сохранением желудка. При функциональных формах “дуоденального стаза” улучшения в течении вторичного ХП удается добиться с помощью курса чрескожной электростимуляции двенадцатиперстной кишки.
Операции внутреннего дренирования протоковой системы ПЖ – патогенетически обоснованный способ купирования симптомов ХП и его осложнений, поскольку одним из факторов патогенеза первичного панкреатита и характерного для него болевого синдрома, а также развития осложнений панкреатита (псевдокист и панкреатических свищей) является гипертензия в системе протоков ПЖ.
По данным P. Banks (1979), оперативное снижение давления в панкреатических протоках у больных панкреатитом с 17 до 7–10 мм рт. ст. избавляет пациентов от болей. Внутреннее дренирование наиболее оправданно при сохраненной в той или иной степени внутри- и внешнесекреторной функций железы при отсутствии значитель-
ного похудания, выраженной стеато- и креатореи.
Целесообразность и техническая возможность выполнения подобных операций определяется наличием доказанного препятствия оттоку секрета ПЖ на том или ином уровне и вызванной этим интрапанкреатической гипертензии. Эффект операции оказывается тем полнее, чем лучше разгружены панкреатические протоки.
При наличии препятствия для оттока секрета в проксимальном отделе главного протока ПЖ предложена и применяется операция рассечения и пластики его устья (вирзунгопластика). При сужении или облитерации устья главного протока ПЖ его проходимость может быть восстановлена трансдуоденальным доступом как путем с рассечением ампулы, так и с рассечением собственного сфинктера главного панкреатического протока (Y-образная сфинктеротомия). Следует подчеркнуть принципиальное отличие этой операции от обычной папиллосфинктеротомии, поскольку при этом объектом вмешательства является не только БСДПК, но и непосредственно главный панкреатический проток.
Вирзунгопластика технически выполнима только при стриктурах самой начальной части главного протока ПЖ приблизительно на протяжении 1,5 см, где он еще довольно тесно прилежит к стенке общего желчного протока. Опыт показывает, что при ХП нечасто встречаются анатомические условия, подходящие для выполнения эффективной трансдуоденальной вирзунгопластики. Стремление расширить показания к этой операции, осуществить ее при протяженных стриктурах и камнях панкреатических протоков может стать источником тяжелых осложнений, а также рецидивов заболевания.
Анализ отдаленных результатов вирзунгопластики свидетельствует об ограниченном декомпрессивном эффекте операции. Стриктуры главного протока ПЖ в зоне его устья протяженностью не более 1 см могут быть столь же эффективно и менее травматично устранены методами эндоскопической вирзунготомии или баллонной дилатации (Binmoeller K., Soehendra N., 1997).
При хроническом первичном (алкогольном) панкреатите сужение главного протока ПЖ редко бывает изолированным. Чаще по его ходу встречаются многочисленные стриктуры, чередующиеся с лакунообразными расширениями, в результате чего проток при рентгеноконтрастном исследовании приобретает характерный вид “цепи озер”. Стриктуры и обтурация конкрементами распространяются также и на более мелкие протоки. В этих условиях анастомозирование ограниченного участка протока с пищеварительным трактом оказывается недостаточным для декомпрессии всей протоковой системы ПЖ. Наиболее патогенетически обоснованным оказывается метод продольной панкреатоеюностомии, разработанный Ch. Puestow (1958) в двух вариантах.
Российский журнал
76 |
2/2000 |
гастроэнтерологии, гепатологии, колопроктологии |

Принципиальная особенность этой операции состоит в том, что с тощей кишкой анастомозируют не проток, а всю рассеченную продольно железу. Это обеспечивает свободный отток в кишку секрета из мельчайших протоков, создает условия для стихания панкреатита, предотвращения его обострения после операции, уменьшения интенсивности болей. При этом максимально сохраняется функционирующая ткань железы как инсулярная, так и ацинарная, что предотвращает развитие сахарного диабета и создает условия для улучшения переваривания пищи за счет повышения выброса панкреатического секрета в кишечник.
Указанные преимущества позволяют рассматривать продольную панкреатоеюностомию как метод выбора хирургического лечения панкреатита тогда, когда препятствие оттоку секрета ПЖ локализуется более чем в 2 см от устья ее главного протока. Операция наиболее эффективна при значительном расширении (водянке) панкреатических протоков.
Анастомозирование тощей кишки с рассеченной на всем протяжении железой без ее широкой мобилизации и спленэктомии обычно достаточно эффективно и нетравматично. При наличии необратимых изменений дистального отдела ПЖ (псевдокисты, особенно рецидивные, в сочетании со свищами, хронический гнойный панкреатит этого отдела железы) приходится использовать более сложную методику наложения продольного панкреатоеюноанастомоза, сочетающегося с дистальной резекцией ПЖ.
Для лечения ХП применяются следующие варианты резекции ПЖ:
1)дистальная;
2)субтотальная, при которой сохраняется лишь небольшая часть железы, непосредственно прилежащая к двенадцатиперстной кишке;
3)секторальная резекция головки железы с сохранением двенадцатиперстной кишки, общего желчного протока и тела ПЖ;
4)панкреатодуоденальная резекция;
5)тотальная дуоденопанкреатэктомия.
Дистальную резекцию ПЖ в качестве само-
стоятельной операции целесообразно применять лишь в редких случаях осложненного панкреатита, ограниченного дистальной половиной железы. Подобные формы изолированного “левостороннего” панкреатита, нередко в сочетании с панкреатическими кистами и свищами, чаще возникают как следствие травмы ПЖ, панкреонекроза, осложнившихся сужением или облитерацией главного протока обычно в области перешейка.
Попытки применения дистальной резекции ПЖ при диффузном панкреатите с расчетом на дальнейшее улучшение его течения в оставшейся части железы под влиянием удаления “основного патологического очага”, как правило, не дают успеха. В то же время потеря при этой операции
Российский журнал
значительной доли островкового аппарата сопровождается развитием сахарного диабета или прогрессированием уже имеющегося при сохранении или усугублении симптомов панкреатита.
Объем дистальной резекции ПЖ определяется распространенностью поражения железы и ее протоковой системы. Важно избегать как чрезмерного удаления малоизмененной железистой ткани, так и оставления пораженной части железы, что может привести к рецидиву гипертензии в блокированном участке протоков оставшейся части органа.
Дистальная резекция ПЖ обычно включает в себя как обязательный этап спленэктомию, что обусловлено тесными анатомическими взаимоотоношениями железы с селезеночными сосудами. При менее выраженных анатомических изменениях железы сосуды могут быть осторожно отделены от нее препарированием. Это позволяет сохранить селезенку. При неизбежности спленэктомии избежать развития синдрома асплении можно с помощью аутотрансплантации фрагментов селезенки.
При установлении в ходе резекции ПЖ признаков гипертензии в протоковой системе остающейся части железы, в частности расширения ее протоков, ушивание ее культи наглухо недопустимо. В этих случаях операцию целесообразно завершить наложением панкреатоеюноанастомоза.
Субтотальная резекция ПЖ предусматривает удаление одним блоком селезенки, хвоста, тела и большей части головки железы вместе с ее крючковидным отростком, оставляя лишь небольшой ободок железистой ткани, непосредственно прилегающей к медиальной стенке двенадцатиперстной кишки.
Осуществление данного вмешательства представляет большие технические трудности, поскольку требует сохранения целости общего желчного протока, а также гастродуоденальной, верхней и нижней панкреатодуоденальных артерий во избежание нарушения кровоснабжения стенки двенадцатиперстной кишки и ее некроза.
Выполнение субтотальной резекции ПЖ закономерно приводит практически к полной утрате ее внешне- и внутрисекреторной функций. Поэтому оно может быть оправданным лишь в исключительных случаях при тотальном поражении ПЖ, в финальной стадии панкреатита, при уже состоявшейся полной или почти полной утрате внешнесекреторной функции и тяжелом сахарном диабете.
Панкреатодуоденальная резекция (ПДР) – патогенетически обоснованный вариант радикальной операции в случаях осложненного хронического панкреатита, алкогольного либо обусловленного дизонтогенетическими поражениями органов панкреатодуоденальной зоны с локализацией патологических изменений – цирроза, литиаза, псевдокист – в головке железы. При этом в патологический процесс часто вовлекаются дис-
гастроэнтерологии, гепатологии, |
2/2000 |
77 |

тальный отдел общего желчного протока (тубулярный стеноз), двенадцатиперстная кишка (стеноз), воротная вена (сдавление), реже – ветви гастродуоденальной и верхней брыжеечной артерий (ложные аневризмы).
Выполнение ПДР при ХП нередко технически затруднено выраженностью спаечного процесса и воспалительной инфильтрации окружающих железу тканей. Трудности могут возникать как при выделении панкреатодуоденального комплекса, так и в ходе реконструктивного этапа операции. В то же время манипуляции на склерозированной железе при ХП облегчаются меньшей кровоточивостью и большей плотностью ткани, частым расширением главного протока железы с утолщенной и уплотненной стенкой. Это повышает безопасность наложения панкреатодигестивного анастомоза.
Выполнение ПДР при ХП не требует соблюдения правил абластики, удаления лимфатического аппарата. При панкреатите значительно чаще удается использовать органосохраняющие варианты ПДР, в частности с сохранением желудка и привратника, а также сформировать максимально широкий продольный панкреатоеюноанастомоз, который связан с минимальной частотой осложнений и создает оптимальные условия для сохранения остаточной внешнесекреторной функции ПЖ.
Секторальная резекция головки ПЖ с сохранением двенадцатиперстной кишки – одна из наиболее современных разновидностей радикальной операции при хроническом панкреатите. Наибольший опыт применения этой операции накоплен H. Beger (1989), который подробно разработал ее технику.
Методика вмешательства сходна с этапами субтотальной резекции железы и ПДР. На этапе выделения головки железы особое внимание уделяют сохранению кровоснабжения двенадцатиперстной кишки, а также целости интрапанкреатической части общего желчного протока. Реконструктивный этап операции включает создание анастомоза дистальной культи ПЖ с изолированной петлей тощей кишки. Проток остающейся небольшой проксимальной культи железы может быть перевязан либо (по рекомендации H. Beger) изолированно анастомозирован с той же петлей тощей кишки.
Применение данного вида органосохраняющей проксимальной резекции ПЖ сопровождается, по данным H. Beger, благоприятными непосредственными и отдаленными функциональными результатами. В то же время повышенная техническая сложность данной операции заставляет при грубых анатомических изменениях железы и смежных органов и тканей признавать секторальную дуоденосохраняющую резекцию ПЖ технически невыполнимой и заменять ее другими радикальными или паллиативными вмешательствами.
Тотальная дуоденопанкреатэктомия (ТДПЭ)
– наиболее обширное оперативное вмешательство, применяемое в наиболее тяжелых случаях хронического диффузного панкреатита, обычно в качестве повторной процедуры после перенесенных неэффективных операций на ПЖ и смежных органах.
Показания к ТДПЭ могут возникать:
1)при невозможности отличить панкреатит от рака ПЖ с поражением ее головки и тела;
2)при рецидиве панкреатита в головке железы после перенесенной ранее ее дистальной резекции;
3)при возникновении в ходе ПДР интраоперационных осложнений.
Техника ТДПЭ включает соответствующие этапы ПДР и дистальной резекции ПЖ. Обычно она сопровождается значительными трудностями в связи с выраженным спаечно-инфильтративным процессом в окружности железы. В то же время реконструктивный этап ТДПЭ менее сложен, поскольку не требует обработки культи ПЖ. Использование варианта тотальной панкреатэктомии с сохранением желудка и привратника позволяет несколько уменьшить объем и травматичность операции и в определенной степени улучшить функциональное состояние пищеварительной системы.
Развитие после ТДПЭ выраженных функциональных расстройств является закономерным. В связи с этим необходимо продолжение заместительной терапии, поскольку внешняя секреция ПЖ оказывается выключенной не только в связи
сперенесенной операцией, но и вследствие ранее возникшей в далеко зашедшей стадии панкреатита выраженной атрофии ацинарной паренхимы железы и нарушенной проходимости ее протоков со снижением выброса ферментов в кишечник.
Более тяжелое последствие ТДПЭ – развитие тяжелого сахарного диабета с суточной потребностью в инсулине около 40 ЕД. Отличительной особенностью постпанкреатэктомического диабета являются его нестабильность и повышенная чувствительность к экзогенному инсулину, что объясняется отсутствием одновременного выделения глюкагона после удаления всего островкового аппарата ПЖ.
У больных после ТДПЭ гипергликемическое состояние быстро сменяется гипогликемическими кризами, которые приводят к развитию энцефалопатии и являются одной из главных причин смерти больных как в ранние, так и поздние сроки после операции.
Развитию гипогликемии способствуют нарушения переваривания и всасывания углеводов в кишечнике после панкреатэктомии. Поэтому использование ТДПЭ при панкреатите крайне опасно у больных с недостаточным интеллектом, у лиц, страдающих алкоголизмом, которым не могут быть обеспечены достаточный медицинский уход и постоянный контроль гликемии.
Российский журнал
78 |
2/2000 |
гастроэнтерологии, гепатологии, колопроктологии |

Наряду с традиционными методами хирургического лечения ХП, осуществляемыми, как правило, лапаротомным доступом, в последние годы все большее распространение находят и эндоскопические вмешательства на ПЖ и смежных органах. Согласно K. Binmoeller и N. Soehendra (1997), цели эндоскопических вмешательств совпадают с таковыми традиционного хирургического лечения ХП и включают декомпрессию панкреатических протоков при наличии их обструкции, а также лечение осложнений панкреатита.
Изолированные, ограниченные по протяженности стенозы устья главного панкреатического протока (ГПП), приводящие к развитию вторичного ХП, могут быть разрешены с помощью рассечения начального отдела главного протока железы – панкреатической сфинктеротомии, которая в ряде случаев также может быть заменена папиллодилатацией с помощью катетеров, снабженных миниатюрными баллончиками.
Выполнение панкреатической сфинктеротомии может сопровождаться рядом осложнений, характерных для интрадуоденальных эндоскопических вмешательств, в частности острым холангитом, панкреатитом, гемобилией, ретродуоденальной перфорацией. Частота рестенозов устья рассеченного ГПП достигает, по данным R. Cozarek (1994), 14%. Снижения частоты рестенозов удается добиться при увеличении протяженности сфинктеротомии с 6 до 10–11 мм.
Стентирование ГПП предложено и применяется при наличии у больных ХП распространенных протяженных его стриктур. Наиболее подходящими кандидатами для выполнения данной процедуры являются, по данным K. Binmoeller и N. Soehendra (1994), пациенты с изолированными стриктурами и выраженным престенотическим расширением протока. Предварительно обычно выполняется баллонная дилатация стриктур, однако, поскольку лечебный эффект этой изолированной процедуры весьма нестоек, ее дополняют введением в расширенный ГПП стента.
В большинстве случаев используют пластмассовый (тефлоновый) эндопротез (стент) с множественными отверстиями. В зависимости от выраженности, локализации и протяженности стриктуры могут быть использованы стенты различного диаметра (5, 7 и 10 Fr.). Операцию начинают с выполнения панкреатической сфинктеротомии, после чего для проведения в ГПП расширителей и эндопротезов используют стандартную технику Сельдингера.
Следует отметить, что эндоскопическое лечение стриктур панкреатических протоков в силу большей ригидности последних представляется технически более сложным по сравнению с выполнением аналогичных процедур на желчных протоках.
Имеются также попытки использования для лечения ХП не только пластиковых, но и металлических саморасширяющихся стентов, ранее ис-
Российский журнал
пользовавшихся для эндопротезирования опухолевых стриктур желчных протоков. Однако, по данным F. Maccioni et al. (1991), имплантация подобных стентов в ГПП нередко приводит к выраженной гиперплазии слизистой оболочки протока, что может нередко обусловливать прекращение функции стента.
K. Binmoeller и N. Soehendra (1997) расширили показания к процедуре стентирования протоковой системы ПЖ, применив ее у 14 пациентов с симптомами ХП, обусловленного pancreas divisum. Данное эндоскопическое вмешательство начинали с рассечения малого сосочка двенадцатиперстной кишки на протяжении 2–3 мм, после чего вводили пластмассовый стент в просвет добавочного панкреатического протока. Авторам удалось добиться купирования или смягчения симптомов панкреатита у 71% больных при сроке наблюдения до 5 лет.
Поскольку важным фактором существования интрапанкреатической гипертензии, манифестирующей болевым синдромом, является литиаз ГПП и его ветвей, разрабатываются способы извлечения конкрементов из протоковой системы ПЖ. Однако, по данным K. Binmoeller и N. Soehendra (1997), панкреатолитотомия, выполняемая после панкреатической сфинктеротомии с помощью корзинки Дормиа, оказывается эффективной лишь у 20% пациентов.
Малая эффективность данной процедуры обусловлена двумя факторами: вклинением конкрементов в ГПП и в его разветвления и расположением их дистальнее стриктуры. Улучшить результаты процедуры возможно, применяя различные методы фрагментации конкрементов – экстракорпоральную литотрипсию, а также различные варианты интракорпоральной деструкции панкреатических камней. Так, H. Neuhaus et al. (1992) обобщили успешный опыт интракорпоральной лазерной литотрипсии панкреатических камней под контролем сверхтонкого дочернего эндоскопа, проведенного через канал дуоденоскопа.
Эндоскопические вмешательства находят все большее распространение как метод лечения больных панкреатитом, осложненным образованием псевдокист. Доступ к ним может быть также осуществлен через рассеченное устье ГПП путем имплантации в него эндопротеза (стента), который проводят в полость псевдокисты, создавая таким образом внутренний дренаж кистозной полости.
Более распространенным методом лечения панкреатических псевдокист, по данным литературы и нашему собственному опыту, является их
трансмуральный внутренний дренаж. Важнейшим условием эффективности и безопасности этой процедуры является наличие тесного сращения стенки кисты со стенкой желудка и двенадцатиперстной кишки, что практически исключает опасность развития послеоперационного панкреатита.
гастроэнтерологии, гепатологии, |
2/2000 |
79 |

Выполнение эндоскопической цистогастроили цистодуоденостомии существенно облегчается и становится более эффективным с использованием метода эндоскопического УЗИ. Технически более сложной процедурой является формирование цистоеюноанстомоза с использованием лапароскопической техники.
Оценивая результаты разнообразных способов эндоскопических хирургических вмешательств при ХП и его осложнениях, можно отметить их меньшую травматичность и высокую эффектив-
ность в некоторых клинических ситуациях. Вместе с тем достаточно значительный процент осложнений и неэффективности эндоскопических процедур требует в ряде случаев перехода к традиционным лапаротомным методам лечения, а в недостаточной мере прослеженные отдаленные результаты применения эндоскопического лечения не позволяют дать полностью обоснованные рекомендации по выбору оптимального способа и техники этого малинвазивного направления в хирургии.
Список литературы
1.Данилов М.В., Федоров В.Д. Хирургия поджелудочной железы: Руководство для врачей. – М.: Медицина, 1995. – 238 с.
2.Кузин М.И., Данилов М.В., Благовидов Д.Ф. Хронический панкреатит. – М.: Медицина, 1985. – 368 с.
3.Шалимов А.А., Шалимов С.А., Нечитайло М.Е., Радзиховский А.П. Хирургия поджелудочной железы. – Симферополь: Таврида, 1997.
–560 с.
4.Beger H.G., Buchler M., Bittner R.R. et al. Duodenum-preserving resection of the head of the pancreas in severe chronic pancreatitis: early and late results // Ann. Surg. – 1989. – Vol. 209. – N 3. – P. 273–278.
5.Binmoeller K.F., Soehendra N. New modalities in the treatment of chronic pancreatitis // What’s new on pancreatic diseases / G.M. Gazzaniga, ed.
–Stuttgart; N. Y.: G. Thieme, 1994. – P. 74–77.
6.Binmoeller K.F., Soehendra N. Endoscopic treatment // The Pancreas / H. Beger et al., ed. – P. 794–807.
7.Buchler M., Beger H.G. Neue Indikationen bei
chronischer Pankreatitis // Internist. – 1989. – Bd 30. – S. 747–751.
8.Cremer M., Deviere J., Delhaye M. et al. Stenting in severe chronic pancreatitis: results of medium-term follow-up in 76 patients // Endoscopy. – 1991. – Vol. 23. – P. 171–176.
9.Kozarek R.A., Ball T.J., Patterson D.J. et al. Endoscopic pancreatic duct sphincterotomy: indications, technique, and analysis of results // Gastrointest. Endoscop. – 1994. – Vol. 40. –
P.592–598.
10.Massioni F., Ricci P., Gandini R. et al. Mucosa hyperplasia: factor conditioning long-term patency of biliary metallic stents // Radiology. – 1991. – Vol. 181. – P. 216–220.
11.Neuhaus H., Hoffmann W., Classen M. Laser lithotripsy of pancreatic and biliary stones via 3,4 and 3,7 mm miniscopes: first clinical results // Endoscopy. – 1992. – Vol. 24. – P. 208–214.
12.Puestow C.B., Gillesby W. Retrograde surgical drainage of pancreas for chronic relapsing pancreatitis // Arch. Surg. – 1958. – Vol. 76. –
P.898–907.
* * *
УДК 616.37-089.819
МАЛОИНВАЗИВНАЯ ХИРУРГИЯ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
А.Н. Лотов
(Факультетская хирургическая клиника Московской медицинской академии им. И.М. Сеченова)
Отмечающийся в последние десятилетия бум в хирургии связан с внедрением в клиническую практику более совершенных инструментальных методов,
позволяющих не только на более высоком уровне проводить диагностический поиск, добиться визуализации пораженного органа в двух- и трехмерном изображениях, но и выполнять лечебные
манипуляции, заменяющие нередко само хирургическое вмешательство.
Ультразвуковое исследование (УЗИ) в медицинской практике начали применять с середины XX столетия. В последующем от неинвазивного, чисто диагностического метода УЗИ более широко стали применять при различных малоинвазивных диагностических процедурах, а с начала
Российский журнал
80 |
2/2000 |
гастроэнтерологии, гепатологии, колопроктологии |
