
- •ЛУЧЕВАЯ ДИАГНОСТИКА И ЛУЧЕВАЯ ТЕРАПИЯ
- •ПРЕДИСЛОВИЕ
- •ГЛАВА 1. ПРИНЦИПЫ И МЕТОДЫ ЛУЧЕВОЙ ДИАГНОСТИКИ
- •1.1. Общие принципы визуализации медицинских изображений
- •1.2. Рентгенологические методы исследования
- •1.3. Методы радионуклидной диагностики
- •1.4. Методы ультразвукового исследования
- •ГЛАВА 2. ЛУЧЕВАЯ ДИАГНОСТИКА ПОВРЕЖДЕНИЙ И ЗАБОЛЕВАНИЙ ОПОРНО-ДВИГАТЕЛЬНОГО АППАРАТА
- •2.1. Лучевые методы исследования опорно-двигательного аппарата
- •Ультразвуковое исследование. УЗИ – недорогой, неинвазивный и не связанный с риском облучения метод.
- •2.2. Лучевые признаки повреждений костей и суставов
- •2.3. Лучевые признаки воспалительного поражения кости
- •2.6. Лучевые признаки дегенеративно-дистрофических заболеваний суставов
- •ГЛАВА 3. ЛУЧЕВАЯ ДИАГНОСТИКА ПОВРЕЖДЕНИЙ И ЗАБОЛЕВАНИЙ ЛЕГКИХ
- •3.1. Лучевые методы исследований органов дыхания
- •Методы рентгенологических исследований легких. Лучевое исследование легких играет большую роль в современной клинической практике. Преимущественно выполняются рентгенологические исследования.
- •3.2. Анализ обзорной рентгенограммы грудной клетки в прямой проекции
- •3.3. Основные рентгенологические синдромы при заболеваниях и повреждениях легких
- •3.4. Лучевые признаки острых воспалительных процессов в легких
- •3.5. Лучевые признаки хронического бронхита
- •3.6. Лучевые признаки туберкулеза органов дыхания
- •3.7. Лучевые признаки травматических повреждений легких
- •3.8. Лучевые признаки опухолей легких
- •ГЛАВА 4. ЛУЧЕВАЯ ДИАГНОСТИКА ЗАБОЛЕВАНИЙ СЕРДЦА И СОСУДОВ
- •Магнитно-резонансная томография. Преимущества МРТ над КТ и ЭхоКГ в изображении сердца:
- •4.2. Лучевые признаки заболеваний сердца
- •4.3. Лучевые признаки заболеваний кровеносных сосудов
- •ГЛАВА 5. ЛУЧЕВАЯ ДИАГНОСТИКА ЗАБОЛЕВАНИЙ ОРГАНОВ ПИЩЕВАРЕНИЯ
- •5.1. Лучевые исследования пищеварительного канала
- •5.6. Лучевые исследования печени и желчных путей
- •5.7. Лучевые признаки заболеваний печени, желчного пузыря и желчных протоков
- •5.8. Лучевые исследования поджелудочной железы
- •ГЛАВА 6. ЛУЧЕВАЯ ДИАГНОСТИКА ЗАБОЛЕВАНИЙ МОЧЕВЫДЕЛИТЕЛЬНОЙ СИСТЕМЫ
- •Ультразвуковые исследования. УЗИ почек. В связи с безвредностью и высокой информативностью сонография в большинстве случаев является первым методом, с которого начинается исследование в урологической клинике.
- •МРТ. Роль МРТ в визуальной диагностике мочевых путей еще окончательно не изучена.
- •6.2. Лучевые признаки заболеваний мочевыделительной системы
- •Лучевые признаки врожденных аномалий почек. Аплазия почки. На обзорных рентгенограммах, как и на урограммах, тень одной почки отсутствует, а лоханка и мочеточники не заполняются рентгеноконтрастным средством, введенным внутривенно.
- •Лучевые признаки воспалительных заболеваний почек
- •Острый пиелонефрит. Большинство острых воспалительных заболеваний почек cопровождаются увеличением их размеров.
- •6.3. Тактика лучевого исследования при почечной колике, макрогематурии и гипертонии
- •6.4. Лучевые признаки повреждений органов мочевыделительной системы
- •ГЛАВА 7. ЛУЧЕВАЯ ДИАГНОСТИКА ЗАБОЛЕВАНИЙ ЭНДОКРИННОЙ СИСТЕМЫ
- •7.1. Лучевая диагностика заболеваний гипофиза
- •7.2. Лучевая диагностика заболеваний щитовидной железы
- •7.3. Лучевая диагностика заболеваний паращитовидных желез
- •7.4. Лучевая диагностика эндокринных заболеваний поджелудочной железы
- •7.5. Лучевая диагностика заболеваний надпочечников
- •ГЛАВА 8. ЛУЧЕВАЯ ДИАГНОСТИКА ЗАБОЛЕВАНИЙ И ПОВРЕЖДЕНИЙ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ
- •8.2. Травмы черепа и головного мозга
- •8.4. Повреждения позвоночника и спинного мозга
- •Опухоли спинного мозга. Методом выбора при исследовании по поводу опухолей спинного мозга является МРТ. МРТ демонстрирует все элементы позвоночника и структуру спинного мозга.
- •ГЛАВА 9. ФИЗИЧЕСКИЕ И БИОЛОГИЧЕСКИЕ ОСНОВЫ ЛУЧЕВОЙ ТЕРАПИИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ
- •9.1. Физические свойства различных видов ионизирующих излучений
- •9.2. Клиническая дозиметрия
- •9.3. Разновидности доз и единицы их измерения
- •9.4. Основные стадии биологического действия ионизирующих излучений
- •9.5. Основные факторы, модифицирующие радиочувствительность
- •9.6. Оптимизация лучевых методов лечения злокачественных опухолей
- •10.1. Показания и противопоказания к лучевой терапии злокачественных опухолей
- •10.2. Варианты лучевой терапии
- •10.3. Принципы лучевой терапии злокачественных опухолей:
- •10.4. Клинико-дозиметрическое планирование лучевой терапии
- •10.5. Классификация методов лучевой терапии
- •10.6. Дозиметрическая характеристика методов лучевой терапии
- •10.7. Состав курса лучевой терапии
- •10.8. Лучевая терапия у детей
- •ГЛАВА 11. ЛУЧЕВЫЕ ПОРАЖЕНИЯ В МЕДИЦИНСКОЙ РАДИОЛОГИИ
- •11.1. Классификация лучевых поражений
- •11.2. Медицинское облучение при лучевой терапии
- •11.3. Медицинское облучение при лучевой диагностике
- •ЛИТЕРАТУРА
377
ГЛАВА 11. ЛУЧЕВЫЕ ПОРАЖЕНИЯ В МЕДИЦИНСКОЙ РАДИОЛОГИИ
В настоящее время основной вклад в дозу, получаемую человеком от техногенных источников радиации, вносят медицинские процедуры и методы лечения, связанные с применением ионизирующего излучения. В табл. 11.1 представлены данные (А.Н. Стожаров и соавт., 2002), показывающие ведущую роль медицинского облучения среди антропогенных источников.
Таблица 11.1. Глобальная индивидуальная эффективная доза (мЗв) в 2000 году от антропогенных источников
|
|
Глобальная |
|
|
|
Источник |
|
годовая |
Диапазон или тенденция лучевых |
||
|
|
индивидуальная |
нагрузок |
|
|
|
|
эффективная |
|
|
|
|
|
доза, мЗв |
|
|
|
Медико- |
|
0,4 |
Границы от 0,04 до 1,0 мЗв при |
||
диагностические |
|
самом низком и самом высоком |
|||
обследования |
|
|
уровнях медицинского обслуживания |
||
Ядерные |
|
0,005 |
Нагрузка |
уменьшилась |
с |
испытания |
в |
|
максимального значения 0,15 в 1963 |
||
атмосфере |
|
|
г. она больше в северном и меньше в |
||
|
|
|
южном полушарии |
|
|
Чернобыльская |
|
0,002 |
Нагрузка |
уменьшилась |
с |
авария |
|
|
максимального значения 0,04 в 1986 |
||
|
|
|
г. (среднее в северном полушарии), |
||
|
|
|
она больше в местностях, близких к |
||
|
|
|
месту аварии |
|
|
Производство |
|
0,0002 |
Нагрузка |
увеличилась |
из-за |
атомной |
|
|
расширения |
программы, |
но |
энергии |
|
|
уменьшилась |
благодаря |
|
|
|
|
совершенствованию работы |
|
|
11.1. Классификация лучевых поражений
Для лучшего понимания возможных последствий медицинского облучения целесообразно рассмотреть биологические эффекты, вызываемые ионизирующей радиацией.
В целом, закономерности лучевого поражения организма определяются двумя факторами:
1.Радиочувствительностью тканей, органов и систем, существенных для выживания организма.
2.Величиной поглощенной дозы излучения и ее распределением в пространстве и времени.
378
Каждый в отдельности и сочетании друг с другом эти факторы определяют преимущественный тип лучевых эффектов (местные или общие), специфику и время проявления (непосредственно после облучения, вскоре после облучения или в отдаленные сроки) и их значимость для организма.
По современным данным, основные детерминированные эффекты общего облучения представляются следующим образом (табл. 11.2):
Таблица 11.2. Взаимоотношение между дозой и радиационным эффектом при облучении всего тела*
Доза |
Клинические показатели |
|
|
0,05 Гр |
Отсутствие симптомов и обнаруживаемых эффектов. |
0,15 Гр |
Возможно наличие хромосомных аберраций; снижение |
|
сперматогенеза. |
0,5 Гр |
Легкая депрессия лейкоцитов и тромбоцитов у небольшого |
|
количества пораженных. |
1 Гр |
Порог дозы для лучевой болезни. Тошнота и рвота у небольшого |
|
количества пораженных. |
2 Гр |
Тошнота и рвота у большинства пораженных; необходимо |
|
лечение миелодепрессии. |
4 Гр |
50% смертельных исходов. |
6 Гр |
Без лечения смертность приближается к 100%. |
10 Гр |
Начинают проявляться осложнения желудочно-кишечного |
|
синдрома. Предел для успеха лечения. |
50 Гр |
Доминирует синдром сердечно-сосудистой/центральной нервной |
|
систем. Смертность составляет 100% в течение нескольких дней |
|
(24-72 часа). |
* При облучении всего тела гамма-квантами в течение короткого времени.
Следует подчеркнуть, что при переходе от изолированной клетки к ткани, к органу и организму все явления усложняются. В механизме стимулирующих и ингибирующих влияний, испытываемых клетками, принимают участие не только локальные факторы, но и регулирующие системы, поддерживающие состояние гомеостаза в организме, а также морфофизиологические факторы (степень кровоснабжения, локализация клеток).
Эти обстоятельства усложняют оценку радиочувствительности тканей, органов и целого организма, но не отвергают принципиального и ведущего значения цитокинетических препаратов, определяющих тип и выраженность лучевых эффектов на всех уровнях биологической организации.
Наилучшее понимание основных проявлений лучевого поражения организма может быть достигнуто сопоставлением их с поглощенной дозой в «критических органах». Под «критическими органами» понимают жизненно
379
важные органы или системы, первыми выходящие из строя в исследуемом диапазоне доз излучения, что обусловливает гибель организма в определенные сроки после облучения.
Очень важно различать эффекты излучения детерминированные и стохастические.
Эффекты излучения детерминированные – клинически выявляемые вредные биологические эффекты, вызванные ионизирующим излучением, в отношении которых предполагается существование порога, ниже которого эффект отсутствует, а выше – тяжесть эффекта зависит от дозы.
Эффекты излучения стохастические – вредные биологические эффекты, вызванные ионизирующим излучением, не имеющие дозового порога возникновения, вероятность возникновения которых пропорциональна дозе, и для которых тяжесть проявления не зависит от дозы.
Для целей радиационной защиты, согласно рекомендациям МКРЗ, принято допущение, что стохастические эффекты имеют беспороговую линейную зависимость.
Кранним лучевым поражениям относят те, которые возникают в течение первых трех месяцев после облучения, к поздним – позже трех месяцев после окончания лучевого воздействия.
В радиобиологической и клинической практике различают лучевые реакции и лучевые повреждения.
Лучевыми реакциями принято называть такие изменения в тканях, которые последующие 2-3 недели после облучения проходят без специального лечения. Примером может служить эритема кожи.
Клучевым повреждениям относятся органические и функциональные изменения органов и тканей, которые требуют специального лечения.
11.2. Медицинское облучение при лучевой терапии
Лучевые реакции и повреждения при лучевой терапии. Как указывалось на предыдущих лекциях, основной принцип лучевой терапии предусматривает необходимость оптимального воздействия излучения на опухоль при условии максимально возможного щажения окружающих органов и тканей. Однако полностью избежать облучения здоровых тканей, особенно при глубоко расположенных новообразованиях, практически не представляется возможным. Достаточно сказать, что отклонение в подводимой дозе на 5% считается критическим как для излечения опухоли, так и для воздействия на здоровые ткани. Из-за малого интервала различий в радиочувствительности опухоли и окружающих ее здоровых тканей и в настоящее время, несмотря на развитие и совершенствование радиотерапевтической техники, могут возникнуть лучевые поражения кожи и других органов и тканей. Следует заметить, что часть людей (от 5 до 10%) являются высокочувствительными к действию ионизирующего излучения, по
380
сравнению с большинством людей, но определить заранее индивидуальную радиочувствительность не представляется возможным.
При лучевой терапии злокачественных опухолей поглощенные дозы ионизирующего излучения определяются клиническими показаниями в соответствии с принципами радиационной онкологии и направлены на достижение максимальной избирательности поражения опухолей. Так как дозы при этом используются большие, в отличие от лучевой диагностики, лучевое воздействие на пациентов может сопровождаться нестохастическими (детерминированными эффектами) со стороны здоровых тканей, однако при этом не должна быть превышена их толерантность (см. табл. 11.3).
Таблица 11.3. Оценки приблизительных пороговых доз для клинически вредных нестохастических эффектов в различных тканях, основанные на реакциях пациентов на стандартное фракционирование рентгеновского или гамма-облучения
Орган |
Повреждения через 5 |
Доза, |
Площадь |
|
лет |
вызывающая |
поля |
|
|
эффект у 1-5% |
облучения |
|
|
пациентов, Гр |
|
Кожа |
Изъязвление, фиброз |
55 |
100 см2 |
Слизистая рта |
То же |
60 |
50 см2 |
Желудок |
Изъязвление |
45 |
100 см2 |
Тонкая кишка |
Изъязвление, сужение |
45 |
100 см2 |
|
канала |
|
|
Толстая кишка |
То же |
45 |
100 см2 |
Печень |
Печеночная |
35 |
Целиком |
|
недостаточность |
|
|
Почки |
Нефросклероз |
23 |
Целиком |
Семенники |
Постоянная |
5 -10 |
Целиком |
|
стерильность |
|
|
Яичники |
То же |
2 – 3 |
Целиком |
Матка |
Некроз, прободение |
100 |
Целиком |
Молочная |
Атрофия и некроз |
50 |
Целиком |
железа |
|
|
|
Легкие |
Пневмонит, фиброз |
40 |
Доля |
Капилляры |
Телеангиоэктазия, |
50 – 60 |
- |
|
склероз |
|
|
Сердце |
Перикардит, панкардит |
40 |
Целиком |
Кости |
Некроз, переломы |
60 |
10 см2 |
ЦНС (головной |
Некроз |
50 |
Целиком |
мозг) |
|
|
|
Спинной мозг |
Некроз |
50 |
5 см2 |
381
|
|
|
Продолжение табл. 11.3. |
||
Глаз |
|
Панофтальмит, |
55 |
Целиком |
|
|
|
кровоизлияние |
|
|
|
Хрусталик |
|
Катаракта |
5 |
Целиком |
|
Щитовидная |
|
Гипотиреоз |
45 |
- |
|
железа |
|
|
|
|
|
Мышцы |
у |
Атрофия |
100 |
Целиком |
|
взрослых |
|
|
|
|
|
Костный мозг |
|
Гипоплазия |
2 |
Целиком |
|
Костный мозг |
|
Гипоплазия |
20 |
Локально |
|
Лимфатические |
|
Атрофия |
35 – 40 |
Локально |
|
узлы |
|
|
|
|
|
Плод |
|
Гибель |
2 |
Целиком |
|
Кроме того, в связи с повышением эффективности комплексного лечения злокачественных образований, включающего и лучевой компонент, увеличилась продолжительность жизни у многих больных и, следовательно, стали чаще обнаруживать местные лучевые повреждения, имеющие длительный (5 и более лет) латентный период.
Необходимость изучения поздних лучевых повреждений обусловлено не столько значительной частотой их развития, сколько особенностями длительного торпидного клинического течения.
В зависимости от проявления лучевые реакции могут быть местными и общими.
Общие лучевые реакции при лучевой терапии. Общая лучевая реакция – это реакция всего организма на воздействие ионизирующего излучения, которая проявляется повышенной температурой, нарушением функции желудочно-кишечного тракта (извращение аппетита, тошнота, рвота и диарея), сердечно-сосудистой системы (тахикардия, гипотония) и изменениями в нервной и кроветворной системах.
Общая лучевая реакция реализуется вследствие прямого и непрямого локального действия ионизирующего излучения. В результате непосредственного поражения в зоне лучевого воздействия возникает угнетение кроветворения при попадании в зону облучения костного мозга и действие на клетки периферической крови (лимфоциты). Кроме того, имеется и опосредованное поражение организма, реализующееся вследствие воздействия радиотоксинов: липидных перекисей, производных хинона, белковых радиотоксинов (вследствие распада клеток опухоли и здоровых тканей), гистамина, холина. Эти соединения вызывают интоксикацию и могут вызвать угнетение кроветворения, что находит свое выражение в прогрессирующей гранулоцитопении, лимфопении с последующим развитием тромбоцитопении и, реже, анемии.
382
Степень общей лучевой реакции в значительной мере зависит как от применяемой дозы и ее режима фракционирования, так и от индивидуальной радиочувствительности организма больного.
Имеется определенная зависимость от области тела и объема тканей, подвергающихся облучению. Наиболее чувствительными в плане развития общей лучевой реакции являются голова, грудная клетка и живот.
По классификации экспертов ВОЗ, различают:
1.Легкие лучевые реакции: потеря аппетита, тошнота, однократная рвота.
2.Средней тяжести лучевые реакции: постоянная тошнота, рвота в течение первой и второй половины лечения, общая слабость.
3.Тяжелые реакции: многократная рвота на протяжении всего курса лучевой терапии (как в день облучения, так и в дни, когда облучение не проводилось).
Таким образом, ведущими клиническими признаками являются тошнота и рвота.
Тяжелые лучевые реакции, лейкопения (ниже 3 109/л) требуют перерыва в лечении. Общая лучевая реакция обратима. Все нарушенные процессы в органах и системах постепенно восстанавливаются и через 3-8 месяцев приходят к норме.
Для профилактики общей лучевой реакции больному с первого дня облучения назначается пища, обладающая радиозащитными свойствами: диета с повышенным содержанием белка (2 г на 1 кг массы тела), содержание жиров ограничивать не следует, но целесообразно, чтобы половина жиров была представлена растительным маслом. Два-три раза в неделю в диете должны быть печень, рыбные продукты. Диета должна содержать свежие овощи, фрукты, натуральные овощные и фруктовые соки. Положительным действием обладают молоко, ацидофильно-дрожжевые молочные продукты. Проводится витаминотерапия (витамины группы В, витамины С, А). Применяют поливитамины, в частности, ревит: ретинола ацетата 0,00086 (2500 МЕ), тиамина бромида 0,00129, рибофлавина 0,001, кислоты аскорбиновой 0,035.
Для профилактики общей лучевой реакции могут применяться радиопротекторы: мексамина гидрохлорид 0,05 г за 30 мин до сеанса лучевой терапии; цистамина дигидрохлорид по 0,2-0,8 г ежедневно или через день за 1 час до облучения. При тяжелых реакциях при проведении субтотального или тотального облучения применяется плазмаферез. Из средств, стимулирующих кроветворение, назначают лейкоген по 0,02 г 3 раза в день, батилол по 0,01 г 2-3 раза в день внутрь, тималин 10 мг в/м 1 раз в день (100 мг на курс). Очень эффективны колониестимулирующие факторы гранулоцитов, в частности, лейкомакс (рекомбинантный человеческий гранулоцитарно-макрофагальный колониестимулирующий фактор) – 3 мкг/кг до 10 мкг/кг массы в сутки. Максимальная продолжительность лечения 10 дней.
383
Из противорвотных средств назначают аминазин 25 мг 1-3 раза в день, церукал 10 мг внутрь до еды по 1-2 таблетки 2-3 раза в день, в/м по 2 мг
(0,01).
Больным, страдающим сердечно-сосудистыми заболеваниями, необходимо назначать соответствующие препараты и средства, повышающие артериальное давление (при гипотонии).
Комплексное применение указанных мероприятий чаще всего позволяет провести полный курс лучевой терапии без проявления лучевой реакции. В тех случаях, когда, несмотря на меры профилактики, появляются симптомы тяжелой общей лучевой реакции, необходимо делать перерыв в облучении, однако при этом следует помнить, что нарушение ритма облучения, особенно в первой половине курса, отрицательно сказывается на результатах лечения. Поэтому вынужденный перерыв при поглощенной дозе 20-30 Гр не должен превышать 3 дней. При дозе 40-50 Гр, в зависимости от характера заболевания, такие перерывы в лучевой терапии могут быть увеличены до 10-14 дней.
Местные лучевые поражения при лучевой терапии. В зависимости от продолжительности времени после облучения местные лучевые повреждения делятся на ранние и поздние (отдаленные). Восстановление сублетально облученных клеток происходит в течение 100 дней. Лучевые повреждения, развившиеся в этот срок (в течение 3 мес.), следует считать ранними. Все повреждения, развившиеся позже, являются поздними.
Местные лучевые реакции. Реакции кожи и подкожной клетчатки являются наиболее частыми, т.к. эти ткани прежде всего подвергаются воздействию радиации при наружном облучении. Наиболее часто реакции кожи наблюдаются при использовании противолежащих полей.
Радиочувствительность кожи зависит от ряда факторов. Так, имеются индивидуальные колебания радиочувствительности кожи, кожа женщин несколько радиочувствительнее, чем кожа мужчин, кожа сгибательной поверхности конечностей чувствительнее разгибательной.
Кожа обладает также регионарной радиочувствительностью, которая убывает в следующем порядке: шея, грудь, живот, бедра, спина, лицо. Наиболее чувствительна кожа подмышечной и паховой области, внутренней поверхности бедер, локтевого сгиба, области шеи. При базедовой болезни, при нефритах, диабете радиочувствительность кожи, соответственно, повышается. Воспаленная, гиперемированная кожа становится более радиочувствительной.
Различают следующие лучевые реакции кожи: эритема и радиодерматит (сухой и влажный).
Эритема – выраженная гиперемия кожи в зоне облучения, сопровождается отечностью, умеренным зудом. В основе развития эритемы лежит расширение капилляров кожи.
384
При прочих равных условиях эритема после однократного облучения развивается при дозе 4 Гр низковольтного рентгеновского облучения и 7,5-8 Гр гамма-излучения. При обычном фракционировании разовой дозы гаммаизлучения эритема развивается после дозы 30-35 Гр.
Спустя 2-3 недели после окончания облучения указанные явления обычно исчезают или, соответственно полю облучения, остается легкая пигментация с последующим шелушением, сохраняющаяся несколько месяцев.
Сухой радиодерматит – изменение кожи в зоне облучения, проявляющееся мелким шелушением эпидермиса, сухостью, пигментацией на фоне гиперемии, отечностью. Сопровождается зудом. Сухой радиодерматит обычно развивается после однократного облучения в дозе 8-
12Гр гамма-излучения или 40-50 Гр фракционированного.
Вэтих случаях восстановление облучаемой кожи не всегда полное – неравномерная депигментация, иногда развиваются телеангиоэктазии (стойкое расширение мелких подкожных кровеносных сосудов).
Влажный мокнущий радиодерматит характеризуется образованием мелких пузырьков с серозным или серозно-гнойным содержимым на фоне гиперемии и отечности облученной кожи. Влажный радиодерматит обычно развивается после высоких суммарных доз облучения (более 50 Гр фракционированного) или 12-16 Гр однократного гамма-излучения. После вскрытия пузырьков и отторжения эпидермиса обнажается мокнущая яркокрасная, слегка кровоточащая поверхность. Эпителизация происходит медленно, после чего чаще остается сухая, пигментированная атрофичная кожа.
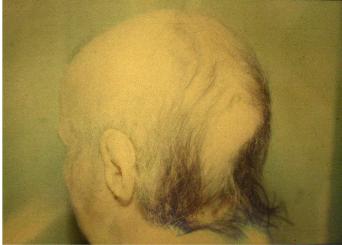
Лучевые реакции кожи всегда сопровождаются выпадением волос в зоне облучения (рис. 11.1). В зависимости от тяжести лучевой реакции эпиляция бывает постоянной и временной, когда волосы отрастают, но они бывают, как правило, неполноценными (редкие, сухие и седые).
Рис. 11.1. Выпадение волос через 3 недели после телегамматерапии на весь головной мозг в суммарной очаговой дозе 30 Гр (разовая доза 3 Гр) по поводу метастазов рака в головной мозг.
385
Пороговая поглощенная доза облучения, вызывающая эпиляцию, близка к 2,5-3 Гр на голову.
При этой дозе и более высокой, примерно до 6 Гр, выраженная эпиляция начинается на 14-17-е сутки болезни. При крайне большой степени тяжести поражения эпиляция возникает на 8-9 сутки.
Особенно радиочувствителен волосяной покров на голове и подбородке, в меньшей степени – на груди, животе, лобке, конечностях. Эпиляция ресниц и бровей возникает при облучении в дозе 10 Гр и более. Облучение головы в дозе более 12-15 Гр однократно ведет к постоянной эпиляции.
Патоморфологическая картина лучевых реакций кожи и слизистых оболочек характеризуется в основном картиной острого расстройства микроциркуляции (стаз, спазм мелких кровеносных сосудов) и наличие отека облученных тканей.
Лучевые реакции слизистых оболочек (мукозиты, лучевые эпителииты) развиваются при облучении полых органов. Они могут наблюдаться одновременно с лучевой реакцией кожи или изолированно. Но так как слизистые обладают большой радиочувствительностью, то на них лучевые реакции могут возникнуть при меньших дозах, чем кожные реакции.
Различают следующие стадии лучевого эпителиита. При I стадии эпителиита имеются гиперемия и легкий отек слизистой. В дальнейшем происходит ороговение эпителия и слизистая представляется белесоватой, помутневшей, суховатой (стадия гиперемии).
При II стадии возникает отторжение ороговевшего эпителия и образование одиночных эрозий с некротическим налетом (стадия очагового пленчатого эпителиита).
При III стадии происходит обширное отторжение эпителия и образование сплошной эрозивной поверхности (стадия сливного пленчатого эпителиита).
Из слизистых оболочек наиболее радиочувствительна конъюнктива. Реакции здесь характеризуются тем, что между 17 и 21-м днями после дозы облучения в 25-30 Гр слизистая краснеет через 2-3 дня, после этого появляются эрозии и дифтерийноподобный налет вследствие пропотевания фибрина.
Обычно, если не было передозировки, все явления проходят через 2-3 недели после лечения.
Слизистая оболочка ротовой полости в процессе облучения становится отечной, гиперемированной и болезненной. Нередко отмечаются ксеростомия (сухость во рту, связанная с подавлением функции слюнных желез), нарушение вкусовых ощущений.
При облучении гортани и глотки изменения со стороны слизистой оболочки клинически выражаются в скоропроходящих явлениях:
386
охриплостью голоса, болями и затруднением при глотании. Лучевой ларингит возникает обычно при СОД 40-45 Гр.
Реакция со стороны бронхов проявляется сухим приступообразным кашлем, одышкой, болями в грудной клетке, иногда умеренным повышением температуры тела. Нередко развивается лучевая пневмония.
Реакция слизистой пищевода характеризуется дисфагией (чувство жжения и затруднения при прохождении пищи), болями за грудиной и в межлопаточном пространстве, слюнотечением. Лучевой эзофагит может возникать при СОД 30-40 Гр.
Реакция со стороны слизистой оболочки кишечника (лучевой энтерит, колит, ректит) выражается в появлении учащенного жидкого стула с примесью слизи и, реже, крови, тенезм (ложные позывы на дефекацию), спастических болей. Лучевой ректит возникает при СОД 50-60 Гр.
Реакция со стороны слизистой оболочки мочевого пузыря проявляется учащенным, болезненным мочеиспусканием, болями внизу живота. Возникает обычно при СОД 35-40 Гр.
Слизистая оболочка шейки и тела матки обладает довольно высокой резистентностью. Радиоэпителиит этих органов может развиться при СОД свыше 60 Гр.
Для предупреждения местных лучевых реакций кожи ее обычно обрабатывают растительным и животным маслами, индифферентными кремами. При появлении эритемы применяют витаминизированный рыбий жир, облепиховое масло, 0,5% преднизолоновую мазь. При развитии сухого радиодерматита используют мазь оксикорт или 0,5% преднизолоновую, 1- 10% метилурациловую, 10% стрептоцидовую и другие мази. Мазь наносят на облучаемую кожу 2 раза в сутки (утром после ночного сна и днем после обеденного сна; перед сном смазывать не следует, т.к. жир за ночь стирается). Лечение влажного эпидермита проводят чаще открытым способом без повязки. Широко используются витаминосодержащие препараты: пантенол, «Олазоль», при радиоэпителиитах – 5-10% раствор димексида.
Для профилактики и лечения радиоэпителиитов избегают механических и термических воздействий, обрабатывают 0,25-1% раствором новокаина, масляными инсцилляциями (оливковое, подсолнечное, персиковое масло).
С целью профилактики, а также чтобы облегчить течение лучевых пульмонитов, применяются глюкокортикостероиды.
Лечение лучевых циститов и ректитов сводится в основном к промыванию мочевого пузыря и прямой кишки антисептическими растворами (фурациллин 1:5000), прямую кишку ежедневно промывают теплым раствором настоя ромашки. На ночь назначаются микроклизмы из вазелинового масла, масла шиповника, 5% раствора димексида.
387
Лучевые повреждения. При ранних лучевых повреждениях, т.е. при таких лучевых поражениях, когда самостоятельное восстановление невозможно, страдают более радиочувствительные и хорошо регенерирующие структуры.
Острый лучевой некроз отличается бурным течением. Уже через 7-10 дней эритема приобретает стойкий характер, сопровождается сильными болями, ухудшением общего состояния и повышением температуры. Увеличиваются периферические лимфатические узлы. В первые дни после облучения появляются пузыри со светлой или сукровичной жидкостью. По вскрытии пузырей и отторжении эпидермиса обнаруживается некроз тканей, поверхность которых покрыта неснимающимся желтоватым налетом. По отторжении некротизированных тканей обнаруживается глубокая язва с подточенными крутыми краями. Весь процесс сопровождается сильными болями, однако в некоторых случаях ранние лучевые некрозы могут развиваться и без выраженных болей и отека. Острый лучевой некроз наблюдается при больших дозах фракционированного облучения (порядка
100Гр и больше) при разовых дозах более 20-50 Гр.
Воснове поздних лучевых повреждений лежат нарушения более радиорезистентных структур, требующих при одних и тех же дозах ионизирующего излучения большего времени для реализации лучевого повреждения. Клинические проявления позднего лучевого повреждения являются следствием постепенного накапливания изменений в мелких кровеносных и лимфатических сосудах, обусловливающих нарушения микроциркуляции и развитие гипоксии облученных тканей, следствием чего является их фиброз и склероз. В этом процессе также играет существенную роль гибель клеточных элементов с замещением их рубцовой тканью, а также резкое угнетение репаративных возможностей клеток.
К поздним лучевым повреждениям относят:
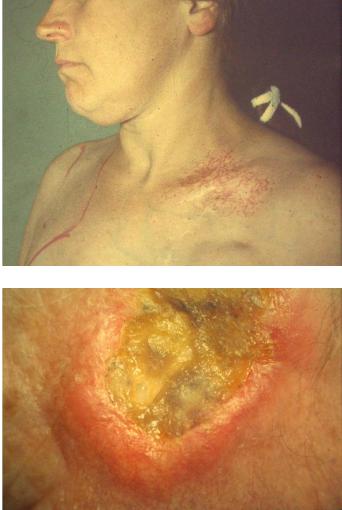
1.Атрофические процессы (рис.11.2).
2.Гиперпластические процессы.
3.Лучевой фиброз или индуративный отек.
4.Лучевые язвы, поздние некрозы (рис.11.3).
5.Лучевой рак.
Ранние и поздние лучевые изменения нормальных тканей у детей. Наиболее выраженные нарушения развития тех или иных органов происходят в случаях облучения их в период активного роста. При этом на первое место выступает так называемый отсроченный эффект, который не следует путать с отдаленным действием излучений. Последнее выражается в повреждении того или иного органа, развивающегося через значительный промежуток времени (например, катаракта). В то время как первый развивается медленно и проявляется постепенно, по мере роста ребенка (например, укорочение конечностей, недоразвитие челюстей, зубов, мышц и др.).
Ранние лучевые реакции у детей, в основном, быстро проходящие,
388
Рис. 11.2. Атрофия кожи с участками депигментации и телеангиоэктазии в области левой ключицы через 5 лет после телегамматерапии по поводу рака молочной железы в суммарной очаговой дозе 50 Гр обычными фракциями (2 Гр).
Рис. 11.3. Поздняя лучевая язва на коже через 7 лет после близкофокусной рентгенотерапии по поводу плоскоклеточного рака в суммарной очаговой дозе 75 Гр.
появляются обычно в процессе облучения или спустя 1-3 недели после его окончания. Поэтому остановимся на рассмотрении отдаленных и отсроченных радиационных эффектов, которые появляются в виде косметических и функциональных дефектов.
Кожные покровы и подкожно-жировая клетчатка. Эритема кожных покровов у ребенка при конвенциальной гамма-терапии (60Со) возникает при дозе 30 Гр. По данным, полученным при изучении отдаленных результатов лечения детей, больных саркомой Юинга, признаки склероза подкожножировой клетчатки наблюдались при такой же дозе, подведенной в период полового созревания.
Костная ткань. В настоящее время установлено, что для кости, рост которой полностью прекратился, толерантность к облучению довольно высока (60-65 Гр при обычном фракционировании). Однако даже небольшие дозы излучений высоких энергий, подведенные к растущей кости, могут вызвать подавление ее роста.
Искривления позвоночника (кифоз, лордоз, сколиоз) встречаются у 2370% детей после лучевой терапии. После облучения тазовой области, из-за недоразвития костей, нередко у повзрослевших больных наблюдается
389
хромота, особенно при дозах на тазобедренный сустав свыше 20 Гр. При этом максимальный эффект выявляется у тех детей, которые облучались в возрасте до 3-х лет.
По данным Всемирной организации здравоохранения (ВОЗ, 1983), порог появления признаков лучевого нарушения роста костной ткани, согласно концепции НСД, равен 300 терапевтическим эквивалентам рада в возрасте от 0 до 1 года; 800 – от 1 до 2-х лет и 1000 – старше 2-х лет.
Головной мозг. Острые реакции на облучение головного мозга обусловлены развитием отека тканей этого органа. Они обычно носят проходящий характер и не оказывают влияние на последующую жизнь ребенка.
Отдельные поздние изменения могут привести к серьезным осложнениям, вплоть до некроза тканей мозга, который может появиться в период от нескольких месяцев до нескольких лет после окончания облучения. Если положить в основу этого осложнения изменения в сосудах, то можно установить, что они в виде гибели микрососудов наиболее часто встречаются в возрасте до 3-х лет. У детей, подвергшихся облучению всего головного мозга в суммарных дозах свыше 20 Гр при обычном фракционировании и разовых дозах 1,5-2 Гр, могут поражаться капилляры с последующим развитием микрообызвествлений. При таком способе подведения дозы у 1% детей выявляется клинически слабо выраженная кратковременная неврологическая дисфункция. Также необходимо отметить, что терапевтическое облучение головного мозга у очень маленьких детей, т.е. до завершения миелинизации и полного развития мозга, может привести к недоразвитию мозга и дисфункции мозга. У детей младшего возраста недельная доза на головной мозг не должна превышать 8 Гр; превышение этой дозы повышает вероятность развития миелопатии.
Спинной мозг. Лучевые поражения спинного мозга обычно проявляются через несколько недель или лет после окончания облучения. При облучении 20 см спинного мозга допустима доза до 30 Гр, подводимая по 1,2 Гр в день 5 раз в неделю; при меньших объемах – 45 Гр, по 8 Гр за неделю. Риск повреждения резко возрастает с уменьшением числа фракций, зависит от длины облучаемой части спинного мозга, но почти не зависит от общей продолжительности облучения.
Сердце. Было показано, что лучевые повреждения сердца развиваются через несколько месяцев или даже лет после окончания лучевого лечения детей, больных лимфогранулематозом. Проявления и симптомы лучевого перикардита аналогичны перикардиту любой этиологии. К ним, прежде всего, можно отнести появление температуры, тахикардию, шум трения перикарда. На электрокардиограмме поражение сердечной мышцы выявляется в виде сглаживания зубцов Т, подъема интервалов ST и снижения комплекса QRS. Клиническое течение лучевого перикардита широко варьирует: у одних больных процесс остается ограниченным, а у других
390
прогрессирует до слипчивого перикардита. Наиболее часто повреждается пристеночный слой перикарда с его утолщением. У детей после облучения сердца в дозе 30 Гр при обычном фракционировании уже имеется опасность повреждения перикарда и даже развития микроинфарктов.
Легкие. Первой и основной реакцией легочной ткани на ее облучение является пульмонит. Тяжесть проявления и его исход зависят от величины и схемы фракционирования дозы, объема облученной легочной ткани и возраста ребенка, при котором это произошло. В возрасте до 4-х лет облучение всего легкого допустимо в дозе 12-15 Гр по 1,5 Гр ежедневно 5 раз в неделю, при расчете дозы на центр легкого рекомендуют дозу 12 Гр за 10 сеансов в течение 2-х недель. У детей более старшего возраста радиочувствительность легочной ткани приближается к таковой у взрослого человека. Облучение 75% легкого в дозе 20 Гр при обычном фракционировании может привести к развитию пульмонита у 20% больных.
Почки. Толерантность почечной ткани к воздействию излучений наименьшая у ребенка до 2-х лет, затем она приближается к толерантности взрослого человека. Первые две-три недели после облучения почек отмечается уменьшение клубочковой фильтрации и обратного всасывания в почечных канальцах. Выздоровление обычно растягивается на многие годы. Суммарные дозы излучения свыше 20-25 Гр при обычном фракционировании несут повышенный риск стойкого нарушения почечной функции, позднее повреждения проявляются в виде гипертонии, альбуминурии, функциональной недостаточности почек. Полагают, что доза 16-20 Гр на всю почку, подведенная обычным фракционированием, является переносимой без каких-либо функциональных нарушений.
Канцерогенез. Большое внимание привлекает опасность возникновения нового опухолевого процесса у лиц, переносивших комплексное лечение. Это впервые было отмечено спустя несколько лет после открытия рентгеновского излучения у детей, перенесших облучение в низких дозах по поводу неопухолевых заболеваний (воспаление сальных желез, стригущего лишая и др.). В настоящее время, когда 60-70% детей, перенесших злокачественные опухолевые заболевания, живут длительное время, у них к 20-летнему возрасту риск повторного возникновения злокачественных опухолей достигает 12%. При этом у детей младшего возраста опасность развития второй опухоли после ранее проведенного лечения выше, чем у старших детей. Развитие новых опухолей большей частью происходит в облученных тканях. Необходимо отметить, что риск индуцирования рака возрастает с дозой до нескольких грей и несколько уменьшается при более высоких дозах, что, по-видимому, определяется гибелью клеток под действием излучения.
Латентные периоды для возникновения большинства злокачественных бластом превышают 30 лет и сильно варьируют.
391
Лечение лучевых повреждений. Лечение должно быть комплексным, сочетающим общие мероприятия с местным воздействием на поврежденную кожу. Общие лечебные мероприятия направлены на повышение жизненного тонуса организма и активацию репаративных процессов. Это достигается высококалорийным питанием, назначением комплекса витаминов, свежих фруктов и овощей. Рекомендуется ежедневный туалет язвы и обработка раствором антибиотиков, а в дальнейшем накладывают повязки с противоожоговыми мазями, в том числе содержащими облепиховое масло. Иногда применяют новокаиновую блокаду 0,25% раствором. В тех случаях, когда консервативное лечение неэффективно при анатомической дозволенности, встает вопрос о раннем хирургическом вмешательстве с некрэктомией или ампутацией пораженного сегмента конечности не позже, чем через 2-2,5 месяца, т.е. в сроки, когда еще только намечается ограничение зоны некроза. Сроки лечения тяжелых местных поражений затягиваются от 0,5 до 1 года.
Лечение поздних лучевых повреждений должно строиться с учетом клинической формы повреждения. При атрофическом дерматите рекомендуется применять стероидные и витаминизированные масла. При лечении гипертрофических процессов и лучевого фиброза применяются рассасывающие препараты, такие как димексид, лидаза или ронидаза и глюкокортикостероиды. Целенаправленный лекарственный электрофорез димексида, протеолитических ферментов и гепарина нередко дает хороший терапевтический эффект. Эта методика дает хорошие результаты и при лечении поздних лучевых язв и некрозов. Однако основным методом лечения таких повреждений следует считать радикальное иссечение поврежденных тканей с последующим кожно-пластическим замещением дефекта. Показания к применению кожной пластики (расщепленным лоскутом или несвободным
– чаще филатовским стеблем) определяются тканевой и регионарной циркуляцией соседних и подлежащих тканей.
Радиационная защита пациентов при лучевой терапии. При лучевой терапии злокачественных опухолей поглощенные дозы ионизирующего излучения определяются согласно клиническим показаниям в соответствии с принципами радиационной онкологии и направлены на достижение максимальной избирательности поражения опухолей. Так как дозы при этом используются большие, в отличие от лучевой диагностики, лучевое воздействие на пациентов сопровождается детерминированными эффектами со стороны здоровых тканей, однако при этом не должна быть превышена толерантность, т.е. предельная лучевая нагрузка, не приводящая к необратимым изменениям ткани. Лечебное использование источников ионизирующих излучений из рассмотрения частоты стохастических эффектов принято исключать, поскольку оно в большинстве случаев имеет место лишь при злокачественных новообразованиях. Лица, страдающие такими заболеваниями, в силу характера заболеваний и возраста, в котором
392
они развиваются, не могут обусловить существенный вклад в генетически значимую дозу. С учетом латентного периода, присущего индуцируемым радиацией опухолям, является практически несущественным и риск возникновения новой опухоли в результате терапевтического облучения уже имеющегося новообразования. Вместе с тем, в лучевой терапии особое значение имеют детерминированные поражения, если учесть, что отклонение в подводимой дозе на 5% считается критическим как для излечения опухоли, так и для воздействия на нормальные ткани.
При этом используется принцип обоснования и оптимизации в соответствии с НРБ-2000. При проведении лучевой терапии должны быть приняты все возможные меры для предотвращения лучевых осложнений у пациента (ОСП-2002).
Самым важным для защиты больного в лучевой терапии является точное подведение правильно назначенной дозы излучения на зону опухолевого поражения при минимально возможном облучении здоровых тканей.
В связи с этим предъявляются высокие требования к дозиметрическому обеспечению лучевого лечения, для чего предусматривается оснащение радиологических отделений компьютерными томографами, рентгенологическими симуляторами, дозиметрическими и планирующими системами.
Планирование облучения при лучевой терапии с использованием открытых радионуклидных источников основано на учете метаболизма радиофармацевтического препарата, а также его физических характеристик. На основании этой информации, зная примерные значения масс органов и тканей, выполняются расчеты доз излучения как в объеме мишени, так и в органах и тканях, представляющих интерес.
При внешнем дистанционном облучении больного нужно укладывать так, чтобы укладка была воспроизводимой. Больной должен находиться в удобном положении; при необходимости используются средства иммобилизации. Эти средства применяют для воспроизведения положения больного при каждом сеансе облучения; они имеют особое значение, когда больному трудно самому сохранять желательное положение облучения.
Нужно заранее рассчитать и независимо проверить продолжительность облучения.
Для защиты нормальных тканей часто помещают в пучок излучения поглощающие материалы: фигурные блоки, клиновидные фильтры, решетчатые диафрагмы, компенсирующие фильтры.
Контроль характеристик пучка излучения и непосредственные измерения на пациенте осуществляются с помощью соответствующих дозиметров. При внешнем облучении дозные измерения должны давать дозы излучения в определенных точках при определенных условиях с погрешностью ±3%. Измерения глубинных доз, коэффициентов ослабления
393
клиновидных фильтров и приставок для блоков должны выполняться с погрешностью 0,5-2%. Активность используемого радионуклида следует знать с погрешностью ± 5%.
Имеются программы контроля качества оборудования для лучевой терапии, включая приемные испытания и периодические эксплуатационные испытания для проверки неизменности начальных условий.
Радиационная защита персонала при проведении лучевой терапии. По степени радиационной опасности методы лучевого лечения можно расположить в следующем порядке: внутриполостная терапия с помощью традиционных методов введения радиоактивных препаратов, терапия с помощью шланговых аппаратов и дистанционная терапия.
Радиационная защита персонала при проведении дистанционной лучевой терапии зависит, главным образом, от качества стационарной защиты, продолжительности и количества укладок на гамма-аппаратах и системы мероприятий по предупреждению аварийных ситуаций. Помещения для дистанционной лучевой терапии располагаются в отдельных зданиях или в изолированных частях лечебных корпусов. Из зала облучения во время сеанса удаляются все лица, кроме больного. Пульт управления выносится в смежное помещение, и связь с больным во время процедуры облучения поддерживается по телефону и с помощью замкнутой телевизионной системы. Вход в помещение, где находится мегавольтный источник или гамма-аппарат, выполняется в виде лабиринта.
С помощью блокировки защитной двери гарантируется невозможность внезапного появления персонала в зоне облучения.
В помещениях для дистанционной лучевой терапии запрещено проводить какие-либо работы, не предусмотренные должностной инструкцией и другими нормативными документами, если эти работы не направлены на предотвращение аварий и других обстоятельств, угрожающих здоровью работающих и нормальной работе учреждения.
Перезарядка гамма-терапевтических аппаратов должна производиться только специализированными организациями, имеющими разрешение СЭС на проведение этих работ.
При контактной лучевой терапии радиационная опасность для персонала заключается во внешнем облучении потоками гамма-квантов и бета-частиц (аппликаторы), что возможно на всех этапах работы с источниками. Радиационная безопасность при работе с закрытыми источниками гамма-бета-излучения реализуется двумя параллельными путями: применением защитных экранов, смотровых окон, дистанционных инструментов и правильной организацией работы, обеспечивающей минимальные затраты времени на проведение каждого этапа. Оба пути тесно связаны друг с другом и зависят от технологической схемы подготовки и проведения лечебной процедуры. При ручном выполнении все манипуляции, связанные с проведением контактной терапии, являются радиационно
