
- •4.Квантово-механическое представление об атоме.
- •5. Принцип неопределенности гейзенберга
- •1)Г.К. Число – n (от 1 до )
- •4)Спиновое – s
- •II: взаимодейств. 2s и 2p орбиталей:
- •Химическая связь
- •4) Металлическая связь — химическая связь, обусловленная наличием относительно свободных электронов. Характерна как для чистых металлов, так и их сплавов и интерметаллических соединений.
- •2. Ковалентная связь.
- •8. Ионная связь.
Химическая связь
1. Виды химической связи:
1) Ионная связь — прочная химическая связь, образующаяся между атомами с большой разностью (>1,7 по шкале Полинга) электроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью.
2) Ковалентная связь (атомная связь, гомеополярная связь) — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
а) Если атомы, образующие простую ковалентную связь, одинаковы, то истинные заряды атомов в молекуле также одинаковы, поскольку атомы, образующие связь, в равной степени владеют обобществлённой электронной парой. Такая связь называется неполярной ковалентной связью.
б)ЕСли атомы различны, то степень владения обобществленной парой электронов определяется различием в электроотрицательностях атомов. Атом с большей электроотрицательностью сильнее притягивает к себе пару электронов связи, и его истинный заряд становится отрицательным. Атом с меньшей электроотрицательностью приобретает, соответственно, такой же по величине положительный заряд. Если соединение образуется между двумя различными неметаллами, то такое соединение называется ковалентной полярной связью.
3) Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать N, O или F. Водородные связи могут быть межмолекулярными или внутримолекулярными
Относительная электроотрицательность ( используется для удобства)
4) Металлическая связь — химическая связь, обусловленная наличием относительно свободных электронов. Характерна как для чистых металлов, так и их сплавов и интерметаллических соединений.
Cs |
Li |
c,s |
n, cl |
o |
f |
br |
0,7 |
1,0 |
2,5 |
3,0 |
3,5 |
4,0 |
2,8 |
Электроотрицательность минимальна – элементы IA подуровней
Электроотрицательность максимальна – F и O
Кривая поллинга. Способность атома оттягивать к себе общую электронную пару.
2. Ковалентная связь.
Ковалентная связь (атомная связь, гомеополярная связь) — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений.
Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными.
Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Электроны тем подвижнее, чем дальше они находятся от ядер.
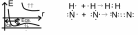 3.
Метод валентных связей
3.
Метод валентных связей
Основные положения.
1) В образованиии химических связей учавствуют электроны с противоположными спинами.
2) При образовании связи а) выделяется энергия б) происходит перекрывание электронных облаков атомов.
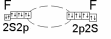 3)
пара атомов в молекуле удерживается
при помощи одной или нескольких
электронных пар. При этом каждый атом
приобретает устойчивую 8-и электронную
оболочку.
3)
пара атомов в молекуле удерживается
при помощи одной или нескольких
электронных пар. При этом каждый атом
приобретает устойчивую 8-и электронную
оболочку.
4.Свойства химических связей
1) Энергия E (КДж/моль) – энергия которая выделяется при образованиихимической связи, или которую нужно затратить для разрушения связи. H+h=h2+435 КДж/моль, Eсв(o2) = 493; Eсв(n2) = 945.
2)длина св(а) – расстояние между ядрами взаимодествующих атомов. abга+гВ; гн=0,53а; гн-н=0,74А
3)насыщеность – если атом образует конечное число связей с другим атомом-связь насыщеная, если нет – то ненасыщенная.
4)направленность – если в пространстве существуют определенные направления, вдоль которых распростр. действ. связи, то свзязь – направленная, если таких нет – ненапрвленная.
5) Полярность: дипольная момент. св.
Mсв., d(дебай): D=3,33*10-30Кл Мсв=f(æ) Mсв=lдип*q, lдип – ДЛИНА ДИПОЛЯ
при Мсв <4d – ковалентная полярная При Мсв >4-11D – преобладает доля ионной связи.
5.
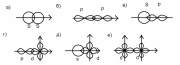 Связь
образованная перекрещиванием электронных
облаков по оси проходящей через ядро
атомов – s связь(если в сяви учавствуют
только s-орбитали).
Связь
образованная перекрещиванием электронных
облаков по оси проходящей через ядро
атомов – s связь(если в сяви учавствуют
только s-орбитали).
Связь образованная перекрыванием электронных облаков по обе стороны от оси , проходящей через ядра атомов – p-связь.
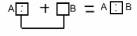

Донорно-акцепторная связь: Один атом (донор -А) педоставляет для образования связи неподеленую пару электронов, а друго (акцептр-В) – вакантную ячейку.
 6.sp-гибридизация(180o)
bef2
f-be-f
be
1s22s2
be*2p
6.sp-гибридизация(180o)
bef2
f-be-f
be
1s22s2
be*2p
 2s
2s
линейная молекула
sp-гибридизация -связь
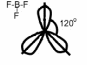
SP2-гибридизация(120o). bF3 B 1s22s22p1 B* 2p
2s
sp3-гибридизация(109,28o) ch4 c 1s22s22p2 c* 2p
тетраэдр 2S
7.неполярные молекулы с гибридной связью. если 2-х атомная молекула состоит из атомов одного элемента (h2, n2, cl2), то каждое электронное облакоЮ образованное общей парой электронов и осуществляющей ковалентную связь, распределяется в пространстве симметрично. относительно ядер обоих атомов. если Полярная двухатомная молекула состоит из атомов различных элементов, то общее электронное облако смещено в сторону одного из атомов так, что возникает ассиметрия в распространении заряда.
Постоянный диполь = 0 Дипольный момент :q*e(заряд*длинну связи).
