
- •4.Квантово-механическое представление об атоме.
- •5. Принцип неопределенности гейзенберга
- •1)Г.К. Число – n (от 1 до )
- •4)Спиновое – s
- •II: взаимодейств. 2s и 2p орбиталей:
- •Химическая связь
- •4) Металлическая связь — химическая связь, обусловленная наличием относительно свободных электронов. Характерна как для чистых металлов, так и их сплавов и интерметаллических соединений.
- •2. Ковалентная связь.
- •8. Ионная связь.
1.
1) 1897г.- открытие Д.Томсоном электрона (. Электроны могут быть выделены из любого элемента. – положительно заряженная частица, => в атоме должны содержаться отрицательные заряженные частицы. Радиоактивность – явления испускания некоторыми элементами излучения. 2)Наименьшая чисть химического элемента – атом. В конце ХIXв. Беккерель открыл радиоактивность излучения, в дальнейшем теми же исследованиями занимался Резерфорд. Пучок радиоактивного излучения в сильном магнитном поле разделился на АЛЬФА, БЕТА и ГАММА излучения, где АЛЬФА ИЗЛУЧЕНИЕ – ядра He(Гелия), БЕТА ИЗЛУЧЕНИЕ- поток электронов или позитронов, ГаММА ИЗЛУЧЕНИЕ – КОРОТКОВОЛНОЕ МАГНИТНОЕ ИЗЛУЧЕНИЕ. 3) пОД ДЕЙСТВИЕМ МАГНИТНОГО ПОЛЯ РАДИОАКТИВНОЕ ИЗЛУЧЕНИЕ РАЗДЕЛЯЕТСЯ НА ТРИ ПОТОКА: ГАММА – НЕЙТРАЛЬНОЕ(НЕ ОТКЛОНЯЕТСЯ); АЛЬФА – ОТКЛОНЯЕТСЯ В СЛУЧАЕ ПОЛОЖИТЕЛЬНОГО ЗАРЯДА , БЕТА - в СЛУЧАЕ ОТРИЦАТЕЛЬНОГО ЗАРЯДА.
2.
Диаметр атома - , а ядра - .Резерфорд провел серию опытов по рассеиванию -Частиц. От радиоактивного источника, заключенного в свинцовый контейнер, α-частицы направлялись на тонкую металлическую фольгу. Рассеянные частицы попадали на экран, покрытый слоем кристаллов сульфида цинка, способных светиться под ударами быстрых заряженных частиц. Сцинтилляции (вспышки) на экране наблюдались глазом с помощью микроскопа. Наблюдения рассеянных -частиц в опыте Резерфорда можно было проводить под различными углами φ к первоначальному направлению пучка. Было обнаружено, что большинство -частиц проходит через тонкий слой металла, практически не испытывая отклонения. Однако небольшая часть частиц отклоняется на значительные углы, превышающие 30°. Очень редкие -частицы (приблизительно одна на десять тысяч) испытывали отклонение на углы, близкие к 180°. Этот результат был совершенно неожиданным даже для Резерфорда. Его представления находилиcь в резком противоречии с моделью атома Томсона, согласно которой положительный заряд распределен по всему объему атома. При таком распределении положительный заряд не может создать сильное электрическое поле, способное отбросить -частицы назад.
3.
корпускулярныЕ свОЙСТВА ФОТОНА ВЫРАЖАЮТСЯ ИЗ УРАВНЕНИЯ пЛАНКА (фотон поделен и существует в виде дискретного образ. (волновой). ; . В соответствии с уравнением энштейна . В 1942г. де Бройль ПРЕДПОЛОЖИЛ, что двойственная природа присуща и электрону : уравнение де бройля.
1) : =108 см/сек
2)тенисный мяч =25 м/сек .
4.Квантово-механическое представление об атоме.
Строение атома. Ядро атома состоит из положительнозаряженных протонов, не имеющих заряда нейтронов. Ядро окружают отрицательно заряженные Электроны. Электроны движутся вокруг ядра по неопределенной траектории. Химические свойства атома определяется концентрацией электромагнитной оболочки. Положение в таблшице менделеева определяется электрическим зарядом его ядра. если атом находиться в нейтральном состояни, то количество электронов равно количеству протонов. Основная масса атома сосредоточена в ядре.
5. Принцип неопределенности гейзенберга
классическая механика – скорость частицы, траектория.
Квантовая механияка – вероятность нахождения частицы в точке пространства – понятие импульса . -неопределенности. - постоянная планка. Невозможно определить положение и скорость частицы атомного масштаба (чем точнее одно, тем неопределеннее другое).
6.
Шрединберг предположил, что состояние движущегося в атоме электрона должно описываться известным в физике уравнением стоячей электромагнитной волны. Подставив в это уравнение вместо длинный волны ее значение из уравнения де броиля ,получим уравнение , связывающее энергию электрона с пространственными координатами и волновой функцией . Вероятность обнаружения электрона в некотором малом объеме выражается: 2V. 2 – выражает плотность вероятности.
обозначают Т2
В УРАВНЕНИЕ ШРЕДИНГЕРА ВХОДЯТ КОВСТВЕННЫЕ КООРДИНАТЫ – X,Y,Z.
ФИЗИЧЕСКИЫЙ СМЫСЛ: – квадрат по абсолютному значению – вероятность нахождения электрона в близи точки с координатами X,Y,Z и энергией E; c учетом принципа неопределенности гейзенберга -орбит.
n=1 n2=1 S; n=2 n2=4 Sp3; n=3 n2=9 Sp3d5; n=4 n2=16 Sp3d5f7
7.
1)Г.К. Число – n (от 1 до )
характеризует общий запас энергии на уровне числовые обозначения 1234567…. Буквенное k,l,mn,o,p,q.
2)Побочное (орбитальное) – (от 0 до(n +1)). Запас энергии на подуровне , который возникает из-за разности формы орбит. число подуровней равно номеру уровня.
e |
s1 |
p2 |
f3 |
4f |
q5 |
|
|
|
|
|
|
3)Магнитное – m(от –l до +l) через о.
траектория ве-ра магнитного момента, на произвольно выбранное направление внешнего магнитного поля.
Орбиталь |
|
m |
число ячеек |
S |
0 |
-0 |
1 |
p |
1 |
-1,0,1 |
3 |
d |
2 |
--2,-1,0,1,2 |
5 |
f |
3 |
-3,-2,-1,0,1,2,3 |
7 |
4)Спиновое – s
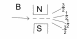 дополнительное
энергетическая характеристика электрона,
которая которая удваивает каждое
значение m
. в
модели бора его объясняют вращение
электрона вокруг оси , при этом существет
некоторый угловой момент импульса –
сплошной момент.
дополнительное
энергетическая характеристика электрона,
которая которая удваивает каждое
значение m
. в
модели бора его объясняют вращение
электрона вокруг оси , при этом существет
некоторый угловой момент импульса –
сплошной момент.
- спаренные электроны -неспаренные электроны
Атом Бора: 1s22p22p1 2p1: n=2; l=1; m=-1,0,1.
8.
 Электронное
облако - область пространства вблизи
ядра атома, к которойсосредот. преобраз.
часть заряда и массы электрона. Плотность
тем больше, чем больше вероятность
обнаружения электрона в области
Электронное
облако - область пространства вблизи
ядра атома, к которойсосредот. преобраз.
часть заряда и массы электрона. Плотность
тем больше, чем больше вероятность
обнаружения электрона в области
1s – сфера , обладает сферической симметрией . Расположение по одну сторону от оси абсцисс.
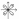
 2p
-
2p
-
сосредоточено в оси x, в плоскости y,z электронного облака нет.
d-(l=2)
Четырехлепестковая фигура, знаки волновой среды чередуются
Пространственная орбита.
9.
Стационарное строение электрона : не излучает магнитной энергии. Характеризуюется состоянием стоячей волны де бройля (минимальное значение его энергии), другое – возбужденное – волна де бройля имеет переменное значение , Энергия ионизации – энергия гид расходуемая для отрыва электрона от атома.
Потенциальная ионизация – минимальное напряжение поля, при котором атом ионизируется A=
чем меньше I, тем легче атом отдает электрон, тем активнее Ме i1,i2<i3<…<in.СРОДСТВО ЭЛЕКТРОНу – это энергия выделяющаяся при присоединении электрона к электроотриц. атому: A+
Электроотрицательность – способность атома притягивать к себе электроны. Эо= e – Сродство к электрону. Для удобства используют значения относительной электроотрицательности(ЭО).
Cs |
Li |
c,s |
n, cl |
o |
f |
0,7 |
1,0 |
2,5 |
3,0 |
3,5 |
4,0 |
11.
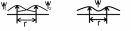 молекулярных
электр. орбиталей, каждой из которых
соответствет определен. набор молекулярных
квантовых чисел. На каждой МО может
находиться не более 2-х электронов с
противоположнонаправленными спинами
– принцип паули. =с11+
с22…(-амплитуда
волновая)
молекулярных
электр. орбиталей, каждой из которых
соответствет определен. набор молекулярных
квантовых чисел. На каждой МО может
находиться не более 2-х электронов с
противоположнонаправленными спинами
– принцип паули. =с11+
с22…(-амплитуда
волновая)
с11+ с22= с(1+ 2)= 1+ 2=... Если возрастает, то возрастает плотность электронного облака.
кратность связи определяется по числу связывающ. электронов, учавствовавщих в ее образовании -простая связь, 4 . I и II период: 2h(1s//]h2(св1s)2]+435Кдж
h[is/+h+h2+[(св1s/)]+259 кдж he[is2]+he[1s/)he2+[(св1s)=(свsp1s)]+239 кдж
