
Энергия гиббса
Чтобы судить о возможности самопроизвольного протекания реакции, необходимо учитывать два фактора - энтальпийный (Н) и энтропийный (S) (при p = const и Т = const). Произведение ТS дает энтропийному фактору размерность энергии, т.е. Дж/моль.
Общая движущая сила процесса |
= |
Энтальпийный (энергетический) фактор Н |
– |
Энтропийный фактор ТS |
|
|
«противодействие» |
||
Оба фактора определяют движущую силу химической реакции и для установления возможности ее самопроизвольного протекания должны оцениваться одновременно.
Это осуществляется при помощи термодинамической функции состояния, которая называется энергией Гиббса (G).

Джозайя Уиллард Гиббс
Изменение энергии Гиббса представляет собой энергию, связанную с изменением энтальпии за вычетом энергии, необходимой для повышения неупорядоченности системы; другими словами речь идет об энергии, которая выделяется системой и может быть использована для совершения работы над ее окружением.
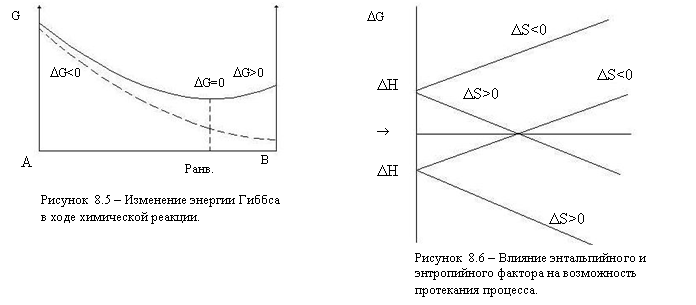
Процесс будет обладать способностью к самопроизвольному протеканию при условии, что знак G < 0.
Таким образом, при P = const и T = const самопроизвольно протекающие процессы идут в сторону уменьшения энергии Гиббса.
Условием (критерием) самопроизвольного протекания процесса при заданных t и p является неравенство G < 0. Чем меньше G, тем сильнее стремление к протеканию данного процесса и тем дальше он находится от состояния равновесия, при котором
G = 0 и H = T S
Где
![]() - температура равновероятности протекания
прямой и обратной реакций.
- температура равновероятности протекания
прямой и обратной реакций.
Если G > 0, процесс самопроизвольно протекать не может.
Расчет величины g
Величину G того или иного процесса в стандартных условиях можно рассчитать, используя ее свойство функции состояния.
Для реакции, протекающей по уравнению:
aA + bB = pP + qQ
G(298 К) = [pfG(298 К, P) + qfG(298 К, Q)] – [afG(298 К, A) + bfG(298 К, B)]
Где fG(298 К) – стандартная энергия Гиббса образования сложного вещества.
Для простых веществ, устойчивых в стандартных условиях,
fG(298 K) = 0.
Для многих веществ величины fG(298 K) являются справочными.
Изменения стандартной энергии Гиббса fG(298 K) в реакции может быть рассчитано также по уравнению:
fG(298
K)
=
![]()
Энергия гиббса и температура
Изменение энергии Гиббса будет отрицательным (G < 0), то есть процесс будет протекать самопроизвольно:
При любой температуре, если H < 0 и S > 0;
При высокой температуре, если H > 0 и S > 0;
При низкой температуре, если H < 0 и S < 0.
