
Термохимия тепловой эффект химической реакции. Энтальпия
Обычно химические реакции сопровождаются тепловыми эффектами. Тепловым эффектом называется суммарное количество энергии, выделенной или поглощенной системой в результате реакции, проводимой при постоянной температуре.
Раздел химии, который изучает тепловые эффекты химических реакций и фазовых превращений, называется термохимией.
В изобарном процессе P = const, следовательно, тепловой эффект реакции Q равен:
Qp = u + pv = (u2 – u1) + p(v2 – v1) = (u2 + pv1) - (u1 + pv1).
Обозначим: u + pv = Н
Величина
Н называется энтальпией
или теплосодержанием
системы. Поэтому тепловой эффект
химической реакции при изобарном
процессе равен изменению энтальпии
системы:
![]() Н
Н
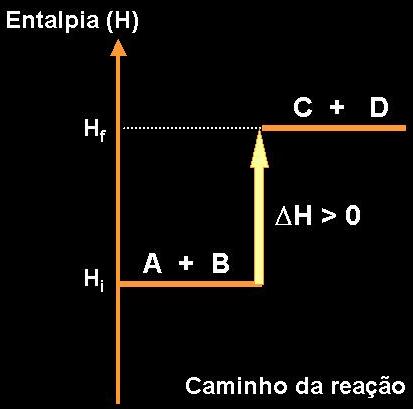
Энтальпия, также как и внутренняя энергия, является термодинамической функцией состояния системы.
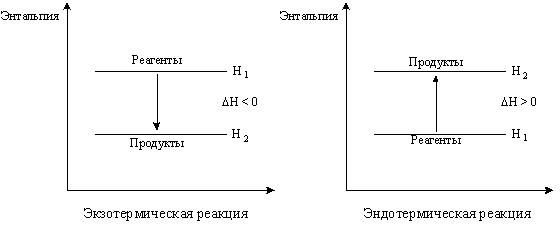
Химические реакции, протекающие с выделением теплоты, называются экзотермическими.
Химические реакции, протекающие с поглощением теплоты, называются эндотермическими.
Термохимические законы. Термохимические расчеты
Тепловые эффекты химических реакций можно определить экспериментально или расчетным путем. Измерение тепловых эффектов называется калориметрией. В основе термохимических расчетов лежит закон, сформулированный русским ученым Г.И. Гессом (1840 г.):

тепловой эффект химической реакции не зависит от пути ее протекания, а зависит от природы и физического состояния исходных веществ и продуктов реакции.

Это означает, что если какую-либо реакцию представить в виде нескольких последовательных стадий, то тепловой эффект данной реакции будет равен сумме тепловых эффектов каждой стадии.
Например, тепловой эффект реакции горения метана равен H = -890,2 кДж
(1)
CH4
+ 2O2
= CO2
+ 2H2O
; ![]() = -890,2 кДж
= -890,2 кДж
Пусть это превращение представляет собой «путь а», проходящий через стадию (1). Можно представить протекание данной реакции через «путь в», проходящий через ряд промежуточных стадий (2), (3), (4) и (5), где стадия (5) = (3) + (4).
Тепловые эффекты каждой из этих стадий равны соответственно:
(2)
CH4(Г)
= C(ГРАФИТ)
+ 2H2(Г)
; ![]() = +74,9 кДж
= +74,9 кДж
(3)
C(ГРАФИТ)
+ O2(Г)
= CO2(Г)
; ![]() = -393,5 кДж
= -393,5 кДж
(4)
2H2(Г)
+ O2(Г)
= 2H2O(Ж)
; ![]() = -571,6 кДж
= -571,6 кДж
Согласно закону Гесса сумма тепловых эффектов на каждой стадии «пути в» будет равна тепловому эффекту реакции горения метана на «пути а»:
=
+
![]() =
+
+
=
+
+
-890,2 = 74,9 - 393,5 - 571,6 (кДж)
Экспериментально было установлено (закон Ломоносова - Лавуазье - Лапласа), что тепловые эффекты прямой и обратной реакций численно равны, но противоположны по знаку.
Так, если прямая реакция экзотермическая, то обратная - эндотермическая:
![]()
Из закона Гесса вытекают два важных в практическом отношении следствия.
Первое следствие из закона Гесса: тепловой эффект реакции равен сумме энтальпий (теплот) образования продуктов реакции за вычетом суммы энтальпий (теплот) образования исходных веществ с учетом стехиометрических коэффициентов в уравнении реакции.
Так для реакции, протекающей по уравнению:
аА + bВ = pР + qQ,
Тепловой эффект рассчитывается по формуле:
H = [pfH(P) + qfH(Q)] - [afH(A) + bfH(B)]
Энтальпия (теплота) образования - это тепловой эффект реакции образования 1 моль сложного вещества из простых веществ: fH [кДж/моль].
Обычно в расчетах используют стандартные энтальпии образования. Стандартная энтальпия образования fН(298 k) это тепловой эффект образования 1 моль сложного вещества из простых веществ при стандартных условиях (T = 298,15 K и P = 101,3 кПа).
Стандартные энтальпии образования простых веществ, устойчивых в стандартных условиях (газообразный O2, кристаллический I2 и т.д.) Принимают равными нулю.
Например, окисление водорода можно представить тремя уравнениями:
(6) 2H2(Г) + O2(Г) = 2H2O(Ж) ; H(298K)6 = -571,6 кДж
(7) H2(Г) + 1/2O2(Г) = H2O(Ж) ; H(298K)7 = -285,8 кДж
(8) H2(Г) + 1/2O2(Г) = H2O(Г) ; H(298K) 8= -241,8 кДж
Каждому уравнению соответствует определенное значение теплового эффекта. И только тепловой эффект реакции, описываемой уравнением (7), будет равен стандартной теплоте образования воды Н(298 К)7 = fН(298 К, H2O(ж)). Согласно этому уравнению в реакции образуется 1 моль воды, стандартным состоянием которой при 298 K является жидкое.
Для многих веществ, стандартные теплоты образования известны и сведены в справочные таблицы.
Теплота образования является мерой термодинамической устойчивости (прочности) сложного вещества относительно простых веществ, из которых оно образовано. Можно утверждать, что, чем более отрицательное значение имеет стандартная энтальпия образования вещества, тем оно устойчивее.
Второе следствие из закона Гесса: тепловой эффект реакции равен сумме энтальпий (теплот) сгорания исходных веществ за вычетом суммы энтальпий (теплот) сгорания продуктов реакции с учетом стехиометрических коэффициентов в уравнении реакции.
