
- •Второе следствие из закона Авогадро:
- •Задания для выполнения контрольной работы
- •Тема 2 : Строение атома. Химическая связь
- •Задачи для выполнения контрольной работы
- •Химическая связь
- •Задачи для выполнения контрольной работы
- •Задачи для выполнения контрольной работы
- •Задачи для выполнения контрольной работы
- •Тема : Растворы электролитов Электролитическая диссоциация. Ионное произведение воды. Гидролиз
- •Задачи для выполнения контрольной работы
- •Тема : Окислительно-восстановительные реакции
- •Задачи для выполнения контрольной работы
- •Список литературы
Задачи для выполнения контрольной работы
Вариант |
Соль |
Вариант |
Соль |
251 |
AgNO3 |
266 |
K2CO3 |
252 |
AlCl3 |
267 |
K2SO3 |
253 |
CdBr2 |
268 |
Na2CO3 |
254 |
Al(NO3)3 |
269 |
Na2SO3 |
255 |
Cd(NO3)2 |
270 |
Na2S |
256 |
Col2 |
271 |
NaNO2 |
257 |
(NH4)2S |
272 |
Al2S3 |
258 |
Co(NO3)2 |
273 |
CuCl2 |
259 |
Cu(NO3)2 |
274 |
FeCl2 |
260 |
FeSO4 |
275 |
Fe(NO3)3 |
261 |
FeCl3 |
276 |
MnSO4 |
262 |
NH4NO3 |
277 |
K2S |
263 |
KNO2 |
278 |
NaCN |
264 |
KClO |
279 |
FeCO3 |
265 |
HCOOK |
280 |
CH3COONa |
Тема : Окислительно-восстановительные реакции
Окислительно-восстановительные реакции (ОВР) – реакции, протекающие с изменением степени окисления химических элементов.
Окисление - это потеря электронов атомом, ионом или молекулой.
Восстановление – присоединение электронов.
Окисление и восстановление – взаимосвязанные процессы: если одна частица окисляется, то другая восстанавливается.
Окислитель – атомы, ионы или молекулы, принимающие электроны,
Восстановитель – частицы, отдающие электроны.
ОВР подразделяется на 3 типа:
межмолекулярные, в которых изменяются окислительные числа атомов и разных частиц:
2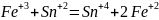
2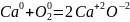
внутримолекулярные, в которых происходят изменение окислительных чисел разных атомов, входящих в состав одной и той же частицы:
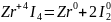
диспропорционирования (самоокисление – самовосстановление), которые протекают с одновременным повышением и понижением окислительного числа атомов одного и того же элемента
4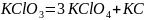 l
l
Для подбора коэффициентов в уравнениях ОВР исходят из правила, что электронов, отданных восстановителем, равно числу электронов и используют метод электронного баланса:
записывают схему реакций: NO+
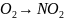
находят атомы, изменяющие степень окисления:
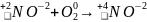
составляют уравнения полуреакций окисления и восстановления для этих атомов и подбирают множители для уравнения числа отданных и принятых электронов:
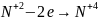 2 процесс
окисления
2 процесс
окисления
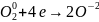 1 процесс
восстановления
1 процесс
восстановления
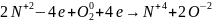 баланс
электронов
баланс
электронов
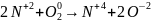
Множители вносят в левые и правые части уравнения, чтобы число окисляющихся атомов (
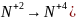 и число восстанавливающихся атомов (
и число восстанавливающихся атомов (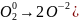 отвечало отношению множителей (2:1) и
подбирают остальные коэффициенты
2NO+
отвечало отношению множителей (2:1) и
подбирают остальные коэффициенты
2NO+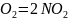
При составлении уравнений ОВР, протекающих в водных растворах, используют электронно-ионный метод:
Записывают схему реакции и определяют функцию каждого реагента:
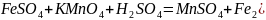 O
O
Здесь
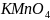 -окислитель,
-окислитель,
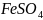 -восстановитель,
-восстановитель,
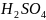 -среда
реакции.
-среда
реакции.
Записывают левую часть уравнения в ионном виде, т.е. указывают только те ионы сильных электронов и молекулы слабых электролитов, которые принимают участие в данной ОВР.
 =
=
Составляют электронно-ионные уравнения полуреакций восстановления и окисления и подбирают коэффициенты:
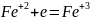 5
5
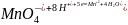 1
1
Записывают полное ионное уравнение с учетом правила сохранения заряда
5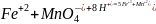 +4
+4
Затем записывают молекулярное уравнение этой реакции
10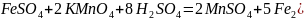
(в данном случае коэффициенты пришлось удвоить, т.к.в формульной единице продукта сульфата железа (ΙΙΙ) содержится 2 атома железа).
В
зависимости от среды характер протекания
реакции между одними и теми же реагентами
будут меняться.
Например,
в разных средах будет восстанавливаться
по разному: в кислой среде до Mn+2
, в слабокислой и нейтральной и
слабощелочной до MnO2,
в сильнощелочной до (
(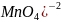 .
Это объясняется тем, что в кислой среде
.
Это объясняется тем, что в кислой среде
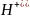 - ионы проникают в анионы
- ионы проникают в анионы
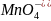 ,
вызывая ослабления связи между марганцем
и кислородом и облегчают действие
восстановления. В нейтральной среде
деформация аниона
,
вызывая ослабления связи между марганцем
и кислородом и облегчают действие
восстановления. В нейтральной среде
деформация аниона
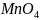 меньше,
т.к. поляризующее действие молекул воды
меньше, чем ионов
меньше,
т.к. поляризующее действие молекул воды
меньше, чем ионов
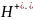 Гидроксид-ионы наоборот, упрочняют
связь MnO.
Гидроксид-ионы наоборот, упрочняют
связь MnO.
