
- •Второе следствие из закона Авогадро:
- •Задания для выполнения контрольной работы
- •Тема 2 : Строение атома. Химическая связь
- •Задачи для выполнения контрольной работы
- •Химическая связь
- •Задачи для выполнения контрольной работы
- •Задачи для выполнения контрольной работы
- •Задачи для выполнения контрольной работы
- •Тема : Растворы электролитов Электролитическая диссоциация. Ионное произведение воды. Гидролиз
- •Задачи для выполнения контрольной работы
- •Тема : Окислительно-восстановительные реакции
- •Задачи для выполнения контрольной работы
- •Список литературы
Задания для выполнения контрольной работы
Определить массу гидросульфата натрия, образующегося при нейтрализации раствора серной кислоты, содержащегося 8 г гидроксида натрия.
Некоторое количество металла, эквивалентная масса которого равна 28 г/моль, вытесняет из кислоты 0,7 л водорода, измеренного при нормальных условиях. Определить массу металла.
Сколько литров водорода (н.у) потребуется для восстановления 112 г оксида металла, содержащего 71,43% металла? Определить эквивалент металла.
Вычислить эквивалент металла 0,5 г которого вытеснили из кислоты 184 мл водорода при 210С и 101325 Па.
При взаимодействии 6 г металла с кислотой при (н.у) выделилось 2,8 л водорода. Определить исходный металл и его эквивалент.
Определить эквивалент металла и его атомную массу, если 1,215 г его вытесняют из серной кислоты 1,12 литров водорода (н.у). Валентность металла в соединении равна 2.
Найти эквивалент металла, если 2 г его взаимодействуют с 3,27 г фосфорной кислоты H3PO4, а 6 г этого металла вытесняют из H3PO4 такой объем кислорода, сколько его вытесняют 2,7 г алюминия.
Определить эквивалент двухвалентного металла, если из 48,15 г его оксида можно получить 88,65 г его нитрата.
В результате реакции 2,19 г металла с водородом образовалось 2,51 г гидрида MeH. Определить эквивалент металла.
При взаимодействия 1,5 г металла с водным раствором щелочи при 270С и 1 атм.выделилось 0,923 л водорода. Определить исходный металл и его эквивалент.
Тема 2 : Строение атома. Химическая связь
Атом – наименьшая частица химического элемента – носитель всех его химических свойств. Атом состоит из положительно заряженного ядра и отрицательно заряженных электронов (заряд –1, масса не сопоставимо мала по сравнению с массой протона). В ядро входят протоны (р+ и нейтроны (n заряд 0, масса 1). Ядро составляет основу атома и определяет индивидуальность элементов. Атомы, обладающие одинаковым зарядом ядра тождественны по химическим свойствам. Атомы с одинаковым числом протонов, но разным числом нейтронов (а значит, и разным массовым числом) называют изотопами. Как правило, каждый элемент представляет собой совокупность нескольких изотопов. Именно этим объясняются значительные отклонения атомных масс многих элементов от целочисленных величин.
Электрону, как любому микрообъекту, присуща двойственная корпускулярно-волновая природа. Движение электрона в атоме носит вероятностно – волновой характер. Околоядерное пространство, в котором с наибольшей вероятностью может находиться электрон, называется атомной орбиталью (АО). АО, как любая геометрических фигура, характеризуется тремя параметрами (координатами), получившими название квантовых чисел (n, l, ml). Они определяют размер (n), форму (l) и ориентацию (ml) атомной орбитали в пространстве. Занимая ту или иную АО, электрон образует электронное облако (электронную орбиталь). Формы электронных облаков аналогичны АО (рис.1). электронное облако характеризуется четырьмя квантовыми числами (n, l,ml, ms). Набором этих чисел можно полностью охарактеризовать состояние любого электрона в атоме. Главное квантовое число n определяет основную характеристику
Рис.
Формы электронных облаков (орбиталей)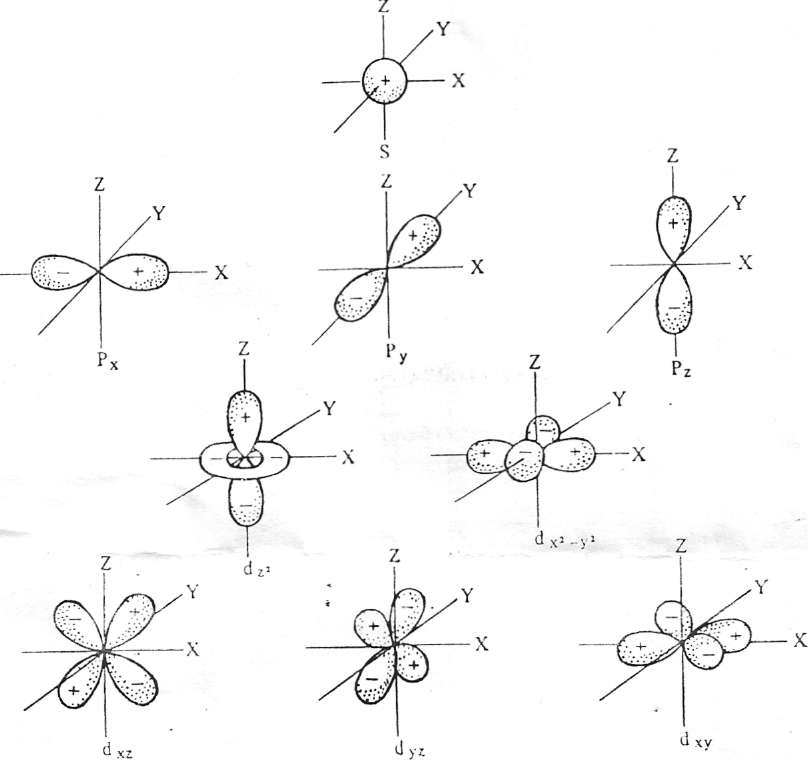
n 1 2 3 4 5 6 7
K L M N O P Q
Орбитальное квантовое число l указывает на различие в энергии связи электронов, находящихся в пределах одного энергетического уровня. Электроны данного энергетического уровня группируются в подуровни. Орбитальное квантовое число определяет форму электронных орбиталей атома (рис. 1), l принимает целочисленные значения от 0 до n – 1.
Для n=1 l=0;
для n = 2 l = 0,1;
для n = 3 l = 0,1,2;
для n = 4 l = 0,1,2,3.
Число подуровней в каждом энергетическом уровне равно его главному квантовому числу (табл.1). Больше четырех подуровней не заполняется, так как значение l = 0,1,2,3 описывают электроны в атомах всех известных элементов. АО, для которых l = 0, 1, 2, 3,
соответственно называют s-, p-, d-, f-орбиталями, а электроны, занимающие эти орбитали, - соответственно s-, p-, d-, f- электронами.
Магнитное квантовое число ml характеризует магнитный момент и пространственное расположение электронных облаков (рис.1). Число возможных значений магнитного квантового числа при заданном l равно 2l+1.
l = 0, ml = 0
l = 1, ml = -1, 0, +1
l = 2 ml = -2, -1, 0, +1, +2
l = 3, ml =-3, -2, -1, 0, +1, +2, +3
Спиновое квантовое число ms характеризует движение электрона вокруг своей оси. Оно имеет +1/2 и -1/2.
Энергетические состояния электрона схематически обозначают в виде
квантовых (энергетических) ячеек (клеток) , электроны в этих ячейках
обозначают стрелками.
Распределение электронов в атомах элементов по АО определяется принципом Паули, принципом наименьшей энергии и правилом Хунда.
Принцип Паули: в атоме не может быть двух и более электронов, имеющих одинаковый набор всех четырех квантовых чисел. Так как АО характеризуется тремя квантовыми числами: n, l, ml, то в ней могут находиться не более двух электронов с противоположными спинами (противоположно направленными стрелками). Согласно принципу Паули, максимальное число электронов на уровне N = 2n2 (табл 1).
Принцип наименьшей энергии. Правило Клечковского: последовательность размещения электронов по АО в невозбужденном атоме должна отвечать наибольшей связи их с ядром, т.е. электрон должен обладать наименьшей энергией. Согласно этому правилу электроны заполняют уровни и подуровни в такой последовательности (шкала энергий): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 5d1 5f14 5d2-10 6p6 7s2 6d1 5f14 6d2-10 7p5, где s, p, d, f – энергетические подуровни, цифры впереди букв означают энергетический уровень, в котором находятся данные электроны, а индекс наверху справа показывает число электронов на данном подуровне. Как следует из шкалы энергий, сначала заполняется 4s – подуровень, а затем 3d;
5s – подуровень, а затем 4d. Такая последовательность заполнения уровней и подуровней обусловлена принципом наименьшей энергии и правилом Клечковского: так как энергия электрона в основном определяется значениями главного квантового числа n и орбитального l, то сначала заполняются те подуровни, для которых сумма значений n +1 равны,то сначала идет заполнение подуровня с меньшим значением n.
Отсюда следует, что после 3p – подуровня заполняется 4s – подуровень (n +l = 4 + 0=4), затем 3d – подуровень (n + l = 3 +2 = 5), 4p (n +l=4+1=5) и 5s-подуровень (n+l=5+0=5).
Правило Хунда: орбитали в пределах данного подуровня заполняются сначала электрону, т.е каждый электрон располагается в отдельной квантовой ячейке в виде неспаренного электрона. Иными словами, электроны располагаются так, что суммарное спиновое число их максимально. Суммарный спин спаренных электронов равен нулю. Например, если три р-орбитали (px, py, pz) надо заполнить тремя p-электронами, то они должны распределяться по одному в каждой отдельной орбитали (ячейке).
