- •Второе следствие из закона Авогадро:
- •Задания для выполнения контрольной работы
- •Тема 2 : Строение атома. Химическая связь
- •Задачи для выполнения контрольной работы
- •Химическая связь
- •Задачи для выполнения контрольной работы
- •Задачи для выполнения контрольной работы
- •Задачи для выполнения контрольной работы
- •Тема : Растворы электролитов Электролитическая диссоциация. Ионное произведение воды. Гидролиз
- •Задачи для выполнения контрольной работы
- •Тема : Окислительно-восстановительные реакции
- •Задачи для выполнения контрольной работы
- •Список литературы
Задачи для выполнения контрольной работы
Для химических элементов определить:
1 Группу и период, в которых находится элемент в периодической таблице.
2 Электронную формулу атома элемента и указать, к какому семейству относится данный элемент.
3 Валентные электроны и перечислить все теоретически возможные степени окисления для нормального и возбужденного состояния атома.
4 Привести примеры соединений, в которых данный элемент имеет разные степени окисления.
Номер варианта |
Символы химических элементов |
|||
s- |
p- |
d- |
f- |
|
11 |
87Fr |
5B |
80Hg |
71Lu |
12 |
88Ra |
6S |
79Au |
70Yb |
13 |
56Ba |
7N |
78Pt |
69Tm |
14 |
55Cs |
8O |
77Ir |
68Er |
15 |
38Sr |
9F |
76Os |
67Ho |
16 |
37Rb |
13AL |
75Re |
66Dy |
17 |
55Cs |
14Si |
74W |
65Tb |
18 |
56Ba |
15P |
73Ta |
64Gd |
19 |
87Fr |
16S |
72Hf |
63Eu |
20 |
88Ra |
17Cl |
57La |
62Sm |
21 |
56Ba |
31Ca |
87Ac |
61Pm |
22 |
55Cs |
32Ge |
104Rf |
60Nd |
23 |
87Fr |
33As |
105Db |
59Pr |
24 |
88Ra |
34Se |
106Sg |
58Ce |
25 |
20Ca |
35Br |
48Cd |
90Th |
26 |
4Be |
50Sn |
47Ag |
91Pa |
27 |
3Li |
51Sb |
46Pd |
92U |
28 |
38Sr |
52Te |
45Rh |
93Np |
29 |
20Ca |
53I |
44Ru |
94Pu |
30 |
37Rb |
49In |
43Tc |
95Am |
31 |
19K |
81Tl |
42Mo |
96Cm |
32 |
12Mg |
82Pb |
41Nb |
97Bk |
33 |
11Na |
83Bi |
40Zr |
98Cf |
34 |
4Be |
84Po |
39Y |
99Es |
35 |
3Li |
85At |
30Zn |
100Fm |
36 |
19K |
81Tl |
29Cu |
101Md |
37 |
20Ca |
82Rb |
28Ni |
102No |
38 |
11Na |
83Bi |
27Co |
103Lr |
39 |
12Mg |
84Po |
26Fe |
98Cf |
40 |
38Sr |
85At |
25Mn |
99Es |
Химическая связь
При образовании связи атомные орбитали с различной симметрией и энергией преобразуются в такое же количество одинаковых гибридных орбиталей с одинаковой энергией, каждая из которых представляет собой продукт смешения исходных орбиталей. Гибридные орбитали более вытянуты в направлении образования химической связи и обеспечивают лучшее перекрывание.
Рассмотрим образование химических связей в молекуле ВеF2:
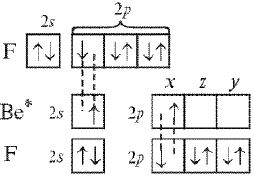
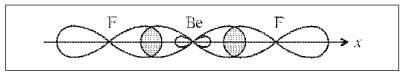
Рис. Орбитали молекулы BeF2
В гибридизации участвуют одна 2s- и одна 2р-орбиталь атома бериллия. Такой случай называется sp-гибридизацией. Минимальное отталкивание обеспечивается при их линейном расположении, т.е. под углом 180°. Отсюда становится понятным угол между связями (Be–F), равный 180°, и равноценность связей.
Рассмотрим молекулу ВF3. В возбужденном атоме бора при образовании связей происходит гибридизация трех орбиталей – 2s, 2рх, 2рz:
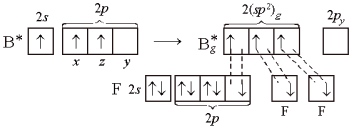
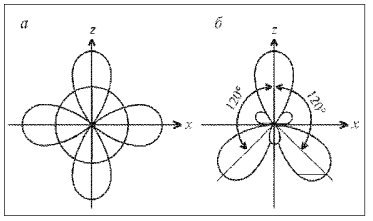
Рис.. sp2-Гибридизация:
а) исходные 2s-, 2рx- и 2рz-орбитали; б – гибридные 2(sp2)g—орбитали
У двух атомов фтора показаны только 2р-электроны, образующие связи.) Три гибридные sp2-орбитали ориентируются так, чтобы отталкивание между ними было минимальным. Поэтому углы между осями гибридных орбиталей, равны 120°. Молекула ВF3 – плоская, связи в ней – равноценные, направленные по углам правильного треугольника.
Рассмотрим молекулу метана СН4. В гибридизации участвуют s-орбиталь и три p-орбитали, т.е. в насыщенных углеводородах реализуется sp3-гибридизация.
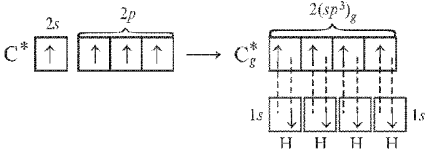
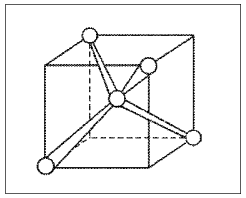
Рис. Ориентация sp3-гибридных орбиталей в молекуле СН4
В этом случае (при sp3-гибридизации) образуются четыре sp3-гибридные орбитали, направленные в пространстве по углам тетраэдра. Углы между осями гибридных орбиталей составляют 109,46°.
Ион аммония NH4+ также имеет тетраэдрическое строение благодаря sp3-гибридизации.
Молекула аммиака NH3 имеет пирамидальную форму: в вершине пирамиды – атом азота, угол составляет ~107,8°, что согласуется с тетраэдрической конфигурацией при sp3-гибридизации в которой, принимает участие орбиталь неподеленной (несвязывающей) пары электронов:
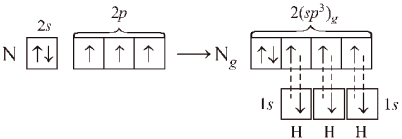
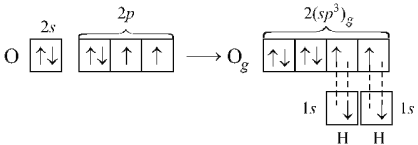
С этих же позиций участием орбиталей двух неподеленных пар электронов в sp3-гибридизации можно объяснить строение молекулы воды, в которой угол между связями О–Н равен ~104,5°: Вследствие более сильного отталкивания неподеленных электронных пар валентные углы в молекулах NН3 (107,8°) и Н2О (104,5°) несколько меньше тетраэдрического (109,5°).
В гибридизации могут участвовать и d-орбитали внешнего или предвнешнего квантового уровня. При образовании комплексного иона [АlF6]3– происходит sp3d2-гибридизация, в которой участвуют вакантные d-орбитали:
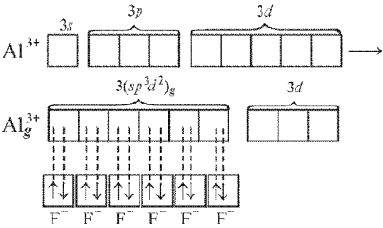
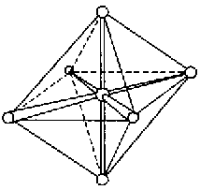
Рис. Ориентация sp3d2- и d2sp3-гибридных орбиталей
Такие шесть гибридных орбиталей направлены по углам октаэдра. Угол между связями 90°.
В комплексном ионе [Fе(СN)6]4 – тип гибридизации d2sp3, геометрическая форма комплекса также октаэдрическая.
Гибридизация с участием d-орбиталей дает и другие структуры молекул и сложных ионов.
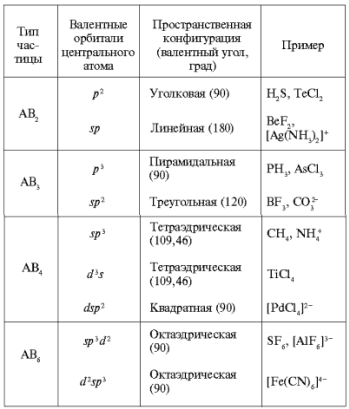
Пространственная конфигурация молекул и ионов