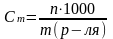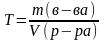- •Второе следствие из закона Авогадро:
- •Задания для выполнения контрольной работы
- •Тема 2 : Строение атома. Химическая связь
- •Задачи для выполнения контрольной работы
- •Химическая связь
- •Задачи для выполнения контрольной работы
- •Задачи для выполнения контрольной работы
- •Задачи для выполнения контрольной работы
- •Тема : Растворы электролитов Электролитическая диссоциация. Ионное произведение воды. Гидролиз
- •Задачи для выполнения контрольной работы
- •Тема : Окислительно-восстановительные реакции
- •Задачи для выполнения контрольной работы
- •Список литературы
Задачи для выполнения контрольной работы
Какова пространственная структура молекулы? Каков тип гибридизации центрального атома в указанном соединении (если есть)? Сколько σ- и π-связей содержит молекула? Отметьте полярность связей и полярность молекулы в целом.
Вариант |
Молекула |
Вариант |
Молекула |
41 |
H2O |
47 |
C2H2 |
42 |
PH3 |
48 |
SiF4 |
43 |
Cl2 |
49 |
OF2 |
44 |
O2 |
50 |
PCl3 |
45 |
NH3 |
51 |
AsH3 |
46 |
CF4 |
52 |
SbH3 |
53 |
BeBr2 |
62 |
BeI2 |
54 |
H2S |
63 |
SO2 |
55 |
N2 |
64 |
H2Te |
56 |
SiH4 |
65 |
HI |
57 |
BCl3 |
66 |
I2 |
58 |
H2Se |
67 |
C2H2 |
59 |
HBr |
68 |
CCl4 |
60 |
Br2 |
69 |
AlCl3 |
61 |
CO2 |
70 |
COCl2 |
Задачи для выполнения контрольной работы
Используя значение относительной электроотрицательности атомов, расположите соединения в порядке возрастания ионности связи. К какому из соединяющихся атомов смещено электронное облако и почему?
-
Вариант
Соединение
Вариант
Соединение
71
NH3,PH3,AsH3,SbH3
86
LiCl,NaCl,KCl,RbCl
72
BeF2,BF3,CF3,NF3
87
BeF2,MgF2,CaF2,BaF2
73
H2O,H2S,H2Se,H2Te
88
Rb2S,K2S,Na2S,Li2S
74
CF4,NF3,OF2,F2
89
MnCl2,FeCl2,NiCl2,MgCl2
75
NaF.NaCl,NaBr,NaI
90
OF2,TeF2,SeF2,SF2
76
H2O,Li2O,Na2O,K2O
91
LiF,NaCl,KBr,RbI
77
BeO,MgO,CaO,SrO
92
BaI2,CaBr2,MgCl2,BeF2
78
CO2,SiO2,GeO2,SnO2
93
AlCl3,GaBr3,BF3,InI3
79
BeO,B2O3,CO2,NO2
94
CF4,GeBr4,SnI4,SiCl4
80
BH3,CH4,NH3,OH2
95
RbCl,SrCl2,InCl3,SnCl2
81
NaCl,MgCl2,AlCl3,SiCl4
96
SnCl4,SbCl3,TeCl2,ICl
82
N2O,NO,NO2,N2O4
97
NaCl,CuCl,AgCl,AuCl
83
B2O3,Al2O3,Ga2O3,InO3
98
Ta2O5,Nb2O5,As2O5,P2O5
84
Al2O3,SiO2,P2O5SO2
99
PbO2,SnO2,ZrO2,TiO2
85
SiH4,PH3,H2S,HCl
100
SnI4,GeBr4,TiBr4,SiCl4
Тема :. Растворы. Способы выражения концентрации растворов
Пример 1. Найдите массу AlCl3, необходимую для приготовления 2 л (2∙10-3м3) раствора с массовой долей хлорида алюминия равной 12%. Плотность раствора 1090 кг/м3 (1090 г/л). Вычислите молярную концентрацию эквивалента (нормалльность), молярную концентрацию (молярность) и титр этого раствора.
Решение
Масса раствора равна
m(р-ра) = V ∙ρ, где V – объем раствора, ρ – его плотность.
m(р-ра) = 2л∙1090 г/л = 2180 г.
2. Массовая доля ω показывает, сколько граммов растворенного вещества содержится в 100 граммах раствора (%).
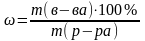
Находим массу AlCl3 для приготовления 2 л раствора с массовой долей 12%.
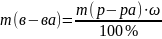 =
=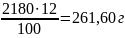
3. По таблице Менделеева находим молярную массу AlCl3 (потребуется для расчета молярной концентрации) и вычисляем молярную массу эквивалента AlCl3 (потребуется для расчета нормальной концентрации).
М(AlCl3) = 27+3∙35,5=133,5 (г/моль) – молярная масса AlCl3,
МЭКВ(AlCl3)
=
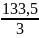 = 44,5 г/моль-экв
– молярная масса эквивалента AlCl3.
= 44,5 г/моль-экв
– молярная масса эквивалента AlCl3.
Напомним:
эквивалет соли, это такое ее количество
в граммах, которое приходится на единицу
валентности катиона, образующего соль.
Например МЭКВ(NaCl)=
М(NaCl);
МЭКВ(СаCl2)=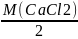 ;
МЭКВ(AlCl3)=
;
МЭКВ(AlCl3)=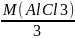 ;
МЭКВ(Al2S3)=
;
МЭКВ(Al2S3)=
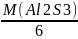
Находим число молей AlCl3 (количество вещества) и число моль-эквивалентов
n(в-ва)=m(в-ва)/М(в-ва)=
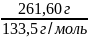 = 1,96 моля
= 1,96 моля
nэкв(в-ва)=m(в-ва)/Мэкв(в-ва)=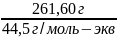 =
5,88 моль-экв
=
5,88 моль-экв
4. Находим молярную концентрацию СМ, т.е. число молей AlCl3 в 1 л раствора.
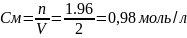
5. Находим молярную концентрацию эквивалента (нормальность) СH, т.е. число эквивалентов вещества в 1 л раствора (моль-экв/л).
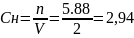 моль-экв/л,
т.е.
моль-экв/л,
т.е.
См = 3Сн (для солей металлов в степени окисления +3)
См = 2Сн (для солей металлов в степени окисления +2)
См = Сн (для солей металлов в степени окисления +1)
Способ выражения содержания растворенного вещества в растворе
|
||||
Название концентрации (синоним) |
Обозна-чение |
Способ выражения содержания растворенного вещества в растворе |
Формула |
Единица измерения |
Массовая доля (процентная концентрация) |
ω |
Отношение массы растворенного вещества к общей массе раствора |
где ρ – плотность раствора |
% |
Мольная доля |
Хi |
Отношение количества (числа молей) растворенного вещества к сумме количеств (числа молей) всех веществ, находящихся в растворе. |
где Σ ni – сумма количеств (молей) всех веществ в растворе |
– |
Молярная концентрация (молярность) |
См, или М |
Количество (число молей) растворённого вещества в единице объёма раствора (в 1 литре) |
где М – молярная масса вещества |
моль/л, |
Молярная концентрация эквивалента (нормальная концентрация, нормальность) |
Сн, или N |
Количество эквивалентов (число молей эквивалентов) растворённого вещества в единице объёма раствора (в 1 литре) |
Мэкв – молярная масса эквивалента, fэкв – фактор эквивалентности |
моль-экв/л |
Моляльная концентрация (моляльность) |
Сm |
Количество растворённого вещества (число молей) в 1000 г растворителя |
|
моль/кг |
Титр раствора |
Т |
Масса вещества, содержащегося в 1 мл раствора |
|
г/см3 кг/см3 |
6. Находим моляльность раствора Сm, т.е. число молей растворенного вещества в 1 кг растворителя (моль/кг). Для этого найдем массу воды.
m(воды) = m(р-ра) – m(в-ва) = 2180,0 г – 261,6 г = 1918,4 г=1,92 кг
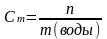 =
=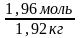
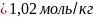
6.Находим титр раствора, т.е. массу (г) растворенного вещества, содержащегося в 1 мл раствора.
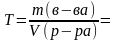
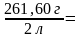
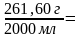
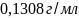 .
.

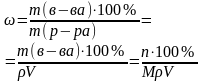 ,
,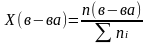 ,
,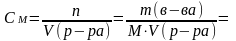
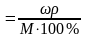 ,
,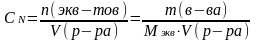
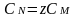 ,
где M
=z∙Мэкв
, z=1/fэкв
,
где M
=z∙Мэкв
, z=1/fэкв