
- •Второе следствие из закона Авогадро:
- •Задания для выполнения контрольной работы
- •Тема 2 : Строение атома. Химическая связь
- •Задачи для выполнения контрольной работы
- •Химическая связь
- •Задачи для выполнения контрольной работы
- •Задачи для выполнения контрольной работы
- •Задачи для выполнения контрольной работы
- •Тема : Растворы электролитов Электролитическая диссоциация. Ионное произведение воды. Гидролиз
- •Задачи для выполнения контрольной работы
- •Тема : Окислительно-восстановительные реакции
- •Задачи для выполнения контрольной работы
- •Список литературы
Задачи для выполнения контрольной работы
5.1
Найдите массу соли, необходимую для
приготовления раствора объемом V
л с массовой долей
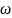 .
Плотность раствора
.
Плотность раствора
 Вычислите молярную концентрацию
эквивалента, молярную концентрацию,
моляльность и титр этого раствора.
Вычислите молярную концентрацию
эквивалента, молярную концентрацию,
моляльность и титр этого раствора.
Вариант |
Соль |
V, л |
,% |
|
161 |
AlCl3 |
0,5 |
6 |
1052 |
162 |
AgNO3 |
1,5 |
8 |
1069 |
163 |
AgNO3 |
0,8 |
6 |
1050 |
164 |
Al2(SO4)3 |
0,8 |
6 |
1061 |
165 |
Al2(SO4)3 |
1,5 |
4 |
1040 |
166 |
BaCl2 |
3,0 |
4 |
1034 |
167 |
BaCl2 |
0,3 |
2 |
1015 |
168 |
CaCl2 |
0,5 |
12 |
1083 |
169 |
CaCl2 |
0,9 |
4 |
1031 |
170 |
CuSO4 |
2,5 |
8 |
1084 |
171 |
CuSO4 |
0,65 |
2 |
1019 |
172 |
FeCl3 |
0,9 |
12 |
1085 |
173 |
FeCl3 |
1,7 |
6 |
1049 |
174 |
FeSO4 |
1,5 |
4 |
1037 |
175 |
FeSO4 |
3,5 |
8 |
1078 |
176 |
K2CO3 |
2,0 |
12 |
1090 |
177 |
K2CO3 |
0,6 |
2 |
1016 |
178 |
K2Cr2O7 |
2,5 |
8 |
1055 |
179 |
K2Cr2O7 |
0,4 |
6 |
1040 |
180 |
K2SO4 |
3,0 |
6 |
1047 |
181 |
K2SO4 |
1,2 |
12 |
1081 |
182 |
MgSO4 |
4,0 |
4 |
1039 |
183 |
MgSO4 |
1,6 |
6 |
1060 |
184 |
Na2CO3 |
0,5 |
12 |
1102 |
185 |
Na2CO3 |
3,5 |
2 |
1019 |
186 |
Na2SO4 |
3,5 |
8 |
1072 |
187 |
Na2SO4 |
1,7 |
6 |
1053 |
188 |
Pb(NO3)2 |
1,5 |
6 |
1052 |
189 |
Pb(NO3)2 |
2,5 |
8 |
1072 |
190 |
Pb(NO3)2 |
0,5 |
12 |
1016 |
Тема : Растворы электролитов Электролитическая диссоциация. Ионное произведение воды. Гидролиз
Электролиты – вещества, способные распадаться на ионы (положительные катионы и отрицательные анионы), их растворы проводят электрический ток.
Неэлектролиты – не распадаются на ионы, их растворы не проводят ток.
Электролитическая диссоциация – распад молекул электролита на ионы в растворе или расплаве.
Диссоциация классов соединений:
кислот HNO3 H+ + NO3–
многоосновных кислот ступенчато, в основном по первой ступени:
H2S H+ + HS– (первая ступень)
HS– H+ + S2– (вторая ступень)
оснований NaOH Na+ + OH–
многокислотных оснований ступенчато, в основном по первой ступени
Mg(OH)2MgOH++OH–(первая ступень)
MgOH+ Mg2+ + OH– (вторая ступень)
амфотерных оснований возможна как кислот и как оснований:
2H+ + SnO22– H2SnО2 Sn(OH)2 Sn2+ + 2OH–
всех солей растворимых в воде – практически полностью, из них:
средних солей Al2(SO4)3 2Al3+ + 2SO42–
кислых солей ступенчато, в основном по 1 ступени
NaHCO3 Na+ + HCO3– (первая ступень)
HCO3– H+ + CO32– (вторая ступень)
основных солей ступенчато, в основном по 1 ступени
CuOHCl CuOH+ + Cl– (первая ступень)
CuOH+ Cu+2 + OH– (вторая ступень)
двойных солей KAl(SO4)2 K+ + Al3+ + 2SO42–.
комплексных солей Na2[Zn(OH)4] 2Na+ + [Zn(OH)4)]2–
О силе электролита можно судить по электропроводности его раствора и по химической активности в реакциях ионного обмена.
Степень диссоциации (α) – отношение числа молекул электролита распавшихся на ионы к общему числу его молекул в растворе. Понятие степени диссоциации неприменимо к сильным электролитам.
Сильные электролиты – вещества, диссоциирующие в растворах полностью:
сильные кислоты |
HCl, HBr, HI, HNO3, H2SO4, HClO4, HMnO4 |
щелочи |
NaOH, KOH, LiOH, RbOH, Ba(OH)2, Ca(OH)2 |
соли |
Все растворимые в воде |
Слабые электролиты – вещества, диссоциирующие частично, в их растворах устанавливается равновесие между молекулами и ионами.
<3% Н2О, СН3СООН, H2C2O4;
=3÷30% – HNO2, HCN, H2S, H2CO3, NH4OH, гидроксиды металлов, кроме щелочей.
Константа диссоциации (Кдис) – константа равновесия процесса диссоциации, количественная характеристика слабых электролитов, не зависит от концентрации раствора.
N H4OH NH4++
OH–
H4OH NH4++
OH– 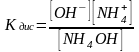
Закон разбавления Оствальда связывает константу и степень диссоциации:
 ,
где
,
где
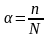 , См
- молярная концентрация
, См
- молярная концентрация
Если α значительно меньше 1, уравнение закона Оствальда упрощается:
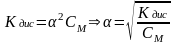 ,
т.е. при разбавлении степень диссоциации
вырастает.
,
т.е. при разбавлении степень диссоциации
вырастает.
Для бинарного электролита КАn (например НСlO, HCSN):
[К+]=[Аn–]= .
.
Показатель константы диссоциации: PК = – lg Кдис.
Изменение условий смещает динамическое равновесие процесса диссоциации:
Разбавление приводит к возрастанию степени диссоциации электролитов.
Добавка одноименного иона, т.е. увеличение концентрации одного из ионов ведет к снижению степени диссоциации электролита.
Ионное произведение воды – константа равная произведению концентраций протонов и гидроксид-ионов
КН2О =[H+][OH-]
Вода – слабый электролит и в незначительной степени диссоциирует на ионы по реакции: H2O ↔ H+ + OH
Kдисс воды=[H+][OH-]) / [H2O] = 1,8 • 10-16 (при 22°С)
Концентрацию недиссоциированных молекул [H2O] можно считать постоянной и в 1 л (1000 г) воды содержится
[H2O] =n=mH2O /МH2O=1000/18 = 55,56 молей
Тогда ионное произведение
КН2О =[H+][OH-]=Kдисс• [H2O] = 1,8·10-16 ·55,56 = 10-14
В чистой воде [H+][OH-]=10-7
Чаще пользуются значениями не самих концентраций, а их десятичными логарифмами, взятыми с обратными знаком (отрицательными логарифмами).
рН=-lg [H+] – водородный показатель;
рОН=-lg [OH-] гидроксильный показатель,
тогда pH +рОН=-lg КН2О pH +рОН=14
В дистиллированной воде pH =рОН =-lg 10-7=7
Водородный показатель – величина характеризующая кислотность среды (раствора)
pH=-lg [H+]
Кислотность среды определяют индикаторами. Их окраска зависит от соотношения [H+] и [OH-]
|
|
|
|
лакмус |
фенолфталеин |
метилоранж |
Кислая |
[H+]>[OH-] |
рН<7 |
рОН>7 |
красный |
бесцветный |
розовый |
Нейтральная |
[H+]=[OH-] |
рН=7 |
рОН=7 |
фиолетовый |
бесцветный |
оранжевый |
Щелочная (основания) |
[OH]>[H+] |
рН>7 |
рОН<7 |
синий |
малиновый |
желтый |
Гидролиз солей - взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита и сопровождающееся изменением рН раствора.
Гидролизу подвергается ион слабого электролита, возможны 3 типа гидролиза.
1.Гидролиз по аниону Соль сильного основания и слабой кислоты СН3СООNa.
Молекулярное уравнение: CH3COONa + H2O CH3COOH + NaOH
Ионно-молекулярное уравнение: СН3СОО– +НОН СН3СООН + ОН–
Образующиеся при диссоциации анионы СН3СОО– связываются в слабый электролит СН3СООН. Ионы ОН– накапливаются, создавая в растворе щелочную среду (рН>7). Гидролиз тем сильнее, чем меньше Кдисс образующейся слабой кислоты.
Гидролиз солей многоосновных кислот протекает по стадиям, преимущественно по первой стадии.
1 стадия: K2S + H2O KHS + KOH
S2– + HOH HS– + OH–
2 стадия: KHS + H2O H2S + KOH
HS-– + HOH H2S + OH–
Гидролиз по катиону. Соль слабого основания и сильной кислоты CuSO4 Гидролиз идет по катиону Cu2+ и протекает в две стадии с образованием преимущественно основной соли.
Реакция среды кислая (рН<7), в растворе накапливаются ионы водорода Н+. Гидролиз тем сильнее, чем меньше Кдисс образующегося основания.
1 стадия: Cu2+ + H2O CuOH+ + H+
2CuSO4 + 2H2O (CuOH)2SO4 + H2SO4
2 стадия: CuOH+ + HOH Cu(OH)2 + H+
(CuOH)2SO4 + 2H2O 2Cu(OH)2 + H2SO4
3. Гидролиз по катиону и аниону. Соль слабого основания и слабой кислоты CH3COONH4.
NH4+ + CH3COO– + HOH NH4OH + CH3COOH
Среда раствора нейтральная, слабокислая или слабощелочная в зависимости от Кдисс образующихся слабых электролитов.
Усиление гидролиза, совместный гиролиз солей слабого основания CrCl3 и слабой кислоты Na2S приводит к необратимому гидролизу каждой из солей до конца с образованием слабого основания и слабой кислоты.
Гидролиз соли CrCl3 идет по катиону: Cr3+ + HOH CrOH2+ + H+
Гидролиз соли Na2S идет по аниону: S2– + HOH HS– + OH–
Гидролиз усиливается, т.к. образуется слабый электролит Н2О: H++OH–=Н2О
Молекулярное уравнение: 2CrCl3+3Na2S+6H2O=2Cr(OH)3+3H2S+6NaCl
Ионно-молекулярное уравнение: 2Cr3+ + 3S2– + 6H2O = 2Cr(OH)3 + 3H2S
Соли сильных оснований и сильных кислот гидролизу не подвергаются, т.к. ни один из ионов соли не образует с ионами Н+ и ОН– воды слабых электролитов. Водные растворы таких солей имеют нейтральную среду.
Пример 2. Напишите уравнение электролитической диссоциации муравьиной кислоты и найдите концентрации ионов Н+ и НСОО- в растворе, молярность которого См=0,01моль/л, а константа диссоциации Кдис =1,810-4.
Решение.
Муравьиная кислота – слабая кислота. В водном растворе присутствуют в основном молекулы HCOOH и некоторое количество ионов, образовавшихся в результате диссоциации. При диссоциации из одной молекулы образуется один ион H+ и один ион HCOO–.
HCOOH
 H+
+
HCOO–,
т.е. СH+
=
СHCOO–
H+
+
HCOO–,
т.е. СH+
=
СHCOO–
Концентрацию ионов найдем из упрощенного выражения закона Оствальда.
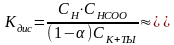
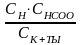
СH+
=
СHCOO–=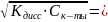
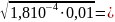 1,34
1,34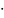 10-3.
10-3.
Задачи для выполнения контрольной работы
Напишите уравнение электролитической диссоциации раствора слабой кислоты и найдите концентрации ионов Н+ и кислотного остатка в моль/л в растворе, если известны константа диссоциации Кдисс. И нормальность Сн
Вариант |
Формула кислоты |
Название кислоты |
Сн,моль/л |
Кдисс |
191 |
HCOOH |
Муравьиная |
0,005 |
1,8 10-4 |
192 |
CH3COOH |
Уксусная |
0,005 |
1,74 10-5 |
193 |
HNO2 |
Азотистая |
0,05 |
5,1 10-4 |
194 |
C6H6COOH |
Бензойная |
0,05 |
6,6 10-5 |
195 |
HIO4 |
Иодная |
0,005 |
2,8 10-2 |
196 |
HIO3 |
Иодноватая |
0,001 |
1,6 10-1 |
197 |
HF |
Плавиковая |
0,01 |
6,8 10-4 |
198 |
HCN |
Синильная |
0,1 |
6,2 10-10 |
199 |
HBrO |
Бромноватистая |
0,1 |
2,5 10-9 |
200 |
C2H5COOH |
Пропионовая |
0,01 |
1,35 10-5 |
201 |
HCNS |
Роданисто-водородная |
0,001 |
1,4 10-1 |
202 |
C6H4(OH)COOH |
Салициловая |
0,001 |
1,1 10-3 |
203 |
HClO2 |
Хлористая |
0,001 |
1,1 10-2 |
204 |
HClO |
Хлорноватистая |
0,05 |
5,0 10-8 |
205 |
HCNO |
Циановая |
0,01 |
3,5 10-4 |
206 |
HCOOH |
Муравьиная |
0,02 |
1,8 10-4 |
207 |
CH3COOH |
Уксусная |
0,01 |
1,74 10-5 |
208 |
HNO2 |
Азотистая |
0,01 |
5,1 10-4 |
209 |
C6H5COOH |
Бензойная |
0,01 |
6,6 10-5 |
210 |
HIO4 |
Йодная |
1,0 |
2,8 10-2 |
211 |
HIO3 |
Йодноватая |
2,0 |
1,6 10-1 |
212 |
HF |
Плавиковая |
0,05 |
6,8 10-4 |
213 |
HCN |
Синильная |
0,5 |
6,2 10-10 |
214 |
HBrO |
Бромноватистая |
0,5 |
2,5 10-9 |
215 |
C2H5COOH |
Пропионовая |
0,05 |
1,35 10-5 |
216 |
HCNS |
Роданистово-дородная |
2,0 |
1,4 10-1 |
217 |
C6H4(OH)COOH |
Салициловая |
1,0 |
1,1 10-3 |
218 |
HClO2 |
Хлористая |
1,0 |
1,1 10-2 |
219 |
HClO |
Хлорноватистая |
0,1 |
5,0 10-5 |
220 |
HCNO |
Циановая |
0,05 |
3,5 10-4 |
Пример 3. Вычислите водородный показатель (pH) раствора и концентрации ионов Н+ и ОН- в растворе КОН, молярность которого составляет 0,01 моль/л (принять α = 1) .
Решение.
Для расчета концентрации ионов [H+] используем выражение ионного произведения воды и величину рН.
Значение α=1 означает, что в растворе все молекулы КОН находятся в состоянии диссоциации, т.е.
[ОН–] = [К+] = [КОН] = 0,01 = 10-2моль/л
рОН = =-lg [ОН–]==-lg 10-2= 2, а
pH = 14–рОН = 14–2 = 12
Пример 4. Составьте молекулярные и ионное уравнения гидролиза солей: а) нитрата аммония NH4NO3; б) сульфита лития Li2SO3; в) ацетата алюминия Al(CH3COO)3; напишите выражение для контастанты гидролиза и оцените рН среды.
Решение.
а) Это соль слабого основания и сильной кислоты.
При растворении в воде соль NH4NO3 диссоциирует
N H4NO3 NH4+ + NO3–
И взаимодействует с водой, связывая ионы воды (Н+ и ОН–) в малодиссоциирующее соединения связывает ион NH4+, образуя молекулы слабого основания NH4ОН.
Ионное уравнение гидролиза NH4NO3
N
H4+
+ H2O
NH4OH
+ H+. 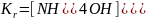
где
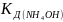 - константа диссоциации NH4ОН.
- константа диссоциации NH4ОН.
Уравнение гидролиза в молекулярной форме
N H4NO3 + H2O NH4OH + HNO3.
Реакция среды кислая, рН < 7.
б) Сульфит лития при растворении в воде диссоциирует
L i2SO3 2Li+ + SO32-.
Ионы SO32- связывают H+ - ионы воды ступенчато, образуя кислые ионы HSO3- и молекулы слабой кислоты H2SO3. Практически гидролиз соли ограничивается первой ступенью
S O32- + H2O HSO3- + OH-,
L
i2SO3
+ H2O
NaHSO3
+ NaOH. 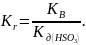
Рекция раствора щелочная, рН > 7.
в) Соль ацетата алюминия диссоциирует, образуя ионы
Al(CH3COO)3 Al+3 + 3CH3COO-
Ионы Al+3 и ион CH3COO- взаимодействуют с ионами воды, образуя малорастворимые соединения Al(OH)3 и взаимодействии слабой кислоты и слабого основания, гидролизуются необратимо и полностью.
A l(CH3COO)3
+ 3H2O
= Al(ОН3)
+ 3 CH3COO.
l(CH3COO)3
+ 3H2O
= Al(ОН3)
+ 3 CH3COO. 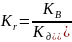
pH
раствора Al(CH3COO)3
зависит
от соотношения
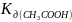 и
и
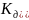 .
Из табл.П 4 следует, что
<
,
следовательно среды кислая.
.
Из табл.П 4 следует, что
<
,
следовательно среды кислая.
Составьте ионное и молекулярное уравнение реакции гидролиза соли, выражение для константы гидролиза и оцените величину рН раствора.

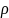 ,кг/м3
,кг/м3