
- •Вопросы и ответы по курсу
- •1.1. Очистка газов и воздуха от аэрозольных частиц
- •1.1.1. Функции распределения аэрозольных частиц по размерам
- •1.1.3. Используемые на практике способы задания размеров несферических аэрозольных частиц
- •1.1.4. Динамика аэрозольных частиц
- •1.1.5. Коагуляция аэрозолей
- •1.1.6. Методы и аппараты для очистки газов от аэрозолей
- •1.1.7. Методы и аппараты для очистки газов от парообразных и газообразных заг-рязнений
1.1.7. Методы и аппараты для очистки газов от парообразных и газообразных заг-рязнений
Адсорбционная очистка газов от молекулярных примесей
56. При очистке газов от газообразных и парообразных примесей адсорбция применяется в случаях, когда нужно снизить концентрации этих примесей до следовых количеств. Адсорбция экономически эффективна, когда начальная концентрация примеси мала, а расход G носителя примеси велик.
57. При адсорбционной очистке газов цикл работы периодически действующих адсорберов включает следующие операции: 1) адсорбция при возможно более низких температурах, 2) десорбция (регенерация адсорбента) при повышении температуры (например, десорбция горячим водяным паром), 3) сушка адсорбента (например, горячим чистым воздухом), 4) охлаждение адсорбента (например, чистым холодным воздухом).
58. Продолжительность tпр адсорбции в адсорбере периодического действия – интервал времени от начала адсорбции до появления проскока (увеличение концентрации С(Х) удаляемой примеси Х в очищенном газе с нуля до приемлемой величины, например, до С(Х) = ПДКсс(Х)).
59. В качестве адсорбентов используют любые высокопористые тела (в виде порошков или гранул) с большой удельной поверхностью. Например, удельная поверхность хорошего активированного угля достигает 1000 м2/г.
На практике в качестве неполярных и полярных адсорбентов широко используют порошки и гранулы:
1) активированного угля, 2) силикагеля, 3) цеолита, 4) глинозема, 5) каолина (глины), 6) оксидов металлов. Активированный уголь является неполярным адсорбентом и используется для адсорбции неполярных газовых или парообразных примесей из воздуха (например, пары йода, радиоактивных благородных газов (РБГ) и т.п.). Активированный уголь широко используется в противогазах, в картриджах доочистителей питьевой воды. Полярные адсорбенты используются для адсорбции полярных газовых или парообразных примесей.
60. Теоретически выведенная изотерма физической мономолекулярной адсорбции из газовой или жидкой смеси на однородной поверхности (изотерма Лэнгмюра) имеет вид
а = а∙ Кл ∙р / (1+ Кл ∙р) или а = а∙ К′л ∙См / (1 + К′л∙ См ),
где а – удельное количество адсорбированного вещества, выраженное в (моль адсорба-
та)/(кг адсорбента), или в (кг адсорбата)/(кг адсорбента);
а - предельное удельное количество адсорбированного вещества (предельная ем-
кость монослоя молекул адсорбированного вещества на поверхности пор адсор-
бента при данной температуре);
Кл и К′л - константы Лэнгмюра при разных способах представления концентрации
примеси, [Кл] = Па-1, [К′л] = л / моль.
р – парциальное давление адсорбируемого вещества в газе,
См – молярная концентрация вещества в газе или в жидкости.
Изотермы адсорбции на неоднородных поверхностях обычно получают эмпирическим путем. Одной из них является изотерма Фрейндлиха
а = k ∙ рb
В изотерме Фрейндлиха константа k характеризует свойства адсорбента, константа b характеризует свойства поглощаемого газа или пара Х. Это выражение справедливо и для растворов, если парциальное давление р поглощаемого вещества заменить на его равновесную концентрацию С.
Как выглядит график изотермы Лэнгмюра при разных температурах?
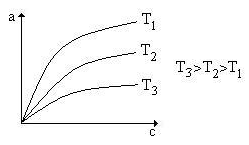
Рис.60.1. Графики функции изотермы Лэнгмюра для разных температур.
61. В практике адсорбции часто используется величина Г, называемая безразмерным коэффициентом адсорбции. Коэффициент Г характеризует изотерму адсорбции на ее начальном приблизительно прямолинейном отрезке.
Начальная приблизительно линейная часть изотермы адсорбции ксенона на активированном угле СКТ при 20 0С описывается уравнением
а = 1,225 С
где а выражена в моль/кг и С – в моль/м3.
Пусть насыпная плотность гранул угля = 400 кг/м3, тогда безразмерный коэффициент Г адсорбции равен
Г = а · / С = 1,225 · С · / С = 1,225 · = 1,225м3/кг · 400кг/м3 = 490.
62. Скорость U перемещения стационарного адсорбционного фронта вдоль слоя адсорбента можно оценить с помощью выражения: U = u / Г, где u – линейная скорость очищаемого газа в свободной от слоя адсорбента части адсорбера, Г – безразмерный коэффициент адсорбции. Как видно, скорость перемещения адсорбируемых частиц вдоль слоя адсорбента отстает от скорости перемещения содержащего эти частицы очищаемого газа в Г раз.
Некоторые пары адсорбент - адсорбат характеризуются особенно большими значениями безразмерного коэффициента адсорбции. Например, для адсорбции йода на угле (пара уголь - йод) при 20оС Г = 108. Это значит, что молекулы йода передвигаются через слой угля в сто миллионов раз медленнее, чем содержащий их воздух.
63. Адсорбционный фронт – это изменение (уменьшение) концентрации С(х, t) адсорбата в газе по длине х слоя адсорбента в момент времени t. В случае стационарного адсорбционного фронта С(х, t) = f (x - Ut), где U - скорость перемещения стационарного адсорбционного фронта. Действительно, пусть C ', х' – система координат, движущаяся со скоростью U вместе с адсорбционным фронтом; С, х – лабораторная система координат, связанная с адсорбционным слоем (рис.1). Пусть адсорбционный фронт в движущейся со скоростью U системе координат описывается функцией C ' = f(х'). Тогда
х = U ∙ t + х', х' = х – U ∙ t, C ' = C, C = (х – U ∙ t).
График функции С(х, t) для двух последовательных моментов времени имеет вид (рис.2):


Рис.1. Рис.2.
64. Динамическая адсорбционная емкость ад слоя адсорбента в адсорбере с данной геометрией и при данной объемной скорости фильтрации – количество адсорбата, поглощенного адсорбентом за время от начала адсорбции до момента появления проскока, отнесенное к массе всего адсорбента. Динамическую адсорбционную емкость определяют экспериментально. Докажите, что при увеличении объемного расхода G очищаемого газа через адсорбер динамическая емкость содержащегося в нем адсорбента уменьшается.
При увеличении G уменьшается производная dC/dx в центре адсорбционного фронта (уменьшается наклон линии адсорбционного фронта к оси х), следовательно, проскок в очищаемом газе наступит при меньшем количестве очищенного газа.
65. Динамическая адсорбционная емкость слоя адсорбента в данном адсорбере увеличивается и в пределе стремится к равновесной адсорбционной емкости при
1) уменьшении объемного расхода очищаемого газа (при объеме угля = соnst),
2) увеличении объема адсорбента (при объемном расходе очищаемого газа = соnst).
66. Теоретическое выражение для оценки времени работы адсорбционного слоя в адсорберах периодического действия. Для начального приблизительно прямолинейного участка изотермы адсорбции (именно на этих участках и работают адсорберы при очистке воздуха от примесей, содержащихся в нем в небольших концентрациях) при периодическом процессе фильтрации через слой активированного угля получено выражение
![]()
![]() -
b ∙
-
b ∙![]()
или
![]() - b ∙
- b ∙
![]()
где tпр – продолжительность цикла адсорбции в аппарате периодического действия, с;
u – линейная скорость газовой смеси в полом сечении адсорбера, м/с;
h – высота слоя активированного угля в адсорбере, м;
Cyo – начальная массовая объемная концентрация адсорбата в газовой смеси,
кг адсорбата / м3 газовой смеси;
ao
– удельная масса адсорбированного
углем вещества, равновесная с начальной
массовой концентрацией Cyo
адсорбата в газовой смеси, кг/кг угля
или кг/м3 угля;![]()
b – величина, являющаяся функцией отношения Cyк / Cyo, где Cyк – концентрация
адсорбата в газовом потоке на выходе из адсорбера к концу цикла адсорбции tпр;
насыпн – насыпная масса адсорбента, кг/м3;
– коэффициент массоотдачи.
Коэффициент массоотдачи определяется количеством вещества, адсорбирующимся за 1 с на поверхности частиц адсорбента с суммарной массой 1 кг при единичной движущей силе Cy – Су* , где Cy - фактическая концентрация адсорбата у поверхности гранул угля, Су* - концентрация адсорбата в газовой смеси у поверхности гранул угля, равновесная с величиной a (определяется по изотерме адсорбции). Приведите поясняющий график.
При выполнении условия
![]() >>
b ∙
>>
b ∙![]() для вычисления tпр
можно использовать приближенное
выражение tпр
h / U
для вычисления tпр
можно использовать приближенное
выражение tпр
h / U
67. Изобразите правдоподобный график зависимости продолжительности цикла адсорбции периодического действия tпр от высоты слоя адсорбента h (при сохранении неизменными объемного расхода фильтруемого газа и диаметра адсорбера). Иначе говоря, изобразите график зависимости tпр от h для функции
![]() - b ∙
- b ∙

Рис. Зависимость продолжительности времени фильтрации tпр от высоты h слоя адсорбента.
Из рисунка видно, что при увеличении h усиливается неравенство tпр > tо. И это позволяет резко упростить расчет tпр, используя приближение
tпр
![]() = h / U
= h / U
68. Задача. В адсорбере периодического действия (например, в противогазе) очищается воздух от примеси хлорпикрина (учебное и боевое ОВ) с помощью активированного угля. Высота h слоя угля 0.05 м. Площадь S поверхности поперечного сечения адсорбера 0.01 м2. Объемный расход G газовой смеси 0.03 м3/мин. (средний объемный расход воздуха при дыхании). Начальная концентрация хлорпикрина Суо = 0.0066 кг/м3. При Су = 0.0066 кг/м3 равновесное содержание а хлорпикрина в единице объема угля составляет 222 кг/м3. Проскок возникает через tпр = 336 мин. = 5.6 ч
Оцените возможность расчета tпр в данной задаче по упрощенному варианту с использованием выражения tпр ≈ t'пр = h / U
1) Вычисляем безразмерный коэффициент Г адсорбции.
Г = а/Су = 222 кг/м3/0.0066 кг/м3 = 3.36 · 104
2) Оцениваем скорость U перемещения стационарного адсорбционного фронта.
u = G / S = 0.03 м3/мин/0.01 м2 = 3 м/мин = 0.05 м/с
U = u/Г = 0.05 м/с/3.36 ·104 = 1.5 ·10-6 м/с
3) Оцениваем потерю времени защитного действия to
tпр = t'пр – tо, t'пр = h /U = 0.05 м / 1.5 ·10-6 м/с = 3.35 ·104 с = 9.2 ч
tо = 9.2 – 5.6 = 3.6 ч
Как видно из анализа, в данной задаче нельзя использовать приближенный вариант расчета tпр, согласно которому tпр ≈ t'пр = h / U. Однако, при увеличении h вклад tо в величину tпр уменьшается и приближенный вариант расчета возможен.
69. На АЭС для очистки выбрасываемых в атмосферу газов от короткоживущих радиоактивных благородных газов (РБГ) и от радиоактивного иода используются т.н. вечные (радиохроматографические) колонны, заполненные активированным углем. Объемная активность Аi i - го радиоактивного газа после колонны описывается выражением
Аi = Аоi ∙ ехр (-i ∙V∙ Гi / G) (1)
где Аi – объемная активность i-го радиоактивного газа после колонны, Ки/м3, Бк/м3;
Аоi – объемная активность i-го газа перед колонной;
i - постоянная радиоактивного распада i-го радиоактивного газа, 1/ч;
V – объем слоя активированного угля в колонне, м3;
G – объемный расход очищаемого газа, м3/ч;
Гi - безразмерный коэффициент адсорбции i-го газа на угле (Г = аρ/С).
Почему эти колонны называют «вечными»?
Для короткоживущих радиоактивных газов время прохождения молекул этих газов через колонну (а оно много больше времени прохождения через колонну газа-носителя) может превышать несколько периодов полураспада. Иначе говоря, радиоактивные атомы распадаются, не добравшись до конца адсорбционного слоя.
Вывести выражение (1), используя закон распада радиоактивных изотопов.
Абсорбционная очистка газов от молекулярных примесей.
70. Константа Генри – это характеристика равновесного распределения газообразной или парообразной примеси между газовой и жидкой фазами на начальной приблизительно прямолинейной части изотермы абсорбции. Строго константа Генри действительна для газов, которые химически не взаимодействуют с жидкостью (например, химически не взаимодействуют с водой газы О2, N2, Ar). Однако эту константу определяют и для химически и обратимо взаимодействующих с жидкостью газов. Например, химически и обратимо взаимодействуют с водой газы СО2, SO2, NH3.
СО2(г) +
Н2О(ж)
![]() Н2СО3(водн)
Н2СО3(водн)
71. Задача. Определите равновесную концентрацию С(О2), мг/л, кислорода в воде, находящейся в контакте с атмосферным воздухом при общем атмосферном давлении 1 атм.
Константа Генри Кг(О2) = 1.5 ·10-3 моль/(л · атм) при 15оС. Мольная доля кислорода у(О2) в чистом воздухе, содержащем насыщенные при 15оС водяные пары, равна 0.209.
Решение. Учитывая размерность константы, уместно предположить линейную зависимость между содержанием кислорода в воде С(О2) и в воздухе р(О2) в виде
С(О2) = Кг· р(О2)
С(О2) = 1.5 · 10-3 моль/(л · атм) · 1 атм · 0.209 · 32 г/моль · 103 мг/г = 10.03 мг/л
Как изменится ход решения, если в другом справочнике приведена константа Генри Е(О2) = 2.77 ·107 мм рт.ст.?
Решение. р(О2) = Е(О2) · х(О2)
где х(О2) – мольная доля растворенного кислорода в воде.
760 мм рт.ст. · 0.209 = 2.77 ·107 мм рт.ст. · х(О2), х(О2) = 5.73 ·10-6
х(О2) =

См(Н2О)
=
 ,
,
См(О2) = х(О2) ·См(Н2О) = 5.73 ·10-6 ·55.5 = 3.18 ·10 -4 моль/л
С(О2) = 3.18 ·10 -4 моль/л · 32 г/моль = 0.01018 г/л = 10.18 мг/л
Как видно из результатов решения, константы Генри, приведенные в разных справочниках, дают при расчетах результаты, отличающиеся друг от друга на ≈ 1.5%.
72. Задача. Даны две изотермы абсорбции SO2 водой (зависимости парциального давления Р(SO2) в газовой фазе от равновесной концентрации С(SO2) в жидкой фазе) при температурах Т1 и Т2.

Используя принцип Ле Шателье, решите, каково соотношение этих температур (больше, меньше)? Запишите термохимическое уравнение процесса абсорбции. Решение. Поскольку при данной концентрации С равновесные значения Р1 > Р2 (см. графики слева), то Т1 > Т2.
SO2(г) + H2O(ж)
= H2SO3(водн),
![]() Hабсорбции
< 0
Hабсорбции
< 0
73. На практике используются абсорберы полые и абсорберы с насадкой. Насадка в насадочных абсорбционных колоннах используется для увеличения межфазной поверхности (поверхности между жидкостью и газом) и, следовательно, для увеличения скорости процесса абсорбции. Чаще всего в качестве насадок используются фарфоровые или железные колечки, именуемые кольцами Рашига. Характеристики насадок: размеры колец (диаметр, высота, толщина стенок); удельный свободный объем (пористость) м3/м3; удельная поверхность м2/м3. Например, есть кольца Рашига с характеристиками: высота колечек 50, диаметр 50 и толщина стенок 5 мм; удельный свободный объем (пористость) насыпанных в беспорядке колечек 0.78 м3/м3, удельная поверхность насыпанных в беспорядке колечек 87 м2/м3. Именно такую удельную поверхность будет иметь абсорбент, стекающий в насадочной абсорбционной колонне тонким слоем по поверхности колечек.
74. При расчетах процессов абсорбции, протекающих в абсорберах, используют следующие выражения:
уравнение баланса М = G · (Yв –Yн) = L · (Xн – Xв)
и уравнение кинетики процесса М = Ку · F · < Y –Y* > .
Укажите физический смысл и размерности использованных величин. Нарисуйте эскиз абсорбера (рис.). По какому параметру усредняют движущую силу Y – Y* ?
М – масса примеси, поглощаемой абсорбентом в абсорбере из газа за единицу
времени, кг/с;
F – площадь межфазной поверхности между газом и жидкостью в абсорбере, м2;
Y – Y* - движущая сила процесса на каком-либо уровне в колонне, кг примеси/кг газа носителя;
< Y – Y* > - движущая сила, усредненная по высоте абсорбера;
Ку - коэффициент массопередачи, кг примеси/ (м2 · с · (кг примеси/кг газа носителя));
Yв, Xв – массовые концентрации примеси в газе и в жидкости в верхней части колонны;
Yн , Xн – массовые концентрации примеси в газе и в жидкости внизу колонны;
G – массовый расход газа через абсорбционную колонну, кг/с;
 L – массовый расход
жидкости через абсорбционную колонну,
кг/с.
L – массовый расход
жидкости через абсорбционную колонну,
кг/с.
Рис. Эскиз абсорбционной колонны с насадкой.
75. Составьте уравнение процесса, протекающего в абсорбере при поглощении SO2 из воздуха водным раствором сульфита натрия. Можно ли очищать воздух от SO2 с помощью этого процесса в абсорбере с насадкой (не забьется ли насадка твердыми продуктами реакции)? Какие другие виды абсорберов вы знаете, кроме абсорберов с насадкой?
Ответы. SO2(г) + Na2SO3(в) + H2O(ж) = 2NaHSO3(в)
SO2(г) + 2Na+(в) + SO32-(в) + H2O(ж) = 2Na+(в) + HSO3-(в)
Образующийся продукт реакции гидросульфит натрия растворим в воде, и, следовательно, насадка забиваться не будет.
Кроме абсорберов с насадкой существуют еще полые абсорберы (см. рисунок к след. вопросу).
76. Известковый процесс. Составьте уравнение процесса, протекающего в абсорбере при поглощении SO2 из воздуха водным раствором негашеной извести СаО. Возможно ли организовать протекание этого процесса в абсорбере с насадкой? Какой дополнительный процесс протекает в этом абсорбере?
Ответы.
Полезный процесс:
SO2 (г) + Са(ОН)2(в) = СаSO3 (тв) + H2O(ж)
SO2(г) + Са2+(в) + 2ОН-(в) = СаSO3(тв) + H2O(ж)
Нежелательный процесс:
СО2 (г) + Са(ОН)2(в) = СаСO3 (тв) + H2O(ж)
Как видно из уравнений, в процессе реакции образуются слаборастворимые сульфит и карбонат кальция. Следовательно, в абсорбере с насадкой эти процессы проводить нельзя- насадка забьется. В этом случае используются полые абсорберы (рис.).
Еще один вопрос. Много ли абсорбента будет расходоваться на нежелательный процесс - очистку воздуха от диоксида углерода?
Это зависит от соотношения концентраций SO2 и СО2. Каково типичное соотношение концентраций SO2 и СО2 в атмосферном воздухе промышленных городов?
Концентрация SO2 в воздухе промышленных городов может достигать 0.1 мг/м3 (при ПДКСС(SO2) = 0.05 мг/м3). В среднем в средней полосе РФ С(SO2) = 1 ÷ 4 мкг/м3.
Концентрация диоксида углерода к концу двадцатого столетия увеличилась в атмосферном воздухе до 0.03% объемных. Пересчитаем ее в мг/м3.
С%(СО2) =
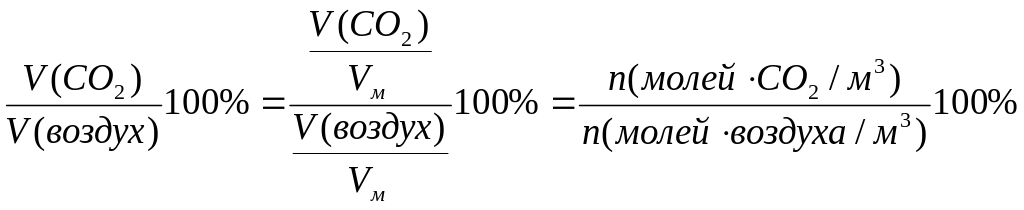 =
=
= (См(СО2)/ См(воздух)) ·100%
где Vм – молярный объем идеального газа при н.у., м3/моль,
V(СО2) – парциальный объем компонента СО2 газовой смеси при н.у., м3.
Используя уравнение состояния идеальных газов, можно найти, что масса 1 м3 воздуха при н.у. равна 1.29 кг/м3. Следовательно, при н.у. молярная концентрация воздуха равна
См(воздух)
=
![]()
Следовательно, молярная концентрация диоксида углерода
См(СО2) = 0.03 · 44.5 · 0.01 = 0.0133 моль/м3(н.у.)
Следовательно, С(СО2) = См(СО2) · М(СО2) = 0.0133 · 44 = 0.59 г/м3 (н.у.)
Из проведенного расчета видно, что абсорбент будет расходоваться в основном для поглощения из воздуха диоксида углерода, а не SO2, что не рационально. Действительно, на единицу массы образующегося целевого продукта СаSO3 будет приходиться m (зависит от концентрации SO2) единиц массы нецелевого продукта СаСО3.

Рис. . Эскиз полого абсорбера. В таком абсорбере удельная межфазная поверхность равна суммарной поверхности капель распыляемого абсорбента в единице объема.
77. Известняковый процесс. Составьте уравнение процесса, протекающего в абсорбере при поглощении SO2 из воздуха водной суспензией известняка СаСO3. Возможно ли организовать протекание этого процесса в абсорбере с насадкой?
SO2(г) + СаСO3 (тв) = СаSO3 (тв) + СО2(г) (1)
В абсорбере с насадкой этот процесс проводить нельзя, т.к. и исходный абсорбент (суспензия СаСO3 в воде) и образующийся СаSO3 слаборастворимы в воде. Суспензия этих веществ забьет насадку.
Реакция (1) протекает слева - направо, поскольку ПР(СаSO3) < ПР(СаСO3).
Ниже на рис. показан еще один вариант использования известняка для удаления SO2 из топочных газов. Порошкообразный известняк СаСO3 засыпается в топку вместе с углем и в ней при высокой температуре разлагается до СаО, который реагирует с SO2, образуя СаSO3. Этот СаSO3 и остаток непрореагировавшего SO2 поступают в камеру для очистки (скруббер), где при орошении суспензией СаО остаток SO2 превращается в СаSO3, который осаждается в виде взвеси (водный осадок).

Рис. Схема двухступенчатой очистки топочных газов ТЭС от SO2. Очистка 1-й ступени – связывание SO2 в топке оксидом кальция. Оставшийся несвязанным SO2 затем удаляется из газа в полом абсорбере.
78. Описать работу спецгазаочистки (см вопрос 47) на АЭС, используя приведенную ниже схему.
Условные обозначения на схеме: 1- емкости отработанных радиоактивных ионообменных
смол и сорбентов, борного концентрата и т.п.; 2- хранилище жидких радиоактивных отхо-
дов (ХЖО); 3- щелочной абсорбер с кольцами Рашига (общая поверхность колец 120 м2);
4- самоочищающийся аэрозольный фильтр ФАРТОС Ц-500 для удаления капельной влаги;
5- подогреватель для уменьшения относительной влажности газового потока; 6 – уголь-
ный адсорбер с углем СКТ-М, импрегнированным иодидом серебра; 7 - воздуходувка; 8 –
вытяжная труба; 9 - спецканализация; 10 - бак со щелочью; 11- узел приготовления водного раствора щелочи; 12 - насос; 13 - холодильник; 14 - бак с 5% раствором азотной кислоты для регенерации фильтра ФАРТОС.
В абсорбер для очистки поступает воздух, содержащий пары масла и воды, оксиды
азота, аэрозоли, 131I в составе I2 и метилиода СН3I.

Рис. Схема спецгазоочистки (очистки газовых сдувок) на АЭС.
1. Что происходит в щелочном абсорбере? 1) Горячий очищаемый газ охлаждается относительно более холодным абсорбентом. 2) Раствор щелочи (абсорбент) нагревается за счет протекания экзотермических реакций поглощения кислотных оксидов и йода. 3) Из очищаемого воздуха при его охлаждении частично конденсируются пары воды. 4) Происходит поглощение йода с образованием иодноватистой кислоты и йодида натрия (NaOH(ж) + I2(г) = NaI(в) + HIO(в)). 5) Частично задерживаются аэрозоли, 6) Задерживаются оксиды азота (2NO2(г) + 2NаOH(в) = NaNO3(в) + NaNO2(в) + Н2О(ж)) ,
2. Фильтр ФАРТОС очищает газ от капельной жидкости.
3. На угольном фильтре происходит адсорбция радиоактивного йода. Поскольку влага затрудняет адсорбцию, то для уменьшения относительной влажности очищаемого газа он подогревается в теплообменнике 5 перед поступлением на угольный фильтр.
4. После угольно фильтра газ выбрасывается в атмосферу через высокую трубу. В атмосфере не задержанные системой очистки вредные примеси разбавляются относительно более чистым воздухом до безопасных для людей и экосистем концентраций.
