
- •4. Термодинамічні властивості реальних газів і водяної пари
- •4.1 Рівняння стану реальних газів
- •4.2 Водяна пара та її характеристики
- •4.3 Три стадії отримання перегрітої пари
- •4.3.1. Перша стадія - процес підігріву води до температури насичення
- •4.3.2. Друга стадія - процес пароутворення
- •7.3.3 Третя стадія - перегрів пари
- •4.4. Використання „h-s” діаграми для процесів з водяною парою
4. Термодинамічні властивості реальних газів і водяної пари
Між молекулами реального газу на віддалях більших від їх ефективного діаметра діють сили протягання, які зменшують тиск газу на стінки посудини, а сили відштовхування, що проявляють себе на віддалях, порівняних з розмірами молекул, протидіють зближенню молекул. Тому об’єм, у якому можуть рухатися молекули реального газу, буде меншим від займаного ним об’єму на величину b, що приблизно втроє більша від власного об’єму всіх молекул газу, а тиск, який чинить реальний газ на стінки посудини, буде меншим (внаслідок притягання між молекулами) ніж ідеального газу при тій же температурі.
4.1 Рівняння стану реальних газів
Найпростішим рівнянням стану реального газу, що враховує сили взаємодії між його молекулами, є рівняння Ван-дер-Ваальса, див. (3.5),
![]() ;
;
![]() , (1)
, (1)
![]() характеризує
внутрішній тиск у газі, який зумовлений
силами притягання його молекул; (v-b)
відповідає вільному об’єму, тобто
об’єму простору, в якому можуть рухатися
молекули газу. Постійні
a і b, залежать від природи газу,
розраховуються за критичними параметрами
газу (див. нижче).
характеризує
внутрішній тиск у газі, який зумовлений
силами притягання його молекул; (v-b)
відповідає вільному об’єму, тобто
об’єму простору, в якому можуть рухатися
молекули газу. Постійні
a і b, залежать від природи газу,
розраховуються за критичними параметрами
газу (див. нижче).
І зотерми,
побудовані за рівнянням Ван-дер-Ваальса,
показані на рис. 1. Хвилеподібна ділянка
ізотерми abcde
відповідає нестійким станам: стани між
a
і b
відповідають пересиченій
(переохолодженій) парі
і можуть бути отримані при дуже повільному
стисненні газу за умови відсутності
центрів конденсації у вигляді пилинок,
крапель туману та інших частинок. Ділянка
bd
ізотерми Ван-дер-Ваальса між точками
b
і d
не має фізичного змісту, оскільки там
зотерми,
побудовані за рівнянням Ван-дер-Ваальса,
показані на рис. 1. Хвилеподібна ділянка
ізотерми abcde
відповідає нестійким станам: стани між
a
і b
відповідають пересиченій
(переохолодженій) парі
і можуть бути отримані при дуже повільному
стисненні газу за умови відсутності
центрів конденсації у вигляді пилинок,
крапель туману та інших частинок. Ділянка
bd
ізотерми Ван-дер-Ваальса між точками
b
і d
не має фізичного змісту, оскільки там
![]() ,
а це відповідає збільшенню тиску зі
збільшенням об’єму. Ділянка de
ізотерми
відповідає перегрітій
рідині.
Така ситуація може бути реалізована
повільним нагріванням дуже чистої
рідини до температури, вищої від кипіння
при даному тиску. Якщо в перегріту рідину
вкинути домішки, або струсонути то вона
вибуховим чином миттєво закипає.
,
а це відповідає збільшенню тиску зі
збільшенням об’єму. Ділянка de
ізотерми
відповідає перегрітій
рідині.
Така ситуація може бути реалізована
повільним нагріванням дуже чистої
рідини до температури, вищої від кипіння
при даному тиску. Якщо в перегріту рідину
вкинути домішки, або струсонути то вона
вибуховим чином миттєво закипає.
Дійсні ізотерми реального газу зображені на рис. 2. Горизонтальна ділянка відповідає перетворенню газу в рідину, це відбувається при постійних температурі і тиску (процес a-e). Тиск не змінюється тому, що об’єм зменшується шляхом часткової конденсації газової фази. У точці е весь газ (пара) перетворюється у рідину і подальше стиснення незначно зменшує об’єм рідини.
З підвищенням температури горизонтальна ділянка ізотерм, на якій рідина і газ при даній температурі перебувають у рівновазі, зменшується, а точки а і е зливаються у точку K в цій точці ізотерма має перегин і горизонтальну дотичну. Точку K називають критичною, а відповідні їй параметри ркр , vкр , і Ткр – критичними.Критичні параметри властиві кожній речовині і зазвичай визначаються експериментально. Їх значення для деяких речовин наведені у табл. 1.
П ри
критичній температурі перехід
газоподібного стану в рідину або навпаки
відбувається без зміни будь-яких фізичних
властивостей (у даному випадку щільності
рідини і газу) і у
критичній точці зникає різниця між
рідиною і газом.
ри
критичній температурі перехід
газоподібного стану в рідину або навпаки
відбувається без зміни будь-яких фізичних
властивостей (у даному випадку щільності
рідини і газу) і у
критичній точці зникає різниця між
рідиною і газом.
При вищих температурах
(![]() )
ізотерми
реального газу наближаються до ізотерм
ідеального газу, а ділянка ізотерми з
двофазним станом відсутня. Звідси
випливає, що
при надкритичних температурах газ не
може бути перетворений у рідину шляхом
його ізотермічного
стиснення.
)
ізотерми
реального газу наближаються до ізотерм
ідеального газу, а ділянка ізотерми з
двофазним станом відсутня. Звідси
випливає, що
при надкритичних температурах газ не
може бути перетворений у рідину шляхом
його ізотермічного
стиснення.
Таблиця 1
Значення критичних параметрів деяких речовин
Речовина |
|
ркр, МПа |
|
Водень |
-240,7 |
1,25 |
30 |
Азот |
-147,0 |
3,30 |
311 |
Кисень |
-118,0 |
4,87 |
430 |
Вуглекислота |
31,0 |
7,15 |
460 |
Вода |
374,15 |
22,13 |
315 |
З’єднавши точки е, е', е'', ...( див. рис. 2), отримаємо криву, яка відділяє ділянку рідинних станів (лівіше e-k) від ділянки двофазного стану „рідина + газ” (правіше e-k). Крива e-k називається граничною кривою рідини. Аналогічно з’єднавши точки а, а', а'', ..., отримуємо граничну криву пари, яка відділяє ділянку у двофазного стану від ділянки газоподібних (пари).
Отже, граничні криві e-k і k-a ділять площу ”p-v” діаграми на три ділянки:
І – рідких станів;
ІІ – двофазного стану (рідина + газ);
ІІІ – газоподібних станів.
Відомо, що будь-яка речовина в залежності від зовнішніх умов (тиску і температури) може знаходитися у твердій, рідкій і газоподібній фазах.
Фазою називають однорідну за своїми фізичними властивостями та хімічним складом частину т.д.с. (слід розрізняти фазу і агрегатний стан).
Приклади: водяна пара, вода , лід – три різні фази молекулярної сполуки води у різних агрегатних станах – газоподібному, рідкому та твердому.
Якщо у рівновазі знаходяться дві або більше фаз, то такий стан називається фазовою рівновагою.
Cтан, у якому перебувають у рівновазі тверда, рідка і газоподібна фази речовини, називається потрійною точкою.
Перехід речовини з одної фази в іншу називається фазовим переходом, або фазовим перетворенням.
Приклади фазового переходів: кипіння - конденсація, кристалізація - плавлення.
Через те, що на термодинамічних діаграмах станів („p-v”, „Т-s” та ін.) для реального газу, на відміну від таких же для ідеального газу відображені стани, які відповідають різним фазам, їх ще називають фазовими діаграмами.
Правило фаз Гібса
У загальному випадку число фаз, що можуть одночасно співіснувати у рівновазі, задається співвідношенням
m
![]() n+2,
n+2,
m – число співіснуючих фаз, n – число компонент у системі. Для однокомпонентної системи (n=1), наприклад води, як ми вже знаємо, m = 3 , тобто у рівновазі, в потрійній точці, одночасно можуть знаходитися три фази.
При фазовому переході повинні виконуватися умови механічної та теплової рівноваги фаз, тобто тиск і температура у всіх частинах т.д.с. повинні бути однаковими.
Рівноважні процеси ( у т.ч. і фазові переходи) підкоряються принципу Ле – Шательє: якщо на систему, що знаходиться в стані рівноваги, діють зовнішні чинники, що виводять її зі стану рівноваги, то рівновага т.д.с. зміщується у напрямі ослаблення зовнішньої дії.
Зв'язок між сталими Ван-дер-Ваальса та критичними параметрами
Між критичними параметрами та сталими Ван-дер-Ваальса існує зв'язок:
![]() ;
;
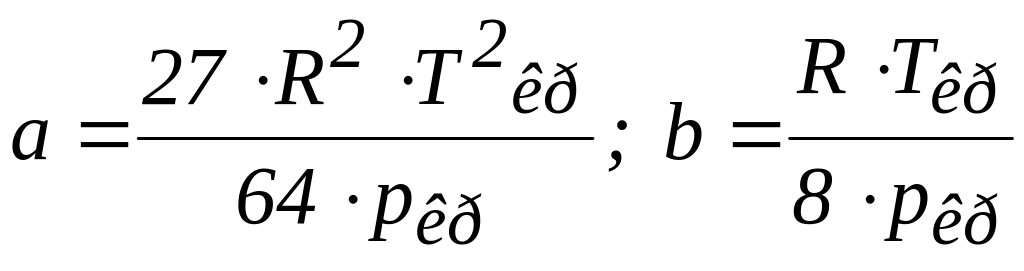 .
.
Величини pкр і Ткр , які входять у (7.1), визначають експериментально.
Після підстановки цих виразів у рівняння Ван-дер-Ваальса отримуємо канонічний (критеріальний) вигляд для нього
![]() (2)
(2)
![]() - безрозмірні
(зведені) змінні.
- безрозмірні
(зведені) змінні.
Стани різних газів, у яких безрозмірні (зведені) параметри однакові, називають відповідними.
Речовини, які перебувають у таких станах, називаються термодинамічно подібними. Користуючись цією подібністю властивостей, можна оцінювати властивості будь-якого газу за відомими властивостями іншого.
Рівняння Ван-дер-Ваальса лише приблизно узгоджується з експериментальними даними проте воно якісно правильно описує поведінку реального газу і дозволяє встановити ряд суттєвих закономірностей. Зокрема, дане рівняння відображає неперервність взаємних перетворень газоподібного, рідкого та існування критичного станів речовини.
Проблема побудови рівняння стану реальних речовин дуже актуальна і вирішується методами статистичної фізики.
Одним з результатів є рівняння Маєра – Боголюбова:
![]() (3)
(3)
В, С, D, … - перший, другий та третій і т. д. віріальні коефіцієнти, які залежать від температури і природи газу і визначаються експериментально.
Перший і другий віріальні коефіцієнти враховують парні взаємодії молекул, третій – взаємодії трьох і т. д. Порівнюючи рівняння (1) та (3) бачимо, що (1) відповідає наближенню (3) з врахуванням поправок В(Т) та С(Т).
